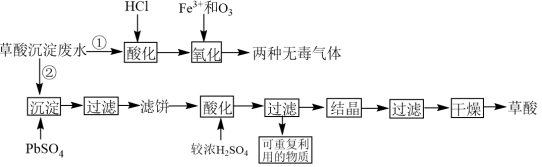
稀土工业生产中,草酸(H2C2O4)是稀土元素沉淀剂。工业生产中会产生稀土草酸沉淀废水,其主要成分为盐酸和草酸的混合溶液及微量的草酸稀土杂质等。此废水腐蚀性较强,直接排放会造成环境污染。工业上处理废水的方法包括“①氧化法”和“②沉淀法”。相关工业流程如图所示:
25℃时,各物质的溶度积常数如下表:
回答下列问题:
(1)“①氧化法”中Fe3+是反应的催化剂,反应产生了两种无毒气体。则草酸和臭氧反应的化学方程式为_______ 。
(2)“氧化”步骤中,当废水pH=1.0时,单位时间内的草酸去除率接近55%;当废水的pH上升至5.5时,单位时间内的草酸去除率只有5%,其原因是_______ 。为了使加入的17.5mg·L-1的Fe3+催化效果达到最佳,废水酸化时应将pH调整至小于_______ (已知lg2=0.3,1g5=0.7)。
(3)“②沉淀法”:将1.5mol PbSO4沉淀剂加到1L含有0.1mol·L-1草酸的模拟废水中。沉淀时发生的离子反应为PbSO4(s)+H2C2O4(aq)=PbC2O4(s)+2H+(aq)+ (aq)。请计算此反应的平衡常数K=
(aq)。请计算此反应的平衡常数K=_______ 。
(4)滤饼“酸化”“过滤”后可重复利用的物质为_______ (填化学式)。
(5)比较“①氧化法”和“②沉淀法”,从原料利用率角度分析,方法_______ (填“①”或“②”)更好,原因是_______ 。

25℃时,各物质的溶度积常数如下表:
| Ksp[Fe(OH)3] | Ksp(PbSO4) | Ksp(PbC2O4) | Ka1(H2C2O4)] | Ka2(H2C2O4) |
| 2.5×10-39 | 2.0×10-8 | 5.0×10-10 | 6.0×10-2 | 6.25×10-5 |
(1)“①氧化法”中Fe3+是反应的催化剂,反应产生了两种无毒气体。则草酸和臭氧反应的化学方程式为
(2)“氧化”步骤中,当废水pH=1.0时,单位时间内的草酸去除率接近55%;当废水的pH上升至5.5时,单位时间内的草酸去除率只有5%,其原因是
(3)“②沉淀法”:将1.5mol PbSO4沉淀剂加到1L含有0.1mol·L-1草酸的模拟废水中。沉淀时发生的离子反应为PbSO4(s)+H2C2O4(aq)=PbC2O4(s)+2H+(aq)+
 (aq)。请计算此反应的平衡常数K=
(aq)。请计算此反应的平衡常数K=(4)滤饼“酸化”“过滤”后可重复利用的物质为
(5)比较“①氧化法”和“②沉淀法”,从原料利用率角度分析,方法
更新时间:2021-02-23 20:55:02
|
相似题推荐
解答题-实验探究题
|
困难
(0.15)
解题方法
【推荐1】锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231 ℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33 ℃、沸点为114 ℃。请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为________ 。
(2)用于微电子器件生产的锡粉纯度测定:
①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
②加入过量的Fe2(SO4)3;
③用0.1 000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是__________________ ;此锡粉样品中锡的质量分数:____________ 。
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
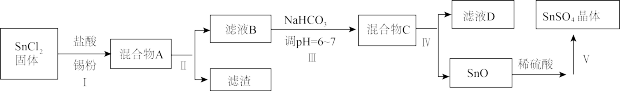
①步骤Ⅰ加入Sn粉的作用:____________________ 及调节溶液pH。
②步骤Ⅱ用到的玻璃仪器有烧杯、________________________ 。
③步骤Ⅲ生成SnO的离子方程式:__________________________ 。
④步骤Ⅳ中检验SnO是否洗涤干净的操作是___________________ ,证明已洗净。
⑤步骤Ⅴ操作依次为___________________ 、过滤、洗涤、低温干燥。
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为:_____________ 。实验室欲用下图装置制备少量SnCl4(夹持装置略),该装置存在明显缺陷,改进方法是_______________
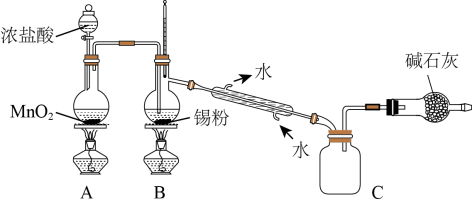
(5)利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是______________________ 。
(1)元素锡比同主族碳的周期数大3,锡的原子序数为
(2)用于微电子器件生产的锡粉纯度测定:
①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
②加入过量的Fe2(SO4)3;
③用0.1 000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
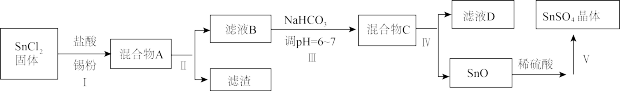
①步骤Ⅰ加入Sn粉的作用:
②步骤Ⅱ用到的玻璃仪器有烧杯、
③步骤Ⅲ生成SnO的离子方程式:
④步骤Ⅳ中检验SnO是否洗涤干净的操作是
⑤步骤Ⅴ操作依次为
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为:

(5)利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
解题方法
【推荐2】常温下钛的化学活性很小,在较高温度下可与多种物质反应。工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下:
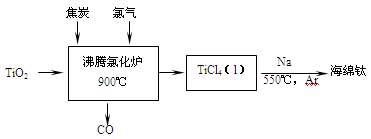
(1)TiCl4遇水强烈水解,写出其水解的化学方程式___________________ 。
(2)①若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是___________ 。
②Cl2含量检测仪工作原理如下图,则Cl2在Pt电极放电的电极反应式为_______ 。

③实验室也可用KClO3和浓盐酸制取Cl2,方程式为:KClO3+ 6HCl(浓) =" KCl" + 3Cl2↑+ 3H2O。
当生成6.72LCl2(标准状况下)时,转移的电子的物质的量为____ mol。
(3)一定条件下CO可以发生如下反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g) △H。
CH3OCH3(g)+H2O(g) △H。
①该反应的平衡常数表达式为K=_____________ 。
②将合成气以n(H2)/n(CO)=2通入1 L的反应器中,CO的平衡转化率随温度、压强变化关系如图所示,下列判断正确的是___________ (填序号)。
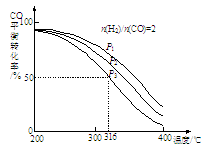
a.△H <0
b.P1<P2<P3
c.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%
③采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(简称DME)。观察下图回答问题。
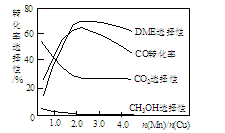
催化剂中n(Mn)/n(Cu)约为___________ 时最有利于二甲醚的合成。

(1)TiCl4遇水强烈水解,写出其水解的化学方程式
(2)①若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是
②Cl2含量检测仪工作原理如下图,则Cl2在Pt电极放电的电极反应式为

③实验室也可用KClO3和浓盐酸制取Cl2,方程式为:KClO3+ 6HCl(浓) =" KCl" + 3Cl2↑+ 3H2O。
当生成6.72LCl2(标准状况下)时,转移的电子的物质的量为
(3)一定条件下CO可以发生如下反应:4H2(g)+2CO(g)
 CH3OCH3(g)+H2O(g) △H。
CH3OCH3(g)+H2O(g) △H。①该反应的平衡常数表达式为K=
②将合成气以n(H2)/n(CO)=2通入1 L的反应器中,CO的平衡转化率随温度、压强变化关系如图所示,下列判断正确的是

a.△H <0
b.P1<P2<P3
c.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%
③采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(简称DME)。观察下图回答问题。

催化剂中n(Mn)/n(Cu)约为
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
名校
解题方法
【推荐3】二氧化钒(VO2)是一种新型热敏材料,实验室以V2O5为原料合成用于制备VO2的氧钒(Ⅳ)碱式碳酸铵晶体{化学式为(NH4)5[(VO)6(CO3)4(OH)9]•10H2O},过程如图:

已知:+4价钒在弱酸性条件下具有还原性,VO2+能被O2氧化。回答下列问题:
(1)步骤ⅰ中生成VOCl2同时生成N2的化学方程式为_____ 。
(2)常温下,只用浓盐酸与V2O5反应也能制备VOCl2溶液,但该方法未被推广,从环保角度分析该方法未被推广的主要原因是_____ (用化学方程式说明)。
(3)步骤ii可用如图仪器组装完成。
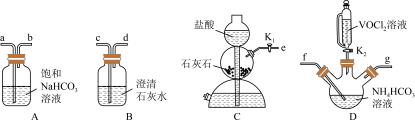
①装置D中盛放NH4HCO3溶液的仪器名称是_____ ;
②反应前通数分钟CO2的目的是_____ 。上述装置从左到右的连接顺序为_____ (用各接口字母表示)。
③反应结束后,将三颈烧瓶置于CO2保护下的干燥器中,静置后可得到紫红色晶体,然后抽滤,先用饱和NH4HCO3溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。检验晶体已经洗涤干净的操作是_____ 。
(4)测定氧钒(Ⅳ)碱式碳酸铵晶体粗产品中钒的含量。
称量wg样品于锥形瓶中,用30mL稀硫酸溶解后,加入稍过量的0.01mol/LKMnO4溶液,充分反应后,再加入稍过量的2%NaNO2溶液,再加入适量尿素除去过量的NaNO2,最后用1mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,重复实验两次。消耗滴定液的体积如表:
已知:滴定反应为VO +Fe2++2H+=VO2++Fe3++H2O
+Fe2++2H+=VO2++Fe3++H2O
①滴定时,向锥形瓶中加入几滴_____ (填化学式)溶液作指示剂。
②粗产品中钒的质量分数为_____ %。
③下列情况会导致所测钒元素的质量分数可能偏小的是_____ (填序号)。
A.称量样品时,样品与砝码的位置放颠倒了
B.(NH4)2Fe(SO4)2标准溶液中部分Fe2+被氧化
C.滴定过程中,往锥形瓶内加入少量蒸馏水
D.滴定达终点时发现滴定管尖嘴内有气泡

已知:+4价钒在弱酸性条件下具有还原性,VO2+能被O2氧化。回答下列问题:
(1)步骤ⅰ中生成VOCl2同时生成N2的化学方程式为
(2)常温下,只用浓盐酸与V2O5反应也能制备VOCl2溶液,但该方法未被推广,从环保角度分析该方法未被推广的主要原因是
(3)步骤ii可用如图仪器组装完成。

①装置D中盛放NH4HCO3溶液的仪器名称是
②反应前通数分钟CO2的目的是
③反应结束后,将三颈烧瓶置于CO2保护下的干燥器中,静置后可得到紫红色晶体,然后抽滤,先用饱和NH4HCO3溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。检验晶体已经洗涤干净的操作是
(4)测定氧钒(Ⅳ)碱式碳酸铵晶体粗产品中钒的含量。
称量wg样品于锥形瓶中,用30mL稀硫酸溶解后,加入稍过量的0.01mol/LKMnO4溶液,充分反应后,再加入稍过量的2%NaNO2溶液,再加入适量尿素除去过量的NaNO2,最后用1mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,重复实验两次。消耗滴定液的体积如表:
| 实验次数 | 滴定前读数/mL | 滴定后读数/mL |
| 1 | 0.00 | 19.99 |
| 2 | 1.10 | 21.10 |
| 3 | 1.56 | 21.57 |
 +Fe2++2H+=VO2++Fe3++H2O
+Fe2++2H+=VO2++Fe3++H2O①滴定时,向锥形瓶中加入几滴
②粗产品中钒的质量分数为
③下列情况会导致所测钒元素的质量分数可能偏小的是
A.称量样品时,样品与砝码的位置放颠倒了
B.(NH4)2Fe(SO4)2标准溶液中部分Fe2+被氧化
C.滴定过程中,往锥形瓶内加入少量蒸馏水
D.滴定达终点时发现滴定管尖嘴内有气泡
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
解题方法
【推荐1】CO2转化为高附加值化学品是科学家研究的重要课题。异丁烯[CH2=C(CH3)2]作为汽油添加剂的主要成分,可利用异丁烷与CO2反应来制备。
反应I:CH3CH(CH3)CH3(g)+CO2(g) CH2=C(CH3)2(g)+H2O(g)+CO(g) ΔH1=+165.2kJ·mol-1
CH2=C(CH3)2(g)+H2O(g)+CO(g) ΔH1=+165.2kJ·mol-1
反应II:CH3CH(CH3)CH3(g) CH2=C(CH3)2(g)+H2(g) ΔH2
CH2=C(CH3)2(g)+H2(g) ΔH2
回答下列问题:
(1)已知:CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.2kJ·mol-1,则ΔH2=
CO2(g)+H2(g) ΔH=-41.2kJ·mol-1,则ΔH2=___________ 。
(2)向1.0L恒容密闭容器中加入1molCH3CH(CH3)CH3(g)和1molCO2(g),利用反应I制备异丁烯。已知正反应速率可表示为v正=k正c[CH3CH(CH3)CH3]·c(CO2),逆反应速率可表示为v逆=k逆c[CH2=c(CH3)2]·c(H2O)·c(CO),其中k正、k逆为速率常数。
①图中能够代表k逆的曲线为_____ (填“L1”“L2”“L3”或“L4”)。
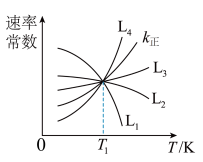
②温度为T1时,该反应的化学平衡常数K=___________ 。
(3)CH4-CO2重整技术是实现“碳中和”的一种理想的CO2利用技术,反应为:CO2(g)+CH4(g) 2CO(g)+2H2(g)。在pMPa时,将CO2和CH4按物质的量之比为1:1充入密闭容器中,分别在无催化剂及ZrO2催化下反应相同时间,测得CO2的转化率与温度的关系如图所示:
2CO(g)+2H2(g)。在pMPa时,将CO2和CH4按物质的量之比为1:1充入密闭容器中,分别在无催化剂及ZrO2催化下反应相同时间,测得CO2的转化率与温度的关系如图所示:
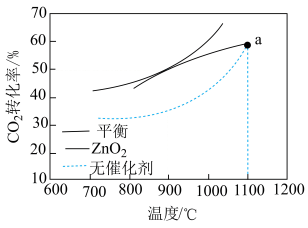
①a点CO2转化率相等的原因是________ 。
②在pMPa、900°C、ZrO2催化条件下,将1molCO2、1molCH4、n molH2O充入密闭容器,CO2的平衡转化率为α,此时压强平衡常数Kp=_______ (以分压表示,分压=总压×物质的量分数;写出含α、n、p的计算表达式)。
(4)利用电化学可以将CO2有效转化为HCOO-,装置如图所示。

①在该装置中,左侧Pt电极上的电极反应式:_________ 。
②装置工作时,阴极除有HCOO-生成外,还可能生成副产物降低电解效率。阴极生成的副产物可能是________ ,标准状况下,当阳极生成O2的体积为224mL时,测得阴极区内的c(HCOO-)=0.015mol/L,则电解效率_______ 。(忽略电解前后溶液体积的变化)已知:电解效率=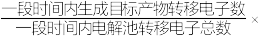 100%。
100%。
反应I:CH3CH(CH3)CH3(g)+CO2(g)
 CH2=C(CH3)2(g)+H2O(g)+CO(g) ΔH1=+165.2kJ·mol-1
CH2=C(CH3)2(g)+H2O(g)+CO(g) ΔH1=+165.2kJ·mol-1反应II:CH3CH(CH3)CH3(g)
 CH2=C(CH3)2(g)+H2(g) ΔH2
CH2=C(CH3)2(g)+H2(g) ΔH2回答下列问题:
(1)已知:CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH=-41.2kJ·mol-1,则ΔH2=
CO2(g)+H2(g) ΔH=-41.2kJ·mol-1,则ΔH2=(2)向1.0L恒容密闭容器中加入1molCH3CH(CH3)CH3(g)和1molCO2(g),利用反应I制备异丁烯。已知正反应速率可表示为v正=k正c[CH3CH(CH3)CH3]·c(CO2),逆反应速率可表示为v逆=k逆c[CH2=c(CH3)2]·c(H2O)·c(CO),其中k正、k逆为速率常数。
①图中能够代表k逆的曲线为

②温度为T1时,该反应的化学平衡常数K=
(3)CH4-CO2重整技术是实现“碳中和”的一种理想的CO2利用技术,反应为:CO2(g)+CH4(g)
 2CO(g)+2H2(g)。在pMPa时,将CO2和CH4按物质的量之比为1:1充入密闭容器中,分别在无催化剂及ZrO2催化下反应相同时间,测得CO2的转化率与温度的关系如图所示:
2CO(g)+2H2(g)。在pMPa时,将CO2和CH4按物质的量之比为1:1充入密闭容器中,分别在无催化剂及ZrO2催化下反应相同时间,测得CO2的转化率与温度的关系如图所示:
①a点CO2转化率相等的原因是
②在pMPa、900°C、ZrO2催化条件下,将1molCO2、1molCH4、n molH2O充入密闭容器,CO2的平衡转化率为α,此时压强平衡常数Kp=
(4)利用电化学可以将CO2有效转化为HCOO-,装置如图所示。

①在该装置中,左侧Pt电极上的电极反应式:
②装置工作时,阴极除有HCOO-生成外,还可能生成副产物降低电解效率。阴极生成的副产物可能是
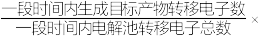 100%。
100%。
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
解题方法
【推荐2】甲烷水蒸气催化重整是制备高纯氢的方法之一、反应如下:
反应ⅰ:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH1=+206kJ·mol-1;
CO(g)+3H2(g) ΔH1=+206kJ·mol-1;
反应ⅱ:CH4(g)+2H2O(g) CO2(g)+4H2(g) ΔH2=+165kJ·mol-1。
CO2(g)+4H2(g) ΔH2=+165kJ·mol-1。
(1)反应ⅲ:CO2(g)+H2(g) CO(g)+H2O(g)的ΔH3=
CO(g)+H2O(g)的ΔH3=___________ ;若在一定温度下的容积固定的密闭容器中进行该反应,则可以提高CO2转化率的措施为___________ ,下列说法可以证明该反应已达到平衡状态的是___________ (填字母)。
a、v正(CO2)=v正(H2)
b、容器内气体压强不再改变
c、H2的浓度不再改变
d、CO和H2O的浓度之比为1∶1
(2)对于反应ⅰ,向体积为2L的恒容密闭容器中,按 =1:1投料。
=1:1投料。
①若在恒温条件下,反应达到平衡时CH4的转化率为50%,则平衡时容器内的压强与起始压强之比为___________ (最简单整数比)。
②其他条件相同时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应相同时间,CH4的转化率随反应温度的变化如图所示。a点___________ (填“是”或“不是")化学平衡状态,CH4的转化率:c点>b点,原因是___________ 。

(3)某科研小组研究了反应ⅱ的动力学,获得其速率方程v=k·cm(CH4)·c0.5(H2O),k为速率常数(只受温度影响),m为CH4的反应级数。在某温度下进行实验,测得各组分初浓度和反应初速率如下:
CH4的反应级数m=___________ ,当实验2进行到某时刻,测得c(H2O)=0.040mol·L-1,则此时的反应速率v=___________ (已知 )。
)。
(4)甲烷水蒸气催化重整制备高纯氢只发生反应ⅰ、反应ⅱ。在恒温、恒压条件下,1molCH4(g)和1molH2O(g)反应达平衡时,CH4(g)的转化率为a,CO2(g)的物质的量为bmol,则反应ⅰ的平衡常数Kx=___________ [写出含有a、b的计算式;对于反应mA(g)+nB(g) pC(g)+qD(g),Kx=
pC(g)+qD(g),Kx= ,x为物质的量分数]。
,x为物质的量分数]。
反应ⅰ:CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH1=+206kJ·mol-1;
CO(g)+3H2(g) ΔH1=+206kJ·mol-1;反应ⅱ:CH4(g)+2H2O(g)
 CO2(g)+4H2(g) ΔH2=+165kJ·mol-1。
CO2(g)+4H2(g) ΔH2=+165kJ·mol-1。(1)反应ⅲ:CO2(g)+H2(g)
 CO(g)+H2O(g)的ΔH3=
CO(g)+H2O(g)的ΔH3=a、v正(CO2)=v正(H2)
b、容器内气体压强不再改变
c、H2的浓度不再改变
d、CO和H2O的浓度之比为1∶1
(2)对于反应ⅰ,向体积为2L的恒容密闭容器中,按
 =1:1投料。
=1:1投料。①若在恒温条件下,反应达到平衡时CH4的转化率为50%,则平衡时容器内的压强与起始压强之比为
②其他条件相同时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应相同时间,CH4的转化率随反应温度的变化如图所示。a点

(3)某科研小组研究了反应ⅱ的动力学,获得其速率方程v=k·cm(CH4)·c0.5(H2O),k为速率常数(只受温度影响),m为CH4的反应级数。在某温度下进行实验,测得各组分初浓度和反应初速率如下:
| 实验序号 | c(H2O)/mol·L-1 | c(CH4)/mol·L-1 | v//mol·L-1·s-1 |
| 1 | 0.100 | 0.100 | 1.2×10-2 |
| 2 | 0.100 | 0.200 | 2.4×10-2 |
 )。
)。(4)甲烷水蒸气催化重整制备高纯氢只发生反应ⅰ、反应ⅱ。在恒温、恒压条件下,1molCH4(g)和1molH2O(g)反应达平衡时,CH4(g)的转化率为a,CO2(g)的物质的量为bmol,则反应ⅰ的平衡常数Kx=
 pC(g)+qD(g),Kx=
pC(g)+qD(g),Kx= ,x为物质的量分数]。
,x为物质的量分数]。
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
【推荐3】氯乙烯是合成聚氯乙烯的单体,制取氯乙烯的方法有乙炔加成法、乙烯氧氯化法等。
(1)乙炔加成法包含的主要反应如下:
CaO+3C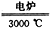 CaC2+CO↑
CaC2+CO↑
CaC2+2H2O→Ca(OH)2+HC≡CH↑
HC≡CH+HCl CH2=CHCl
CH2=CHCl
①CaC2的电子式为__________ 。
②该方法具有设备简单、投资低、收率高等优点;其缺点是_________________ (列举2点)。
(2)乙烯氧氯化法包含的反应如下:
CH2=CH2(g)+Cl2(g)→ClCH2-CH2Cl(g) △H1
2CH2=CH2(g)+4HCl(g)+O2(g)→2ClCH2-CH2Cl(g)+2H2O(g)△H2
ClCH2-CH2Cl(g)→CH2=CHCl(g)+HCl(g)△H3
总反应:4CH2=CH2(g)+2Cl2(g)+O2(g)→4CH2=CHCl(g)+2H2O(g) △H4
则△H4=__________ (用含△H1、△H2、△H3 的代数式表示)。
(3)将一定量的1,2-二氯乙烷充入密闭容器中,发生反应:ClCH2-CH2Cl(g)→CH2=CHCl(g)+HCl(g),两 种 物 质 的物 质 的 量分数 (w) 与 温度的关系如图所示。

①温度低于290℃时,氯乙烯的产率为0,其原因是______________________ ;该反应的△H________ (填“>”或“<”) 0。
②已知A点的总压强为101kPa,则A点对应温度下的平衡常数Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,保留小数点后两位数字)。
③不考虑反应的选择性,若要进一步提高氯乙烯的平衡产率,则可以采取的措施是_____________ (任写两条)。
(1)乙炔加成法包含的主要反应如下:
CaO+3C
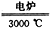 CaC2+CO↑
CaC2+CO↑CaC2+2H2O→Ca(OH)2+HC≡CH↑
HC≡CH+HCl
 CH2=CHCl
CH2=CHCl①CaC2的电子式为
②该方法具有设备简单、投资低、收率高等优点;其缺点是
(2)乙烯氧氯化法包含的反应如下:
CH2=CH2(g)+Cl2(g)→ClCH2-CH2Cl(g) △H1
2CH2=CH2(g)+4HCl(g)+O2(g)→2ClCH2-CH2Cl(g)+2H2O(g)△H2
ClCH2-CH2Cl(g)→CH2=CHCl(g)+HCl(g)△H3
总反应:4CH2=CH2(g)+2Cl2(g)+O2(g)→4CH2=CHCl(g)+2H2O(g) △H4
则△H4=
(3)将一定量的1,2-二氯乙烷充入密闭容器中,发生反应:ClCH2-CH2Cl(g)→CH2=CHCl(g)+HCl(g),两 种 物 质 的物 质 的 量分数 (w) 与 温度的关系如图所示。

①温度低于290℃时,氯乙烯的产率为0,其原因是
②已知A点的总压强为101kPa,则A点对应温度下的平衡常数Kp=
③不考虑反应的选择性,若要进一步提高氯乙烯的平衡产率,则可以采取的措施是
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
【推荐1】硅孔雀石是一种含铜矿石,含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质。以其为原料制取硫酸铜的工艺流程如图:
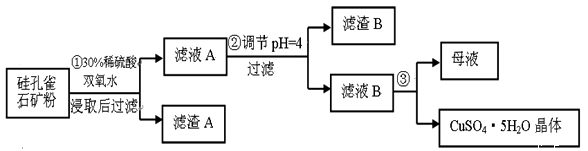
(1) 完成步骤①中稀硫酸与CuSiO3·2H2O反应的化学方程式:
CuSiO3·2H2O+H2SO4=CuSO4 +__________+H2O;双氧水的作用是 。
(2)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
步骤②中,调节pH=4时,所得滤渣B的成分的化学式为 ,滤液B中除Cu2+外, 还含有的金属阳离子是 。
(3)将滤液B通过 、 ,过滤,洗涤等操作可得到硫酸铜晶体。
(4)硫酸铜也可以用硫化铜和氧气在高温条件下化合制得,该反应的化学方程式 。

(1) 完成步骤①中稀硫酸与CuSiO3·2H2O反应的化学方程式:
CuSiO3·2H2O+H2SO4=CuSO4 +__________+H2O;双氧水的作用是 。
(2)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
(3)将滤液B通过 、 ,过滤,洗涤等操作可得到硫酸铜晶体。
(4)硫酸铜也可以用硫化铜和氧气在高温条件下化合制得,该反应的化学方程式 。
您最近一年使用:0次
解答题-无机推断题
|
困难
(0.15)
【推荐2】某混合物含有下列物质中的3种或更多种,各0.01 mol:(NH4)2SO3、NaCl、CaSO4、 K2CrO4、 Mg(NO3)2、 NH4Cl;将该混合物置于水中,充分反应后离心分离得到白色沉淀和0.1 dm3无色溶液。向该溶液中通入0.01 mol氨气,无沉淀生成:若将氨气换成0.01mol NaF,则有白色沉淀生成。指出该混合物中肯定存在的物质_____ 、肯定不存在的物质_____ 、不能判断是否存在的物质各有哪些______ 。并对肯定存在的物质简要说明理由______ 。
已知: K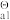 (H2SO3)=1.3 ×10-2 K
(H2SO3)=1.3 ×10-2 K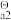 (H2SO3)=6.2 ×10-8 K
(H2SO3)=6.2 ×10-8 K (NH3·H2O)=1.8 ×10-5 K
(NH3·H2O)=1.8 ×10-5 K (CaSO4)=4.9 ×10-5 K
(CaSO4)=4.9 ×10-5 K (CaSO3)= 6.8 ×10-8 K
(CaSO3)= 6.8 ×10-8 K (MgSO3)=3.2 ×10-3 K
(MgSO3)=3.2 ×10-3 K (CaCrO4)=7.l ×10-4 K
(CaCrO4)=7.l ×10-4 K (CaF2)=5.3 ×10-9 K
(CaF2)=5.3 ×10-9 K (MgF2)= 5.2 ×10-11 K
(MgF2)= 5.2 ×10-11 K [Mg(OH)2]= 5.6 ×10-12 K
[Mg(OH)2]= 5.6 ×10-12 K [Ca(OH)2 ]=5.5 ×10-6
[Ca(OH)2 ]=5.5 ×10-6
已知: K
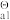 (H2SO3)=1.3 ×10-2 K
(H2SO3)=1.3 ×10-2 K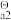 (H2SO3)=6.2 ×10-8 K
(H2SO3)=6.2 ×10-8 K (NH3·H2O)=1.8 ×10-5 K
(NH3·H2O)=1.8 ×10-5 K (CaSO4)=4.9 ×10-5 K
(CaSO4)=4.9 ×10-5 K (CaSO3)= 6.8 ×10-8 K
(CaSO3)= 6.8 ×10-8 K (MgSO3)=3.2 ×10-3 K
(MgSO3)=3.2 ×10-3 K (CaCrO4)=7.l ×10-4 K
(CaCrO4)=7.l ×10-4 K (CaF2)=5.3 ×10-9 K
(CaF2)=5.3 ×10-9 K (MgF2)= 5.2 ×10-11 K
(MgF2)= 5.2 ×10-11 K [Mg(OH)2]= 5.6 ×10-12 K
[Mg(OH)2]= 5.6 ×10-12 K [Ca(OH)2 ]=5.5 ×10-6
[Ca(OH)2 ]=5.5 ×10-6
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
解题方法
【推荐3】四川省钙芒硝矿(主要成分CaSO4•Na2SO4)资源丰富。钙芒硝矿可生产具有广泛用途的芒硝(Na2SO4•10H2O)和元明粉(Na2SO4),其简要生产流程如下图所示。
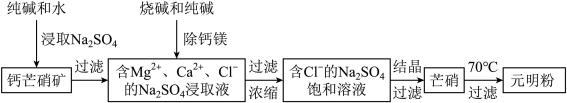
请回答下列问题:
(1)浸取Na2SO4时,加入少量Na2CO3可使钙芒硝矿中的部分CaSO4转化为CaCO3,破坏钙芒硝矿结构,从而促进Na2SO4的浸取。CaSO4能转化为CaCO3的原因是_________________________ 。
(2)向Na2SO4的浸取液中加入适量烧碱和纯碱,Ca2+和Mg2+分别生成①________ 、②_________ (填化学式)被过滤除去。
(3)根据下图溶解度曲线,可采用冷却结晶法从含少量NaCl的Na2SO4饱和溶液中制得芒硝的原因是___________________________________________________________________________ 。

(4)已知:25℃、101kPa时,
2C(s) + O2(g) ==2CO(g) ΔH1 = —222kJ/mol
4Na2SO3(s) == 3Na2SO4(s) + Na2S(s) ΔH2 = —122kJ/mol
2Na2SO3(s) + O2(g) == 2Na2SO4(s) ΔH 3= —572kJ/mol
元明粉经碳还原制备Na2S的热化学方程式是__________________________________________________ 。
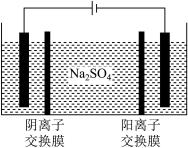
(5)如图,用惰性电极电解Na2SO4溶液,阳极区制得H2SO4溶液,阴极区制得NaOH溶液。其电解总反应的化学方程式是:______________________________ 。
(6)芒硝加热至70℃时,得到Na2SO4的饱和溶液(结晶水作溶剂,忽略加热过程中水的蒸发)和无水Na2SO4。若3220kg芒硝加热至70℃时,可析出元明粉(Na2SO4)的质量是________ kg。

请回答下列问题:
(1)浸取Na2SO4时,加入少量Na2CO3可使钙芒硝矿中的部分CaSO4转化为CaCO3,破坏钙芒硝矿结构,从而促进Na2SO4的浸取。CaSO4能转化为CaCO3的原因是
(2)向Na2SO4的浸取液中加入适量烧碱和纯碱,Ca2+和Mg2+分别生成①
(3)根据下图溶解度曲线,可采用冷却结晶法从含少量NaCl的Na2SO4饱和溶液中制得芒硝的原因是

(4)已知:25℃、101kPa时,
2C(s) + O2(g) ==2CO(g) ΔH1 = —222kJ/mol
4Na2SO3(s) == 3Na2SO4(s) + Na2S(s) ΔH2 = —122kJ/mol
2Na2SO3(s) + O2(g) == 2Na2SO4(s) ΔH 3= —572kJ/mol
元明粉经碳还原制备Na2S的热化学方程式是
(5)如图,用惰性电极电解Na2SO4溶液,阳极区制得H2SO4溶液,阴极区制得NaOH溶液。其电解总反应的化学方程式是:

(6)芒硝加热至70℃时,得到Na2SO4的饱和溶液(结晶水作溶剂,忽略加热过程中水的蒸发)和无水Na2SO4。若3220kg芒硝加热至70℃时,可析出元明粉(Na2SO4)的质量是
您最近一年使用:0次
【推荐1】铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中。
(1)铝粉和铁的氧化物(FeO-Fe2O3)可配成铝热剂用于焊接钢轨,反应的化学方程式是_______ 。
(2)以铝土矿(主要成分为Al2O3。含SiO2和Fe2O3等杂质)为原料生产铝和铵明矾晶体[NH4Al(SO4)2·12H2O]的一种工艺流程如下【已知:SiO2在“碱溶”时转化为铝硅酸钠(NaAlSiO4·nH2O)沉淀】。

①实验前,要将铝土矿粉碎的目的是_______ 。
②用氧化物的形式表示铝硅酸钠的化学式_______ 。
③步骤②涉及到的离子方程式是:_______ 。
④写出利用Al2O3制备金属Al的化学方程式:_______ 。
⑤若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为_______ 。
(1)铝粉和铁的氧化物(FeO-Fe2O3)可配成铝热剂用于焊接钢轨,反应的化学方程式是
(2)以铝土矿(主要成分为Al2O3。含SiO2和Fe2O3等杂质)为原料生产铝和铵明矾晶体[NH4Al(SO4)2·12H2O]的一种工艺流程如下【已知:SiO2在“碱溶”时转化为铝硅酸钠(NaAlSiO4·nH2O)沉淀】。

①实验前,要将铝土矿粉碎的目的是
②用氧化物的形式表示铝硅酸钠的化学式
③步骤②涉及到的离子方程式是:
④写出利用Al2O3制备金属Al的化学方程式:
⑤若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
【推荐2】五氧化二钒( )为橙黄色晶性粉末,在冶金、化工、催化等领域有重要应用,也是制备其他钒化合物的重要原料。实验室以含钒废料(主要成分为
)为橙黄色晶性粉末,在冶金、化工、催化等领域有重要应用,也是制备其他钒化合物的重要原料。实验室以含钒废料(主要成分为 ,还含有Fe、Cu、Mn、Si、AI等元素的氧化物以及有机物)为原料制备
,还含有Fe、Cu、Mn、Si、AI等元素的氧化物以及有机物)为原料制备 的一种流程如图所示:
的一种流程如图所示:
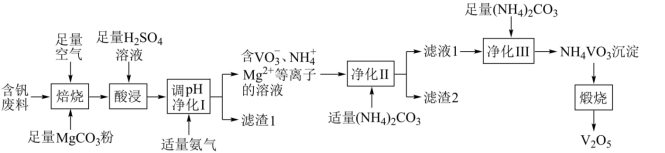
已知:①含钒离子在溶液中的存在形式与溶液pH的关系
②25℃时,难溶电解质的溶度积常数如表所示:
请回答下列问题:
(1)写出基态V原子的价层电子排布式:___________ 。
(2)“焙烧”的目的之一是将 转化成
转化成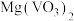 ,请写出转化的化学方程式:
,请写出转化的化学方程式:___________ 。
(3)“酸浸”时,为了提升各物质的浸出速率,除了适当升高温度外,还可以采取的措施是___________ (写一条即可)。
(4)25℃,“调pH净化Ⅰ”时需将 、
、 、
、 三种离子去除干净(浓度
三种离子去除干净(浓度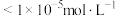 时视为去除干净)外,还需要考虑V的存在形式,则需调节pH范围为
时视为去除干净)外,还需要考虑V的存在形式,则需调节pH范围为___________ 。
(5)“净化Ⅱ”的目的是除 、
、 ,若该过程加入过量
,若该过程加入过量 ,可能导致的结果是
,可能导致的结果是___________ 。
(6)“滤液1”中加入 的目的是将
的目的是将 变成沉淀偏钒酸铵(
变成沉淀偏钒酸铵( ),简称“沉钒”。“沉钒”得到的
),简称“沉钒”。“沉钒”得到的 需进行洗涤、干燥,请写出证明
需进行洗涤、干燥,请写出证明 已洗净的实验操作及现象:
已洗净的实验操作及现象:___________ 。
(7)煅烧 得到的产物中,可以在该流程中循环利用的物质是
得到的产物中,可以在该流程中循环利用的物质是___________ 。
(8)为测定该产品的纯度,某同学准确称取 产品1.000g,加入过量稀硫酸使其完全转化成
产品1.000g,加入过量稀硫酸使其完全转化成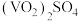 ,并配成100mL溶液(此溶液pH=1)。取10.00mL溶液用0.1000mol/L的
,并配成100mL溶液(此溶液pH=1)。取10.00mL溶液用0.1000mol/L的 标准溶液滴定,滴定到终点时消耗标准液5mL。已知滴定过程中
标准溶液滴定,滴定到终点时消耗标准液5mL。已知滴定过程中 被氧化为
被氧化为 ,该产品的纯度为
,该产品的纯度为___________ 。(计算结果保留两位小数)
 )为橙黄色晶性粉末,在冶金、化工、催化等领域有重要应用,也是制备其他钒化合物的重要原料。实验室以含钒废料(主要成分为
)为橙黄色晶性粉末,在冶金、化工、催化等领域有重要应用,也是制备其他钒化合物的重要原料。实验室以含钒废料(主要成分为 ,还含有Fe、Cu、Mn、Si、AI等元素的氧化物以及有机物)为原料制备
,还含有Fe、Cu、Mn、Si、AI等元素的氧化物以及有机物)为原料制备 的一种流程如图所示:
的一种流程如图所示:
已知:①含钒离子在溶液中的存在形式与溶液pH的关系
| 溶液pH | <4.0 | 6.0≤pH≤8.0 | >8.0 |
| 钒元素存在形式 |  |  | 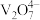 |
| 难溶电解质 |  | 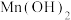 |  |  |  |  |
 | 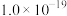 | 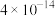 |  |  | 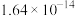 |  |
(1)写出基态V原子的价层电子排布式:
(2)“焙烧”的目的之一是将
 转化成
转化成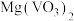 ,请写出转化的化学方程式:
,请写出转化的化学方程式:(3)“酸浸”时,为了提升各物质的浸出速率,除了适当升高温度外,还可以采取的措施是
(4)25℃,“调pH净化Ⅰ”时需将
 、
、 、
、 三种离子去除干净(浓度
三种离子去除干净(浓度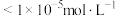 时视为去除干净)外,还需要考虑V的存在形式,则需调节pH范围为
时视为去除干净)外,还需要考虑V的存在形式,则需调节pH范围为(5)“净化Ⅱ”的目的是除
 、
、 ,若该过程加入过量
,若该过程加入过量 ,可能导致的结果是
,可能导致的结果是(6)“滤液1”中加入
 的目的是将
的目的是将 变成沉淀偏钒酸铵(
变成沉淀偏钒酸铵( ),简称“沉钒”。“沉钒”得到的
),简称“沉钒”。“沉钒”得到的 需进行洗涤、干燥,请写出证明
需进行洗涤、干燥,请写出证明 已洗净的实验操作及现象:
已洗净的实验操作及现象:(7)煅烧
 得到的产物中,可以在该流程中循环利用的物质是
得到的产物中,可以在该流程中循环利用的物质是(8)为测定该产品的纯度,某同学准确称取
 产品1.000g,加入过量稀硫酸使其完全转化成
产品1.000g,加入过量稀硫酸使其完全转化成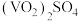 ,并配成100mL溶液(此溶液pH=1)。取10.00mL溶液用0.1000mol/L的
,并配成100mL溶液(此溶液pH=1)。取10.00mL溶液用0.1000mol/L的 标准溶液滴定,滴定到终点时消耗标准液5mL。已知滴定过程中
标准溶液滴定,滴定到终点时消耗标准液5mL。已知滴定过程中 被氧化为
被氧化为 ,该产品的纯度为
,该产品的纯度为
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
解题方法
【推荐3】苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:

制备苯乙酸的装置示意图如右(加热和夹持装置等略):
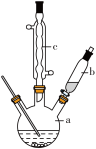
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是____________________ 。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器c的作用是____________________ ;仪器b的名称是____________________ ,其作用是____________________ 。反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是____________________ 。下列仪器中可用于分离苯乙酸粗品的是(填标号)。____________________
A 分液漏斗 B 漏斗 C 烧杯 D 直形冷凝管 E 玻璃棒
(3)提纯粗苯乙酸的方法是____________________ ,最终得到44g纯品,则苯乙酸的产率是____________________ 。
(4)用CuCl2•2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是____________________ 。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是____________________ 。
(6)在实际操作时,发现b中液体不容易滴下来,你认为应将b改为____________________ (填仪器名称)即可解决此问题。

制备苯乙酸的装置示意图如右(加热和夹持装置等略):

已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器c的作用是
A 分液漏斗 B 漏斗 C 烧杯 D 直形冷凝管 E 玻璃棒
(3)提纯粗苯乙酸的方法是
(4)用CuCl2•2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
(6)在实际操作时,发现b中液体不容易滴下来,你认为应将b改为
您最近一年使用:0次



