名校
解题方法
1 . 工业上以赤泥[主要成分是Sc2O3,另含有少量Fe2O3、SiO2(不溶于酸)、Al2O3等]为主要原料提取氧化钪,其工艺流程如图所示(P2O4是一种磷酸酯萃取剂,草酸化学式为H2C2O4)。
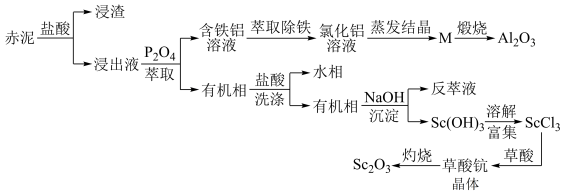
回答下列问题:
(1)赤泥经盐酸处理后所得“浸渣”主要成分为____ (化学式)。
(2)赤泥“盐酸酸浸”时不宜温度过高,原因是____ 。
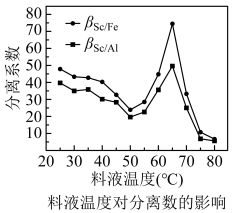
(3)P2O4萃取浸出液,其浓度、料液温度对萃取率的影响如表所示,萃取时P2O4最佳浓度及料液温度分别为____ 、____ ;
P2O4浓度对萃取率的影响如表:
料液温度对分离系数的影响如图:
(4)M经煅烧后可得到Al2O3,则M成分为____ 。
(5)为探究所得草酸钪晶体Sc2(C2O4)3·xH2O中结晶水的含量,取2.96g样品(纯度为75%),灼烧得到0.69gSc2O3固体,则x=____ 。
(6)草酸钪晶体在空气中灼烧分解反应方程式为____ 。

回答下列问题:
(1)赤泥经盐酸处理后所得“浸渣”主要成分为
(2)赤泥“盐酸酸浸”时不宜温度过高,原因是
(3)P2O4萃取浸出液,其浓度、料液温度对萃取率的影响如表所示,萃取时P2O4最佳浓度及料液温度分别为
P2O4浓度对萃取率的影响如表:
试验编号 | P2O4浓度/% | 分相情况 | 钪萃取率/% | 铁萃取率/% |
1-1 | 1 | 分相快 | 90.76 | 15.82 |
1-2 | 2 | 分相容易 | 91.53 | 19.23 |
1-3 | 3 | 分相容易 | 92.98 | 13.56 |
1-4 | 4 | 有第三相 | 90.69 | 30.12 |
1-5 | 5 | 轻微乳化 | 91.74 | 39.79 |
料液温度对分离系数的影响如图:

(4)M经煅烧后可得到Al2O3,则M成分为
(5)为探究所得草酸钪晶体Sc2(C2O4)3·xH2O中结晶水的含量,取2.96g样品(纯度为75%),灼烧得到0.69gSc2O3固体,则x=
(6)草酸钪晶体在空气中灼烧分解反应方程式为
您最近半年使用:0次
21-22高三上·广东广州·期末
2 . 铼(Re)是熔点和沸点较高的金属单质之一,用于制造高效能喷射引擎和火箭引擎。钼酸锂(Li2MoO4)的外观为白色结晶粉末,用于电极材料、金属陶瓷的制作。从辉钼矿氧化焙烧后的烟道灰(主要成分有SiO2、Re2O7、MoO3、CuO、Fe3O4)中提取铼粉和制钼酸锂的流程如下图所示。
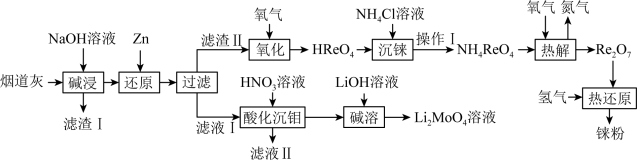
已知:
I.Re2O7是酸性氧化物,过铼酸(HReO4)是易溶于水的一元强酸,但不具有强氧化性。
Ⅱ.过铼酸铵(NH4ReO4)是白色片状晶体,微溶于冷水,溶于热水。
回答下列问题:
(1)“碱浸”时,Re2O7和MoO3分别与NaOH发生以下反应_______ (填写化学方程式)、MoO3+2NaOH=NaMoO4+H2O,则“滤渣I”的主要成分为_______ (填化学式)。
(2)“还原”时,Zn被氧化成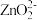 ,铼的化合物被还原生成难溶的2ReO2·2H2O,该反应的离子方程式为
,铼的化合物被还原生成难溶的2ReO2·2H2O,该反应的离子方程式为___________ 。
(3)“沉铼”时,加入热NH4C1溶液至产生白色沉淀,为使沉淀充分析出并分离得到纯净NH4ReO4晶体,“操作I”包括___________ 、___________ 、洗涤、干燥。
(4)“热解”时,发生反应的化学方程式为___________ 。
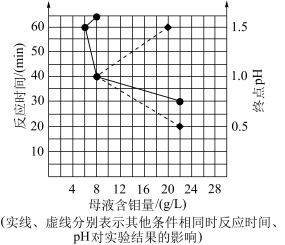
(5)“酸化沉钼”过程溶液pH和反应时间对钼酸的析出有很大影响,根据下图中数据判断最佳的“酸化沉钼”条件:反应时间为___________ min、pH为___________ 。
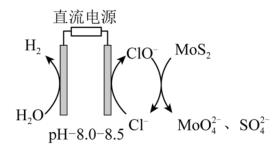
(6)电氧化法是一种极具发展前景的钼精矿冶金工艺,其工作原理如图所示。电解时,若维持电流强度为0.5A(相当于每秒通过5×10-6mol电子),电解90min,理论上消耗MoS2的质量为______ g。

已知:
I.Re2O7是酸性氧化物,过铼酸(HReO4)是易溶于水的一元强酸,但不具有强氧化性。
Ⅱ.过铼酸铵(NH4ReO4)是白色片状晶体,微溶于冷水,溶于热水。
回答下列问题:
(1)“碱浸”时,Re2O7和MoO3分别与NaOH发生以下反应
(2)“还原”时,Zn被氧化成
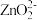 ,铼的化合物被还原生成难溶的2ReO2·2H2O,该反应的离子方程式为
,铼的化合物被还原生成难溶的2ReO2·2H2O,该反应的离子方程式为(3)“沉铼”时,加入热NH4C1溶液至产生白色沉淀,为使沉淀充分析出并分离得到纯净NH4ReO4晶体,“操作I”包括
(4)“热解”时,发生反应的化学方程式为
(5)“酸化沉钼”过程溶液pH和反应时间对钼酸的析出有很大影响,根据下图中数据判断最佳的“酸化沉钼”条件:反应时间为

(6)电氧化法是一种极具发展前景的钼精矿冶金工艺,其工作原理如图所示。电解时,若维持电流强度为0.5A(相当于每秒通过5×10-6mol电子),电解90min,理论上消耗MoS2的质量为

您最近半年使用:0次
2022-03-08更新
|
856次组卷
|
6卷引用:广东省华师附中、实验中学、深圳中学、广雅中学四校2021-2022学年高三上学期期末联考化学试题
(已下线)广东省华师附中、实验中学、深圳中学、广雅中学四校2021-2022学年高三上学期期末联考化学试题广东名校2021-2022学年高三下学期开学测试化学试题湖南省衡阳市第八中学2021-2022学年高三下学期开学考试(第六次月考)化学试题湖南省永州市第四中学2022届高三下学期期中考试化学试题湖南省株洲市第四中学2022-2023学年高三上学期第四次月考化学试题湖南省株洲市九方中学2022-2023学年高三上学期第二次月考化学试题
名校
3 . 碲(Te)具有两性特征,铜阳极泥是提取碲的主要原料,碲在铜阳极泥中主要以MezTeCMe表 示金属Cu、Pb、Au、Ag等)的形式存在。
(1)利用“氯化浸出-还原法”制备Te的工艺流程如下所示。
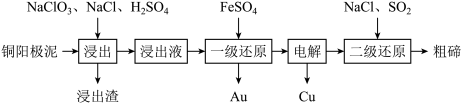
①浸出液的主要成分为CuSO4、HAuCu、H2TeO3,则浸出渣的主要成分 为____ (填化学式);“浸出”过程中有少量污染性气体生成,该气体是_______ (填物质名称)
②已知HAuCU是一种强酸,则“一级还原”过程中发生反应的离子方程式为_________ 。
③欲得到64g碲,则“二级还原”过程中至少需通入____ mol SO2。 “氧化碱浸-电解法”指的是在氧化剂的作用下,Cu2Te与NaOH溶液反应生成Na2TeO3和Cu(OH)2,经电解即可获得Te。
①以空气为氧化剂进行“氧化碱浸”的化学方程式为______ 。
②电解过程中,阴极的电极反应式为______ 。
③与“氯化浸出-还原法”相比“氧化碱浸-电解法”的优点是____ (任写一点)
(1)利用“氯化浸出-还原法”制备Te的工艺流程如下所示。

①浸出液的主要成分为CuSO4、HAuCu、H2TeO3,则浸出渣的主要成分 为
②已知HAuCU是一种强酸,则“一级还原”过程中发生反应的离子方程式为
③欲得到64g碲,则“二级还原”过程中至少需通入
①以空气为氧化剂进行“氧化碱浸”的化学方程式为
②电解过程中,阴极的电极反应式为
③与“氯化浸出-还原法”相比“氧化碱浸-电解法”的优点是
您最近半年使用:0次
解题方法
4 . 锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231 ℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33 ℃、沸点为114 ℃。请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为________ 。
(2)用于微电子器件生产的锡粉纯度测定:
①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
②加入过量的Fe2(SO4)3;
③用0.1 000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是__________________ ;此锡粉样品中锡的质量分数:____________ 。
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
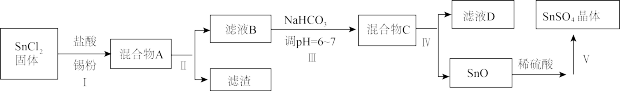
①步骤Ⅰ加入Sn粉的作用:____________________ 及调节溶液pH。
②步骤Ⅱ用到的玻璃仪器有烧杯、________________________ 。
③步骤Ⅲ生成SnO的离子方程式:__________________________ 。
④步骤Ⅳ中检验SnO是否洗涤干净的操作是___________________ ,证明已洗净。
⑤步骤Ⅴ操作依次为___________________ 、过滤、洗涤、低温干燥。
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为:_____________ 。实验室欲用下图装置制备少量SnCl4(夹持装置略),该装置存在明显缺陷,改进方法是_______________
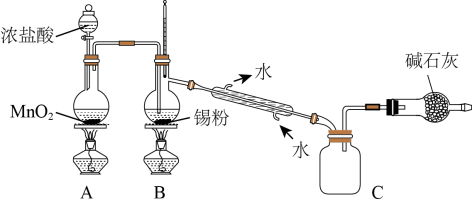
(5)利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是______________________ 。
(1)元素锡比同主族碳的周期数大3,锡的原子序数为
(2)用于微电子器件生产的锡粉纯度测定:
①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
②加入过量的Fe2(SO4)3;
③用0.1 000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
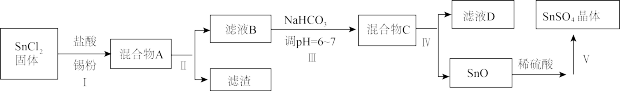
①步骤Ⅰ加入Sn粉的作用:
②步骤Ⅱ用到的玻璃仪器有烧杯、
③步骤Ⅲ生成SnO的离子方程式:
④步骤Ⅳ中检验SnO是否洗涤干净的操作是
⑤步骤Ⅴ操作依次为
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为:

(5)利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是
您最近半年使用:0次
2016-12-09更新
|
251次组卷
|
4卷引用:2017届广东省华侨中学高三上学期摸底考试理综化学试卷
解题方法
5 . 铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3、Fe2O3等杂质。以铬铁矿为原料制备重铬酸钾(K2Cr2O7)、重铬酸钠(Na2Cr2O7)的过程如下图所示。
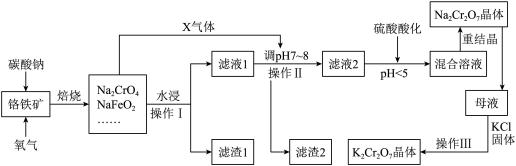
已知:①NaFeO2遇水强烈水解:NaFeO2 + 2H2O=NaOH + Fe(OH)3↓;
②Cr2O72-+ H2O 2CrO42- + 2H+。
2CrO42- + 2H+。
请回答:
(1)“焙烧”后的固体产物成分除Na2CrO4、NaFeO2外,还有__________ (填化学式)
等。写出“焙烧”过程中所发生的氧化还原反应的化学方程式_____________________ 。
(2)“焙烧”过程中,所产生X气体的电子式为_________________________ 。
(3)“水浸”步骤中,为了提高浸出率,可采取的措施有(请写出两条):_____ ;_____ 。
(4)滤渣1的主要成分是_______________ 。若要进一步分离滤渣2 中的可酸溶成分,请写出酸溶时发生反应的离子方程式_________________________________________ 。
(5)含Na2Cr2O7的“混合溶液”经过蒸发并冷却至30~40℃得到的Na2Cr2O7晶体还要进行重结晶,其目的是进一步减少晶体中杂质__________ (填化学式)的含量。
(6)操作Ⅲ由多步组成,向含Na2Cr2O7的母液中加入KCl固体,最终获得K2Cr2O7晶体的操作依次是____________ 、__________ 、过滤、75%乙醇水溶液洗涤、干燥。

已知:①NaFeO2遇水强烈水解:NaFeO2 + 2H2O=NaOH + Fe(OH)3↓;
②Cr2O72-+ H2O
 2CrO42- + 2H+。
2CrO42- + 2H+。请回答:
(1)“焙烧”后的固体产物成分除Na2CrO4、NaFeO2外,还有
等。写出“焙烧”过程中所发生的氧化还原反应的化学方程式
(2)“焙烧”过程中,所产生X气体的电子式为
(3)“水浸”步骤中,为了提高浸出率,可采取的措施有(请写出两条):
(4)滤渣1的主要成分是
(5)含Na2Cr2O7的“混合溶液”经过蒸发并冷却至30~40℃得到的Na2Cr2O7晶体还要进行重结晶,其目的是进一步减少晶体中杂质
(6)操作Ⅲ由多步组成,向含Na2Cr2O7的母液中加入KCl固体,最终获得K2Cr2O7晶体的操作依次是
您最近半年使用:0次
6 . 硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如下:
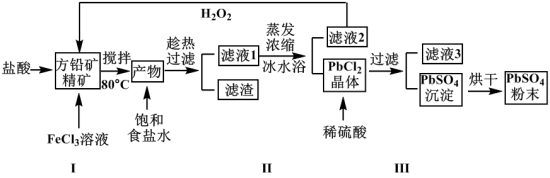
已知:(ⅰ)PbCl2(s)+2Cl-(aq)

 (aq) △H>0
(aq) △H>0
(ⅱ)Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×10-5
(ⅲ)Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、7.04
(1)步骤Ⅰ中FeCl3溶液与PbS反应生成PbCl2和S的离子方程式为_____________________ ,步骤Ⅰ中另一个反应是H2O2与FeCl2、盐酸反应生成FeCl3,实现FeCl3的重复利用,其离子方程式为__________ ,加入盐酸的另一个目的是为了控制pH在0.5~1.0,原因是_____________________________ 。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因___________________________ 。
(3)写出PbCl2晶体转化为PbSO4沉淀的离子方程式__________________________________ 。
(4)滤液3是_______________ 。
(5)铅蓄电池的电解液是稀硫酸(22%~28%),充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,铅蓄电池充电时阴极的电极反应式为________________________________ 。

已知:(ⅰ)PbCl2(s)+2Cl-(aq)


 (aq) △H>0
(aq) △H>0(ⅱ)Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×10-5
(ⅲ)Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、7.04
(1)步骤Ⅰ中FeCl3溶液与PbS反应生成PbCl2和S的离子方程式为
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因
(3)写出PbCl2晶体转化为PbSO4沉淀的离子方程式
(4)滤液3是
(5)铅蓄电池的电解液是稀硫酸(22%~28%),充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,铅蓄电池充电时阴极的电极反应式为
您最近半年使用:0次
14-15高三上·广东汕头·期中
解题方法
7 . 明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al 、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:

回答下列问题:
(1)明矾净水的原理是(用离子方程表示)_________________________________ 。
(2)操作Ⅰ是_____________ ,操作Ⅱ是蒸发浓缩、_______________ 、过滤、_____ 、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是(只用一种试剂)_________________ 。
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下Fe2+转化为Fe3+,MnO4-转化为Mn2+)_________________________________________________ 。
已知:生成氢氧化物沉淀的pH如下表所示
注:金属离子的起始浓度为0.1 mol·L-1
根据表中数据解释调pH=3的目的_______________________________________ 。
(5)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:_______________ 。滤渣2含有的物质是___________ 。

回答下列问题:
(1)明矾净水的原理是(用离子方程表示)
(2)操作Ⅰ是
(3)检验滤液A中是否存在Fe2+的试剂是(只用一种试剂)
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下Fe2+转化为Fe3+,MnO4-转化为Mn2+)
已知:生成氢氧化物沉淀的pH如下表所示
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1 mol·L-1
根据表中数据解释调pH=3的目的
(5)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:
您最近半年使用:0次



