20-21高二下·浙江·阶段练习
1 . 某兴趣小组对化合物X开展实验探究。
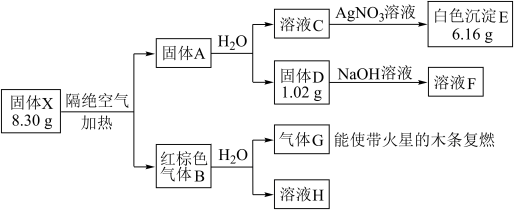
其中:X是易溶于水的强酸盐,由4种元素组成;D、E、G均为纯净物,B为混合物;溶液C、F、H均为单一溶质溶液,溶液H中含溶质0.06 mol,溶液C的焰色反应通过蓝色钴玻璃观察为紫色。
(1)组成X的4种元素是_______________ (填元素符号),E的化学式是______________ 。
(2)固体X隔绝空气加热分解的化学方程式____________________________ 。
(3)写出溶液F与少量溶液H反应的离子方程式____________________________ 。
(4)标况下,将红棕色气体B收集在一个大试管中,再倒插在水槽中,得到溶液的浓度为_______ mol/L (设溶质不扩散,)。
(5)写出红棕色气体B中的化合物气体(在答案中写出化学式)与溴蒸气的鉴别方法:______________ 。

其中:X是易溶于水的强酸盐,由4种元素组成;D、E、G均为纯净物,B为混合物;溶液C、F、H均为单一溶质溶液,溶液H中含溶质0.06 mol,溶液C的焰色反应通过蓝色钴玻璃观察为紫色。
(1)组成X的4种元素是
(2)固体X隔绝空气加热分解的化学方程式
(3)写出溶液F与少量溶液H反应的离子方程式
(4)标况下,将红棕色气体B收集在一个大试管中,再倒插在水槽中,得到溶液的浓度为
(5)写出红棕色气体B中的化合物气体(在答案中写出化学式)与溴蒸气的鉴别方法:
您最近一年使用:0次
名校
解题方法
2 . 已知还原性:SO >I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是 ( )
>I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是 ( )
 >I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是 ( )
>I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是 ( )A.当a=b时,发生的离子反应为SO +Cl2+H2O=SO +Cl2+H2O=SO +2H++2Cl- +2H++2Cl- |
B.当5a=4b时,发生的离子反应为4SO +2I-+5Cl2+4H2O=4SO +2I-+5Cl2+4H2O=4SO +I2+8H++10Cl- +I2+8H++10Cl- |
C.当a≤b≤ a时,反应中转移电子的物质的量n(e-)为a mol≤n(e-)≤3a mol a时,反应中转移电子的物质的量n(e-)为a mol≤n(e-)≤3a mol |
D.当a<b< a时,溶液中SO a时,溶液中SO 、I-与Cl-的物质的量之比为a∶(3a-2b)∶2b 、I-与Cl-的物质的量之比为a∶(3a-2b)∶2b |
您最近一年使用:0次
2020-08-18更新
|
3378次组卷
|
7卷引用:黑龙江省哈尔滨师范大学附属中学2020-2021学年高二下学期期末考试化学试题
黑龙江省哈尔滨师范大学附属中学2020-2021学年高二下学期期末考试化学试题(已下线)解密04 离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密04 离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)课时06 与量有关的离子方程式书写-2022年高考化学一轮复习小题多维练(全国通用)辽宁省实验中学2021-2022学年高一上学期11月期中阶段测试化学试题浙江省瑞安市上海新纪元高级中学2019-2020学年高一下学期期末考试化学试题(2)福建省泉州市永春第一中学2022-2023学年高一上学期期末考试化学试题
解题方法
3 . 铁和铝是两种重要的金属,它们的单质及其化合物有着各自的性质。
(1)现配制100mL 0.01mol∙L-1 FeCl3溶液,配制过程中需要的玻璃仪器除量筒、胶头滴管、烧杯外,还需要____________________ 。
(2)将FeCl3溶液滴入沸水可得到红褐色液体,反应的离子方程式是______________ 。此液体具有的性质是 _______ (填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b. 将该液体进行过滤,可得到红褐色固体
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)在隔绝空气的条件下,用镁条引燃Fe3O4粉末和铝粉的均匀混合物,使其充分反应。向充分反应后的剩余固体中加入足量的NaOH溶液,有大量气泡产生,所得剩余固体中除铁外还含有的固体物质是_________ (填化学式)。写出以上过程中涉及到的化学反应方程式,如果是离子反应,用离子反应方程式表示_________ 。
(4)“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强。
①该过程反应的化学方程式为______________________ 。
②人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平:
______ Cu2S+______ Fe3++____ H2O
_____ Cu2++______ Fe2++______ ( ) +______ SO42- 。
(5)羟胺(NH2OH)是一种还原剂,用25.00 mL 0.049 mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与24.5 mL 0.020 mol/L的KMnO4酸性溶液反应。则在上述反应中,羟胺的氧化产物是_____________________ 。
(1)现配制100mL 0.01mol∙L-1 FeCl3溶液,配制过程中需要的玻璃仪器除量筒、胶头滴管、烧杯外,还需要
(2)将FeCl3溶液滴入沸水可得到红褐色液体,反应的离子方程式是
a.光束通过该液体时形成光亮的“通路”
b. 将该液体进行过滤,可得到红褐色固体
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)在隔绝空气的条件下,用镁条引燃Fe3O4粉末和铝粉的均匀混合物,使其充分反应。向充分反应后的剩余固体中加入足量的NaOH溶液,有大量气泡产生,所得剩余固体中除铁外还含有的固体物质是
(4)“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强。
①该过程反应的化学方程式为
②人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平:

(5)羟胺(NH2OH)是一种还原剂,用25.00 mL 0.049 mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与24.5 mL 0.020 mol/L的KMnO4酸性溶液反应。则在上述反应中,羟胺的氧化产物是
您最近一年使用:0次
2016-12-09更新
|
808次组卷
|
2卷引用:湖南省常德市第二中学2020-2021学年高二下学期期末考试化学试题



