1 . 金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石( )转化为
)转化为 ,再进一步还原得到钛。
,再进一步还原得到钛。
直接氯化:
反应Ⅰ:
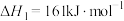
碳氯化:
反应Ⅱ: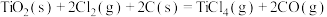
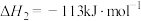
反应Ⅲ:

(1)直接氯化可以在___________ 下自发进行。
(2)反应Ⅳ 的
的 为
为___________ 
(3)科学家对以上反应做过热重分析,温度为1223K、氯气分压 的条件下,得到固体相对质量变化与时间的关系如下图所示:
的条件下,得到固体相对质量变化与时间的关系如下图所示:
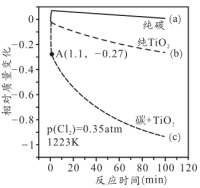
①用纯碳实验时,质量稍微有所增长,生成了含___________ 键的物质。
②用纯 实验时,所发生的化学方程式为
实验时,所发生的化学方程式为___________ ;该反应的活化能___________ (填“高”或“低”)。
③按照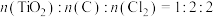 混合,实验发现1.1min内质量迅速减少,经光谱分析证明有光气(
混合,实验发现1.1min内质量迅速减少,经光谱分析证明有光气( )生成,固体中含有C和
)生成,固体中含有C和 ,则x=
,则x=___________ 。
④1.1min之后,光气( )继续反应,有理论认为机理如下:
)继续反应,有理论认为机理如下:

决速步骤的反应方程式为___________ ,1.1min之后发生的总反应方程式为___________ 。
(4)按照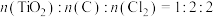 混合,平衡状态下不同物质的组成比与温度的关系如下图所示:
混合,平衡状态下不同物质的组成比与温度的关系如下图所示:
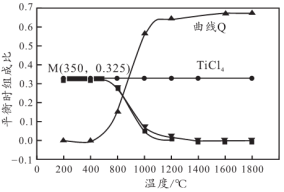
①曲线Q是___________ (填化学式)的变化图像。
②M点所发生的化学方程式是___________ 。
 )转化为
)转化为 ,再进一步还原得到钛。
,再进一步还原得到钛。直接氯化:
反应Ⅰ:

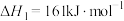
碳氯化:
反应Ⅱ:
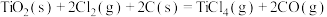
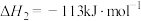
反应Ⅲ:


(1)直接氯化可以在
(2)反应Ⅳ
 的
的 为
为
(3)科学家对以上反应做过热重分析,温度为1223K、氯气分压
 的条件下,得到固体相对质量变化与时间的关系如下图所示:
的条件下,得到固体相对质量变化与时间的关系如下图所示:
①用纯碳实验时,质量稍微有所增长,生成了含
②用纯
 实验时,所发生的化学方程式为
实验时,所发生的化学方程式为③按照
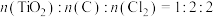 混合,实验发现1.1min内质量迅速减少,经光谱分析证明有光气(
混合,实验发现1.1min内质量迅速减少,经光谱分析证明有光气( )生成,固体中含有C和
)生成,固体中含有C和 ,则x=
,则x=④1.1min之后,光气(
 )继续反应,有理论认为机理如下:
)继续反应,有理论认为机理如下:
决速步骤的反应方程式为
(4)按照
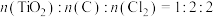 混合,平衡状态下不同物质的组成比与温度的关系如下图所示:
混合,平衡状态下不同物质的组成比与温度的关系如下图所示:
①曲线Q是
②M点所发生的化学方程式是
您最近半年使用:0次
名校
解题方法
2 . 二氟草酸硼酸锂(LiBF2C2O4)热稳定性好,在较宽的温度范围内具有良好的离子电导率,对水分不敏感,被认为是最有希望取代六氟磷酸锂的电解质锂盐。由锂精矿(主要成分有LiAlSi2O6还含有少量Fe2+等离子)制备LiBF2C2O4的工艺如下。
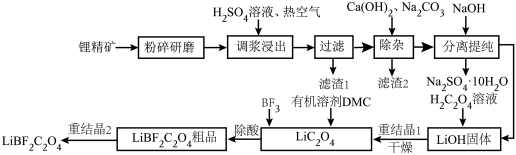
回答下列问题:
(1)调浆浸出时通入热空气的作用是___________ (用离子方程式表示)。
(2)锂精矿中所有的Al元素和Si元素以某种铝硅酸盐从滤渣1中分离,该铝硅酸盐的化学式为___________ ,滤渣2的主要成分是CaCO3和___________ (填化学式)。
(3)分离提纯的步骤,将滤液蒸发浓缩,加入NaOH后,冷却到-5~-15℃分离出Na2SO4·10H2O。再将分离后的母液___________ 、___________ (填简要操作),得到LiOH固体。
(4)在较短的反应时间内,BF3和Li2C2O4反应时的比例对产物组成的影响如下表所示。
①一般认为BF3和Li2C2O4反应分两步进行:
第一步:Li2C2O4+BF3=LiBF2C2O4+LiFEa1
第二步:___________ Ea2
请补齐第二步反应,并判断两步反应的活化能Ea1___________ (填“>”或“<”)Ea2。
②为避免药品浪费,反应的最佳比例n(BF3):n(Li2C2O4)=___________ 。
(5)BF3和环境中微量的水反应会生成酸性物质,影响产品的纯度和性质,用Li2CO3比用LiOH除酸更好的原因是___________ 。
(6)LiBF2C2O4的阴离子含五元环状结构,且B最外层为8e-构型,请你补全LiBF2C2O4的结构式:_____ 。
Li+[ _____ ]。

回答下列问题:
(1)调浆浸出时通入热空气的作用是
(2)锂精矿中所有的Al元素和Si元素以某种铝硅酸盐从滤渣1中分离,该铝硅酸盐的化学式为
(3)分离提纯的步骤,将滤液蒸发浓缩,加入NaOH后,冷却到-5~-15℃分离出Na2SO4·10H2O。再将分离后的母液
(4)在较短的反应时间内,BF3和Li2C2O4反应时的比例对产物组成的影响如下表所示。
| n(BF3):n(Li2C2O4) | 产物组成 |
| 0.5 1.0 1.5 2.0 2.5 | LiBF2C2O4、LiBF4、Li2C2O4 LiBF2C2O4、LiBF4、Li2C2O4 LiBF2C2O4、LiBF4、Li2C2O4 LiBF2C2O4、LiBF4 LiBF2C2O4、LiBF4 |
第一步:Li2C2O4+BF3=LiBF2C2O4+LiFEa1
第二步:
请补齐第二步反应,并判断两步反应的活化能Ea1
②为避免药品浪费,反应的最佳比例n(BF3):n(Li2C2O4)=
(5)BF3和环境中微量的水反应会生成酸性物质,影响产品的纯度和性质,用Li2CO3比用LiOH除酸更好的原因是
(6)LiBF2C2O4的阴离子含五元环状结构,且B最外层为8e-构型,请你补全LiBF2C2O4的结构式:
Li+[ _____ ]。
您最近半年使用:0次
2023-05-17更新
|
588次组卷
|
3卷引用:陕西省西安市西北工业大学附属中学2023-2024学年高二上学期期中考试化学试题
名校
3 . I、在防治新冠肺炎的工作中,过氧乙酸(CH3COOOH)是众多消毒剂中的一种。过氧乙酸可将各种病原微生物杀灭。某同学利用高浓度的双氧水和冰醋酸制备少量过氧乙酸并进行相关实验。
(1)过氧乙酸的制备。向100mL的三颈烧瓶中加入25mL冰醋酸(化学式:CH3COOH),滴加42.5%双氧水15mL,之后加入一定量浓硫酸作催化剂,维持反应温度为40℃,磁力搅拌4h后,室温静置12h。写出三颈烧瓶中制取过氧乙酸的化学反应方程式___________ 。
(2)过氧乙酸质量分数的测定。准确称取1.00g过氧乙酸样品液,定容于100mL容量瓶中,取其中10.00mL溶液调pH后,用KMnO4标准溶液滴定至溶液出现浅红色,以除去过氧乙酸试样中剩余的H2O2,再加入过量KI溶液,摇匀,用0.0200mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液25.00mL。(已知:CH3COOOH+2I-+2H+=I2+CH3COOH+H2O;2Na2S2O3+I2=Na2S4O6+2NaI)
①加入过量KI溶液前,需除去H2O2的原因是___________ (用离子方程式表示)。若H2O2不除,则测得过氧乙酸质量分数将___________ (填“偏大”、“偏小”、“无影响”)。
②滴定时所选指示剂为___________ 。
③制得过氧乙酸溶液中过氧乙酸质量分数为___________ %。
II、沉淀滴定与中和滴定相似。为了测定某三氯化氧磷(POCl3)产品中POCl3的含量:准确称取1.600g样品在水解瓶中摇动至完全水解(POCl3+3H2O=H3PO4+3HCl),将水解液(提示:H3PO4已除去)配成100mL溶液,取10.00mL于锥形瓶中,加入0.2000mo/L的AgNO3溶液20.00mL(Ag++C1-=AgC1↓),再加少许硝基苯,用力振荡,使AgC1沉淀被硝基苯覆盖。加入NH4Fe(SO4)2作指示剂,用0.1000mo/LKSCN标准溶液滴定过量的AgNO3至终点(Ag++SCN-=AgSCN↓),做平行实验,平均消耗KSCN标准溶液10.00mL。
(3)①达到滴定终点的判断方法是___________ 。
②取10.00mL于锥形瓶中,需用___________ 仪器取。
③已知:Ksp(AgC1)=3.2×10-10mol2/L2,Ksp(AgSCN)=2×10-12mol2/L2,若无硝基苯覆盖沉淀表面,测定POCl3的质量分数将___________ (填“偏大”、“偏小”、“无影响”)。
(1)过氧乙酸的制备。向100mL的三颈烧瓶中加入25mL冰醋酸(化学式:CH3COOH),滴加42.5%双氧水15mL,之后加入一定量浓硫酸作催化剂,维持反应温度为40℃,磁力搅拌4h后,室温静置12h。写出三颈烧瓶中制取过氧乙酸的化学反应方程式
(2)过氧乙酸质量分数的测定。准确称取1.00g过氧乙酸样品液,定容于100mL容量瓶中,取其中10.00mL溶液调pH后,用KMnO4标准溶液滴定至溶液出现浅红色,以除去过氧乙酸试样中剩余的H2O2,再加入过量KI溶液,摇匀,用0.0200mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液25.00mL。(已知:CH3COOOH+2I-+2H+=I2+CH3COOH+H2O;2Na2S2O3+I2=Na2S4O6+2NaI)
①加入过量KI溶液前,需除去H2O2的原因是
②滴定时所选指示剂为
③制得过氧乙酸溶液中过氧乙酸质量分数为
II、沉淀滴定与中和滴定相似。为了测定某三氯化氧磷(POCl3)产品中POCl3的含量:准确称取1.600g样品在水解瓶中摇动至完全水解(POCl3+3H2O=H3PO4+3HCl),将水解液(提示:H3PO4已除去)配成100mL溶液,取10.00mL于锥形瓶中,加入0.2000mo/L的AgNO3溶液20.00mL(Ag++C1-=AgC1↓),再加少许硝基苯,用力振荡,使AgC1沉淀被硝基苯覆盖。加入NH4Fe(SO4)2作指示剂,用0.1000mo/LKSCN标准溶液滴定过量的AgNO3至终点(Ag++SCN-=AgSCN↓),做平行实验,平均消耗KSCN标准溶液10.00mL。
(3)①达到滴定终点的判断方法是
②取10.00mL于锥形瓶中,需用
③已知:Ksp(AgC1)=3.2×10-10mol2/L2,Ksp(AgSCN)=2×10-12mol2/L2,若无硝基苯覆盖沉淀表面,测定POCl3的质量分数将
您最近半年使用:0次
2022高二上·安徽阜阳·竞赛
解题方法
4 . 化学一直都在发展……
①利用非水体系中的化学反应,可以用来制备无水盐,工业上原来制备无水硝酸铜的过程如下(步骤I得到的是硝酸铜溶液),据此回答:
CuO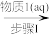 Cu(NO3)2
Cu(NO3)2 Cu(NO3)2·n H2O
Cu(NO3)2·n H2O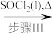 Cu(NO3)2(无水)
Cu(NO3)2(无水)
已知:步骤III的气体产物仅有两种,均呈酸性,其中一种分子量为64
(1)步骤I中加入的物质1(aq)为_______ (填写化学式),步骤III中加入SOCl2的作用是_______ ,写出步骤III发生的化学反应的化学方程式_______ 。
(2)已知若步骤III中不加入SOCl2,直接加热含结晶水的硝酸铜,会生成碱式硝酸铜[Cu(NO3)2·3Cu(OH)2],其原因是硝酸铜发生了_______ (填反应类型),其反应的化学方程式为_______ 。
②现如今化学家们发明了另一种制备方法:
Cu(s) Cu(NO3)2·n N2O4
Cu(NO3)2·n N2O4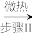 Cu(NO3)2
Cu(NO3)2
已知:在液态N2O4中存在一下自耦电离平衡:N2O4 NO++
NO++ ,步骤I,II均放出有毒气体,两者均为汽车尾气的主要成分
,步骤I,II均放出有毒气体,两者均为汽车尾气的主要成分
(3)试写出步骤I与步骤II的方程式:步骤I_______ ;步骤II_______ 。
(4)该反应的优点(写出一条即可):_______ 。
①利用非水体系中的化学反应,可以用来制备无水盐,工业上原来制备无水硝酸铜的过程如下(步骤I得到的是硝酸铜溶液),据此回答:
CuO
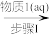 Cu(NO3)2
Cu(NO3)2 Cu(NO3)2·n H2O
Cu(NO3)2·n H2O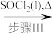 Cu(NO3)2(无水)
Cu(NO3)2(无水)已知:步骤III的气体产物仅有两种,均呈酸性,其中一种分子量为64
(1)步骤I中加入的物质1(aq)为
(2)已知若步骤III中不加入SOCl2,直接加热含结晶水的硝酸铜,会生成碱式硝酸铜[Cu(NO3)2·3Cu(OH)2],其原因是硝酸铜发生了
②现如今化学家们发明了另一种制备方法:
Cu(s)
 Cu(NO3)2·n N2O4
Cu(NO3)2·n N2O4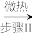 Cu(NO3)2
Cu(NO3)2已知:在液态N2O4中存在一下自耦电离平衡:N2O4
 NO++
NO++ ,步骤I,II均放出有毒气体,两者均为汽车尾气的主要成分
,步骤I,II均放出有毒气体,两者均为汽车尾气的主要成分(3)试写出步骤I与步骤II的方程式:步骤I
(4)该反应的优点(写出一条即可):
您最近半年使用:0次
5 . 书写方程式
(1)硫酸铝和硅酸钠溶液反应的离子方程式_______ 。
(2)酚醛树脂的合成_______ 。
(3)用重铬酸钾和浓盐酸制氯气_______ 。
(4) 和
和 固体混合物在高温下发生反应,放出的气体均为黄绿色(
固体混合物在高温下发生反应,放出的气体均为黄绿色( 为黄绿色)
为黄绿色)_______ 。
(5) 将雌黄铁矿(
将雌黄铁矿(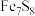 )中的S氧化成
)中的S氧化成
_______ 。
(1)硫酸铝和硅酸钠溶液反应的离子方程式
(2)酚醛树脂的合成
(3)用重铬酸钾和浓盐酸制氯气
(4)
 和
和 固体混合物在高温下发生反应,放出的气体均为黄绿色(
固体混合物在高温下发生反应,放出的气体均为黄绿色( 为黄绿色)
为黄绿色)(5)
 将雌黄铁矿(
将雌黄铁矿(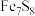 )中的S氧化成
)中的S氧化成
您最近半年使用:0次
解题方法
6 . 钪( )是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为
)是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为 (可表示为
(可表示为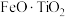 ),还含有少量
),还含有少量 等氧化物,从钛铁矿中提取
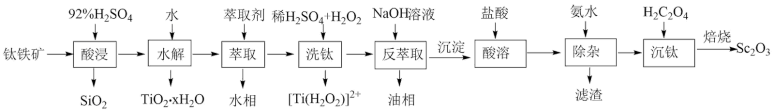
等氧化物,从钛铁矿中提取 的流程如下:
的流程如下:
已知:①当离子浓度减小至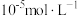 时可认为沉淀完全
时可认为沉淀完全
②室温下,溶液中离子沉淀完全的 如下表所示:
如下表所示:
③ ,
,
回答下列问题:
(1)“酸浸”后 元素转化为
元素转化为 ,其水解反应的化学方程式是
,其水解反应的化学方程式是___________ 。
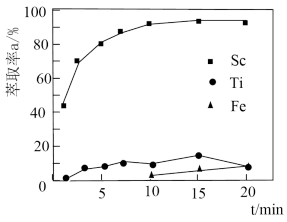
(2)“萃取”时,使用 煤油作为萃取剂,一定条件下萃取率
煤油作为萃取剂,一定条件下萃取率 受振荡时间的影响如图,萃取时选择最佳的振荡时间为
受振荡时间的影响如图,萃取时选择最佳的振荡时间为___________  。
。
(3)“洗钛”所得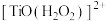 为橘黄色的稳定离子,
为橘黄色的稳定离子, 的作用是
的作用是___________ 。(写出两点)
(4)“酸溶”后滤液中存在的阳离子 浓度均小于
浓度均小于 “除杂”过程中应控制的
“除杂”过程中应控制的 范围是
范围是___________ 。
(5)“沉钪”后得到五水草酸钪,焙烧生成四种氧化物。其反应的化学方程式为___________ 。
 )是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为
)是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为 (可表示为
(可表示为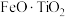 ),还含有少量
),还含有少量 等氧化物,从钛铁矿中提取
等氧化物,从钛铁矿中提取 的流程如下:
的流程如下:
已知:①当离子浓度减小至
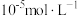 时可认为沉淀完全
时可认为沉淀完全②室温下,溶液中离子沉淀完全的
 如下表所示:
如下表所示:| 离子 |  |  |  |
沉淀完全的 | 3.2 | 9.0 | 1.05 |
 ,
,回答下列问题:
(1)“酸浸”后
 元素转化为
元素转化为 ,其水解反应的化学方程式是
,其水解反应的化学方程式是(2)“萃取”时,使用
 煤油作为萃取剂,一定条件下萃取率
煤油作为萃取剂,一定条件下萃取率 受振荡时间的影响如图,萃取时选择最佳的振荡时间为
受振荡时间的影响如图,萃取时选择最佳的振荡时间为 。
。
(3)“洗钛”所得
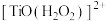 为橘黄色的稳定离子,
为橘黄色的稳定离子, 的作用是
的作用是(4)“酸溶”后滤液中存在的阳离子
 浓度均小于
浓度均小于 “除杂”过程中应控制的
“除杂”过程中应控制的 范围是
范围是(5)“沉钪”后得到五水草酸钪,焙烧生成四种氧化物。其反应的化学方程式为
您最近半年使用:0次
名校
解题方法
7 . X、Y、Z、M为短周期元素,原子序数依次增大。A~J均由该四种元素构成的单质或化合物,其转化关系如图所示,部分生成物省略。
已知:①A、B、C、G都是由两种元素构成的化合物,其中A、G分子所含的电子数为10e-,B、C分子所含的电子数为18e-;D为空气的主要成分之一、
②另取16.8gJ在真空条件下,控制温度350~400oC加热至完全分解,得到F和8.96L(已折算成标准状况)A两种物质。

请回答下列问题:
(1)写出C的化学式是___________ ;D的电子式是___________ 。
(2)请写出金属单质E在生产生活中的一种作用___________ 。
(3)写出次氯酸钠与过量气体A反应生成B的化学方程式是___________ ;B在制备过程中,气体A需要过量的理由是___________ 。
(4)写出F和G反应生成H和A的化学方程式是___________ 。
(5)B在加热条件下与CuO反应可生成气体D和金属单质,请设计实验方案,验证B与CuO反应后固体的成分(不考虑其他反应)___________ 。
(6)写出J在已知②条件下受热分解的化学方程式是___________ 。
已知:①A、B、C、G都是由两种元素构成的化合物,其中A、G分子所含的电子数为10e-,B、C分子所含的电子数为18e-;D为空气的主要成分之一、
②另取16.8gJ在真空条件下,控制温度350~400oC加热至完全分解,得到F和8.96L(已折算成标准状况)A两种物质。

请回答下列问题:
(1)写出C的化学式是
(2)请写出金属单质E在生产生活中的一种作用
(3)写出次氯酸钠与过量气体A反应生成B的化学方程式是
(4)写出F和G反应生成H和A的化学方程式是
(5)B在加热条件下与CuO反应可生成气体D和金属单质,请设计实验方案,验证B与CuO反应后固体的成分(不考虑其他反应)
(6)写出J在已知②条件下受热分解的化学方程式是
您最近半年使用:0次
2021-11-05更新
|
1073次组卷
|
2卷引用:浙江省诸暨市2018-2019学年高二下学期期末考试化学试题
解题方法
8 . 卡尔-费休(Karl-Fischer) 法是测定有机溶剂中的微量水含量的经典方法。所用试剂由碘、二氧化硫、吡啶(C5H5N,有机碱,与H+反应生成C5H5NH+)和无水甲醇按一定比例配制而成。该试剂与待测溶剂中的水反应后,产物的含量用库仑滴定法来测定。
(1)该方法的基本原理是利用碘与二氧化硫反应,反应方程式为___________ 。
(2)上述反应在测量条件下,是可逆反应,加入吡啶的作用是___________ 。
(3)加入甲醇可以进一步稳定产物,生成C5H5NHSO4CH3,请写出总反应。的化学方程式:___________ 。。
(4)测定20.0 mL有机溶剂含水量____ 。库仑滴定时,以24.8 mA恒定电流通电302s时达到反应终点(电极反应: 2I-- 2e = I2)。求该有机溶剂的含水量(mg·L-1) ____ 。已知: 1 mol电子的电量为9.65× 104C,电量计算公式Q=It
(1)该方法的基本原理是利用碘与二氧化硫反应,反应方程式为
(2)上述反应在测量条件下,是可逆反应,加入吡啶的作用是
(3)加入甲醇可以进一步稳定产物,生成C5H5NHSO4CH3,请写出总反应。的化学方程式:
(4)测定20.0 mL有机溶剂含水量
您最近半年使用:0次
解题方法
9 . 写出下列反应的方程式
(1)硫代硫酸钠与稀盐酸混合,生成有刺激性气味的气体_______
(2)氯酸钾、硫酸锰与氢氧化钾共熔,生成绿色物质_______
(3)在重铬酸钾溶液中加入少量银离子,生成砖红色沉淀_______
(4)金溶解在王水中_______
(1)硫代硫酸钠与稀盐酸混合,生成有刺激性气味的气体
(2)氯酸钾、硫酸锰与氢氧化钾共熔,生成绿色物质
(3)在重铬酸钾溶液中加入少量银离子,生成砖红色沉淀
(4)金溶解在王水中
您最近半年使用:0次
解题方法
10 . 化合物 A是近十年开始采用的锅炉水添加剂。A的相对分子质量90.10,可形成无色晶体,能除去锅炉水中溶解氧,并可使锅炉壁钝化。
(1)A是用碳酸二甲酯和一水合肼在70°C下合成的,收率80%。 画出A的结构式___________ 。
(2)写出合成A的反应方程式___________ 。
(3)低于135°C时,A直接与溶解氧反应,生成三种产物。写出化学方程式___________ 。
(4) 高于135°C时,A先发生水解,水解产物再与氧反应。写出化学方程式___________ 。
(5)化合物A能使锅炉壁钝化是基于它能将氧化铁转化为致密的四氧化三铁。写出化学方程式___________ 。
(6)化合物A与许多金属离子形成八面体配合物,例如[Mn(A)3]2+。 结构分析证实该配合物中的A和游离态的A相比,分子中原本等长的两个键不再等长。画出这种配合物的结构简图(氢原子不需画出),讨论异构现象___________ 。
(1)A是用碳酸二甲酯和一水合肼在70°C下合成的,收率80%。 画出A的结构式
(2)写出合成A的反应方程式
(3)低于135°C时,A直接与溶解氧反应,生成三种产物。写出化学方程式
(4) 高于135°C时,A先发生水解,水解产物再与氧反应。写出化学方程式
(5)化合物A能使锅炉壁钝化是基于它能将氧化铁转化为致密的四氧化三铁。写出化学方程式
(6)化合物A与许多金属离子形成八面体配合物,例如[Mn(A)3]2+。 结构分析证实该配合物中的A和游离态的A相比,分子中原本等长的两个键不再等长。画出这种配合物的结构简图(氢原子不需画出),讨论异构现象
您最近半年使用:0次



