名校
解题方法
1 . Ce4+与Ce3+之间的转化被应用于去除污染金属工艺,目前国内外采用下列两种方法实现Ce4+的再生。
回答下列问题:
(1)利用臭氧再生:反应在酸性条件下进行,有氧气生成,其离子方程式为__ ;还原产物为__ (填化学式)。
(2)利用电化学再生:原理如图所示,则阳极的电极反应式为__ 。
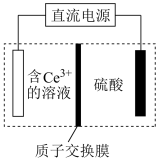
回答下列问题:
(1)利用臭氧再生:反应在酸性条件下进行,有氧气生成,其离子方程式为
(2)利用电化学再生:原理如图所示,则阳极的电极反应式为

您最近一年使用:0次
2020-08-28更新
|
125次组卷
|
2卷引用:广东省云浮市2019-2020学年高二上学期期末考试化学试题
名校
解题方法
2 . 锰的化合物在工业、医疗等领域有重要应用。某兴趣小组模拟工业制备KMnO4及探究锰(II)盐能否被氧化为高锰(VI)酸盐。已知:酸性条件下,KMnO4可氧化Cl-。
I.KMnO4的制备:
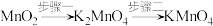
反应原理:
步骤一:3MnO2+6KOH+KClO3=3K2MnO4(墨绿色)+KCl+3H2O
步骤二:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
实验操作:
步骤一:将一定比例的MnO2、KOH和KClO3固体混合加热,得到墨绿色的固体,冷却后加水充分溶解,然后将得到的碱性K2MnO4溶液放入烧杯C中。
步骤二:连接装置,检查气密性后装入药品。打开分液漏斗活塞,当C中溶液完全变为紫红色时,关闭活塞停止反应,分离、提纯获取KMnO4晶体。
实验装置如图所示:
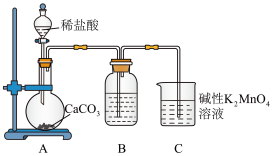
(1)检查装置A气密性:关闭分液漏斗活塞,在B中加入蒸馏水至液面超过长导管口,用热毛巾捂住圆底烧瓶,若__ ,则说明装置气密性良好。
(2)装置A中盛装稀盐酸的仪器名称是__ ,装置B中盛装的试剂是__ 。
(3)反应结束后,若未及时分离KMnO4晶体,会发现C中紫红色溶液变浅,其原因可能是__ 。
II.该小组继续探究Mn2+能否被氧化为MnO ,进行了下列实验:
,进行了下列实验:
已知:MnO2为棕黑色固体,难溶于水;KMnO4在酸性环境下缓慢分解产生MnO2。
(4)实验①中生成棕黑色沉淀的离子方程式为__ 。
(5)对比实验②和③,实验②的作用是__ 。
I.KMnO4的制备:
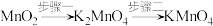
反应原理:
步骤一:3MnO2+6KOH+KClO3=3K2MnO4(墨绿色)+KCl+3H2O
步骤二:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
实验操作:
步骤一:将一定比例的MnO2、KOH和KClO3固体混合加热,得到墨绿色的固体,冷却后加水充分溶解,然后将得到的碱性K2MnO4溶液放入烧杯C中。
步骤二:连接装置,检查气密性后装入药品。打开分液漏斗活塞,当C中溶液完全变为紫红色时,关闭活塞停止反应,分离、提纯获取KMnO4晶体。
实验装置如图所示:

(1)检查装置A气密性:关闭分液漏斗活塞,在B中加入蒸馏水至液面超过长导管口,用热毛巾捂住圆底烧瓶,若
(2)装置A中盛装稀盐酸的仪器名称是
(3)反应结束后,若未及时分离KMnO4晶体,会发现C中紫红色溶液变浅,其原因可能是
II.该小组继续探究Mn2+能否被氧化为MnO
 ,进行了下列实验:
,进行了下列实验:| 装置图 | 试剂X | 实验现象 |
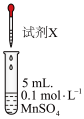 | ①1mL2mol/LNaOH和1mL1.5mol/LH2O2混合液 | 生成棕黑色沉淀 |
| ②2mL0.1mol/LHNO3溶液 | 无明显现象 | |
| ③2mL0.1mol/LHNO3溶液和少量PbO2 | 滴加HNO3溶液后试管内无明显现象,加入PbO2立即变为紫红色,稍后紫红色消失,生成棕黑色沉淀 |
已知:MnO2为棕黑色固体,难溶于水;KMnO4在酸性环境下缓慢分解产生MnO2。
(4)实验①中生成棕黑色沉淀的离子方程式为
(5)对比实验②和③,实验②的作用是
您最近一年使用:0次
2020-08-28更新
|
79次组卷
|
2卷引用:广东省云浮市2019-2020学年高二上学期期末考试化学试题
3 . 铜广泛应用于电气、轻工、机械制造国防工业等。回答下列问题:
(1)用黄铜矿冶铜原理如图所示:
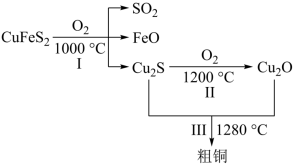
①CuFeS2中Fe的化合价为__ 。
②反应Ⅲ的化学方程式为___ 。
(2)制锈中有无害的Cu2(OH)2CO3和有害的“粉状锈[Cu2(OH)3Cl]。
①Cu2(OH)2CO3和Cu2(OH)3Cl均属于__ (填“正”“酸式”或“碱式”)盐;CuCl在湿的空气中生成Cu(OH)Cl的反应中,CuCl作__ (填“氧化剂”或“还原剂")。
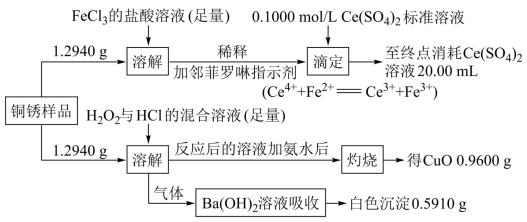
②某铜锈样品可能由CuCl、Cu2(OH)3Cl和Cu2(OH)2CO3组成,测定其组成的步骤如图所示,则铜锈样品中n(CuCl):n[Cu2(OH)3C1]:n[Cu2(OH)2CO3]=__ 。
(1)用黄铜矿冶铜原理如图所示:

①CuFeS2中Fe的化合价为
②反应Ⅲ的化学方程式为
(2)制锈中有无害的Cu2(OH)2CO3和有害的“粉状锈[Cu2(OH)3Cl]。
①Cu2(OH)2CO3和Cu2(OH)3Cl均属于
②某铜锈样品可能由CuCl、Cu2(OH)3Cl和Cu2(OH)2CO3组成,测定其组成的步骤如图所示,则铜锈样品中n(CuCl):n[Cu2(OH)3C1]:n[Cu2(OH)2CO3]=

您最近一年使用:0次
4 . 人体中含有铁元素,+2价的亚铁离子是血红蛋白(用于运输氧气)的重要组成成分。
(1)误服亚硝酸盐会使人中毒,是因为二价铁被__ (填“氧化”或“还原”)成三价铁,此时服用维生素C可缓解亚硝酸盐中毒,维生素C在此过程中是作__ (填“氧化剂”或“还原剂”)。
(2)现有一瓶久置的FeSO4溶液,请设计实验检验其中是否含有Fe3+:___ 。Fe2+在空气中易发生氧化还原反应而变质,可加入__ (填化学式)来防止其变质,而又不会使溶液中有新的杂质。
(3)高铁酸钾(K2FeO4)是水处理过程中使用的一种新型消毒剂。可在碱性条件下,用NaClO氧化Fe(OH)3来制备,请配平反应方程式:__ ClO-+___ Fe(OH)3+___ OH-=___ FeO +
+__ +__ Cl-
向制得的Na2FeO4溶液中加入适量的饱和KCl溶液会析出K2FeO4,写出该反应的化学方程式:__ 。
(1)误服亚硝酸盐会使人中毒,是因为二价铁被
(2)现有一瓶久置的FeSO4溶液,请设计实验检验其中是否含有Fe3+:
(3)高铁酸钾(K2FeO4)是水处理过程中使用的一种新型消毒剂。可在碱性条件下,用NaClO氧化Fe(OH)3来制备,请配平反应方程式:
 +
+向制得的Na2FeO4溶液中加入适量的饱和KCl溶液会析出K2FeO4,写出该反应的化学方程式:
您最近一年使用:0次



