名校
解题方法
1 .  作为一种广谱型的消毒剂,将逐渐用来取代
作为一种广谱型的消毒剂,将逐渐用来取代 ,成为自来水的消毒剂。已知
,成为自来水的消毒剂。已知 是一种易溶于水的气体,实验室制备
是一种易溶于水的气体,实验室制备 的原理是用亚氯酸钠固体与氯气反应:
的原理是用亚氯酸钠固体与氯气反应: ,下图是实验室用于制备和收集一定量纯净的
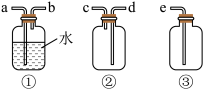
,下图是实验室用于制备和收集一定量纯净的 的装置(某些夹持装置和垫持用品已省略),其中E用于除去
的装置(某些夹持装置和垫持用品已省略),其中E用于除去 中的未反应的
中的未反应的 。
。

(1)仪器P的名称是___________ 。
(2)写出装置A中烧瓶内发生反应的离子方程式:___________ 。
(3)B装置中所盛试剂是___________ 。
(4)F为 收集装置,应选用的装置是
收集装置,应选用的装置是___________ (填序号),其中与E装置导管相连的导管口是___________ (填接口字母)。
(5) 的另一种制备方法是用氯酸钠(
的另一种制备方法是用氯酸钠( )与浓盐酸反应,同时生成
)与浓盐酸反应,同时生成 。
。
①请写出该反应的化学方程式:________ 。
②浓盐酸在该反应中表现出来的性质是________ (填序号)。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
 作为一种广谱型的消毒剂,将逐渐用来取代
作为一种广谱型的消毒剂,将逐渐用来取代 ,成为自来水的消毒剂。已知
,成为自来水的消毒剂。已知 是一种易溶于水的气体,实验室制备
是一种易溶于水的气体,实验室制备 的原理是用亚氯酸钠固体与氯气反应:
的原理是用亚氯酸钠固体与氯气反应: ,下图是实验室用于制备和收集一定量纯净的
,下图是实验室用于制备和收集一定量纯净的 的装置(某些夹持装置和垫持用品已省略),其中E用于除去
的装置(某些夹持装置和垫持用品已省略),其中E用于除去 中的未反应的
中的未反应的 。
。
(1)仪器P的名称是
(2)写出装置A中烧瓶内发生反应的离子方程式:
(3)B装置中所盛试剂是
(4)F为
 收集装置,应选用的装置是
收集装置,应选用的装置是
(5)
 的另一种制备方法是用氯酸钠(
的另一种制备方法是用氯酸钠( )与浓盐酸反应,同时生成
)与浓盐酸反应,同时生成 。
。①请写出该反应的化学方程式:
②浓盐酸在该反应中表现出来的性质是
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
您最近一年使用:0次
2023-06-08更新
|
754次组卷
|
4卷引用:广东省湛江市2023-2024学年高一上学期1月期末调研考试化学试题
广东省湛江市2023-2024学年高一上学期1月期末调研考试化学试题广东省深圳市罗湖区2022-2023学年高一上学期1月期末考试化学试题(已下线)专题突破卷04?非金属及其化合物?-2024年高考化学一轮复习考点通关卷(新教材新高考)云南省开远市第一中学校2023-2024学年高一上学期12月月考化学试题
2 . 某同学用如图装置制备Cl2并探究其性质。查阅资料知:
i.S2O 酸性条件下与H+迅速反应生成S和SO2
酸性条件下与H+迅速反应生成S和SO2
ii.S2O 有较强的还原性
有较强的还原性
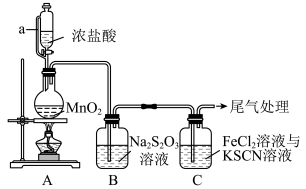
(1)装置A中a的作用是_______ ;装置A中制备Cl2的离子方程式为_______ 。
(2)上述装置中存在一处缺陷,会干扰Cl2和Na2S2O3性质的探究,改进的方法是_______ 。
(3)改进实验装置后,B中S2O 被氧化为SO
被氧化为SO ,写出该反应的离子方程式
,写出该反应的离子方程式_______ 。
(4)装置C中溶液颜色先变为血红色,一段时间后褪色。某同学对褪色原因提出假设:
假设1:Fe3+被Cl2氧化为更高价态;
假设2:_______ ;
为进一步探究,该同学取装置C褪色后的溶液少许于试管中,_______ (写出操作及现象)说明假设2成立。
i.S2O
 酸性条件下与H+迅速反应生成S和SO2
酸性条件下与H+迅速反应生成S和SO2ii.S2O
 有较强的还原性
有较强的还原性
(1)装置A中a的作用是
(2)上述装置中存在一处缺陷,会干扰Cl2和Na2S2O3性质的探究,改进的方法是
(3)改进实验装置后,B中S2O
 被氧化为SO
被氧化为SO ,写出该反应的离子方程式
,写出该反应的离子方程式(4)装置C中溶液颜色先变为血红色,一段时间后褪色。某同学对褪色原因提出假设:
假设1:Fe3+被Cl2氧化为更高价态;
假设2:
为进一步探究,该同学取装置C褪色后的溶液少许于试管中,
您最近一年使用:0次
解题方法
3 . 实验室需要用容量瓶等仪器配制480 mL2.0mol·L-1 NaCl溶液。
(1)在配制上述2.0mol·L-1 NaCl溶液时,需要用到托盘天平,计算需要称取NaCl的质量为_______ g (结果保留1位小数)。
(2)整个实验中用到的玻璃仪器除烧杯、玻璃棒、量筒外还有_______ 。
(3)利用上述2.0mol·L-1 NaCl溶液配制100mL0.5mol·L-1 NaCl溶液(设为溶液A),用量筒量所需2.0mol·L-1NaCl溶液的体积为_______ mL(计算结果保留一位小数)。
(4)下列操作对所配溶液浓度影响实验结果偏高的有_______ 。
A.称量时砝码生锈(未破损)
B.溶解所用烧杯未洗涤
C.颠倒摇匀后补加少量的水
D.定容时俯视观察刻度线
E.容量瓶中原有少量水
F.转移容量瓶时部分液体流出
(5)某同学配制完KCl溶液后未洗涤烧杯,可能使用了同一个烧杯配制溶液A,其怀疑溶液A中混入了K+。该同学用焰色试验的方法,透过_______ 观察到火焰呈_______ 色,证明了溶液中含有K+。
(6)某工厂用电解NaCl溶液的方法制备氯气,其化学原理为如下反应:

请将上述方程式补充完整_______ 。
(1)在配制上述2.0mol·L-1 NaCl溶液时,需要用到托盘天平,计算需要称取NaCl的质量为
(2)整个实验中用到的玻璃仪器除烧杯、玻璃棒、量筒外还有
(3)利用上述2.0mol·L-1 NaCl溶液配制100mL0.5mol·L-1 NaCl溶液(设为溶液A),用量筒量所需2.0mol·L-1NaCl溶液的体积为
(4)下列操作对所配溶液浓度影响实验结果偏高的有
A.称量时砝码生锈(未破损)
B.溶解所用烧杯未洗涤
C.颠倒摇匀后补加少量的水
D.定容时俯视观察刻度线
E.容量瓶中原有少量水
F.转移容量瓶时部分液体流出
(5)某同学配制完KCl溶液后未洗涤烧杯,可能使用了同一个烧杯配制溶液A,其怀疑溶液A中混入了K+。该同学用焰色试验的方法,透过
(6)某工厂用电解NaCl溶液的方法制备氯气,其化学原理为如下反应:

请将上述方程式补充完整
您最近一年使用:0次
解题方法
4 . 磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。废旧电池正极片(磷酸亚铁锂、炭黑和铝箔等)可再生利用,其工艺流程如图:
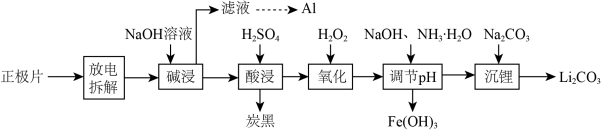
已知:碳酸锂在水中的溶解度:0℃时1.54g,90℃时0.85g,100℃时0.71g。
(1)上述流程中要得到Li2CO3的操作是___ 。
(2) “氧化”发生反应的离子方程式为___ ;若用HNO3代替H2O2,不足之处是___ 。
(3)①已知Ksp[Fe(OH)3]=2.6×10-39。常温下,在Fe(OH)3悬浊液中,当溶液的pH=3.0时,Fe3+的浓度为___ mol·L-1。
②“调节pH”生成沉淀时,溶液pH与金属元素的沉淀百分率(ω)的关系如表:
则最佳的沉淀pH=___ 。
(4) “沉锂”时所得的沉淀应用___ 洗涤(填“热水”或“冷水”)。
(5)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池放电时正极的电极反应式为___ 。

已知:碳酸锂在水中的溶解度:0℃时1.54g,90℃时0.85g,100℃时0.71g。
(1)上述流程中要得到Li2CO3的操作是
(2) “氧化”发生反应的离子方程式为
(3)①已知Ksp[Fe(OH)3]=2.6×10-39。常温下,在Fe(OH)3悬浊液中,当溶液的pH=3.0时,Fe3+的浓度为
②“调节pH”生成沉淀时,溶液pH与金属元素的沉淀百分率(ω)的关系如表:
| pH | 3.5 | 5.0 | 6.5 | 8.0 | 10.0 | 12.0 |
| ω(Fe)/% | 66.5 | 79.2 | 88.5 | 97.2 | 97.4 | 98.1 |
| ω(Li)/% | 0.9 | 1.3 | 1.9 | 2.4 | 4.5 | 8.0 |
则最佳的沉淀pH=
(4) “沉锂”时所得的沉淀应用
(5)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池放电时正极的电极反应式为
您最近一年使用:0次
5 . 四氧化三锰既是磁性材料锰锌铁氧体(ZnaMnbFecO4,Fe元素为+3价,Zn、Mn元素化合价相同)的重要生产原料,也常被用作氮氧化物分解的催化剂。近年来对制备高品质四氧化三锰的研究越来越受到重视。以硫酸锰为原料制备四氧化三锰的工艺流程如图:

回答下列问题:
(1)“溶解”时需用玻璃棒,其作用为____ 。
(2)“碱化”时反应离子方程式为____ 。
(3)滤液X中含有的溶质为____ (填化学式)。
(4)简述“碱化”得到的沉淀是否洗涤干净的方法:_____ 。
(5)“氧化”时发生的化学反应方程式为____ 。
(6)研究实验条件发现:在其他条件不变的情况下,加快和H2O2的滴加速度,氧化速率并未明显加快,其原因是____ (用化学方程式表示)。
(7)取30.2gMnSO4经上述工艺过程后,生成____ gMn3O4(假设Mn元素不损失)。

回答下列问题:
(1)“溶解”时需用玻璃棒,其作用为
(2)“碱化”时反应离子方程式为
(3)滤液X中含有的溶质为
(4)简述“碱化”得到的沉淀是否洗涤干净的方法:
(5)“氧化”时发生的化学反应方程式为
(6)研究实验条件发现:在其他条件不变的情况下,加快和H2O2的滴加速度,氧化速率并未明显加快,其原因是
(7)取30.2gMnSO4经上述工艺过程后,生成
您最近一年使用:0次
12-13高二上·广东湛江·期末
6 . 在KMnO4中,Mn的化合价是
| A.+2 | B.+4 | C.+6 | D.+7 |
您最近一年使用:0次



