2023高一下·上海嘉定·学业考试
名校
1 . 如图是硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题。
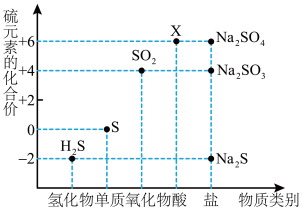
(1)X 的浓溶液与碳在一定条件下可以发生反应,体现了 X 的_______ 性。
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有_______ (填化学式)。
(3)将 H2S 与 SO2混合可生成淡黄色沉淀。该反应中氧化产物与还原产物的物质的量之比为_______ 。
(4)配平下列反应,并用单线桥法标出电子转移的方向和数目______ 。
Na2S+_______Na2SO3+_______H2SO4=_______Na2SO4+_______S↓+_______H2O
(5)下列关于硫及其化合物的叙述正确的是
(6)设 NA为阿伏加德罗常数的值。下列说法正确的是
为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:
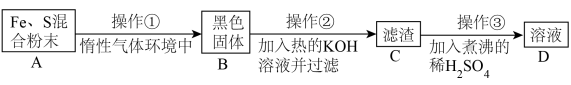
请回答以下问题:
(7)操作②的作用是_______ ,也可改用_______ 。
(8)混合粉末 A 中硫粉过量的原因是_______ 。
(9)下列溶液中通入SO2一定不会产生沉淀的是
(10)区别浓H2SO4和稀H2SO4,既简单又可靠的方法是

(1)X 的浓溶液与碳在一定条件下可以发生反应,体现了 X 的
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有
(3)将 H2S 与 SO2混合可生成淡黄色沉淀。该反应中氧化产物与还原产物的物质的量之比为
(4)配平下列反应,并用单线桥法标出电子转移的方向和数目
Na2S+_______Na2SO3+_______H2SO4=_______Na2SO4+_______S↓+_______H2O
(5)下列关于硫及其化合物的叙述正确的是
| A.试管内壁残留的硫可用酒精洗涤 | B.SO2的水溶液长期放置,酸性会增强 |
| C.SO2有毒,不可以做食品添加剂 | D.浓硫酸在空气中敞口放置,质量会减小 |
| A.1mol 铁单质与足量的硫单质充分反应,转移电子的数目为3NA |
| B.常温下,22.4LSO2与足量的O2反应,生成的SO3分子数为NA |
| C.常温下,将5.6g铁片投入足量的浓硫酸中,铁失去的电子数为0.3NA |
| D.1 molNa2O2与足量H2O反应,转移的电子数为NA |
为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:

请回答以下问题:
(7)操作②的作用是
(8)混合粉末 A 中硫粉过量的原因是
(9)下列溶液中通入SO2一定不会产生沉淀的是
| A.Ba(OH)2 | B.澄清石灰水 | C.Na2S | D.BaCl2 |
| A.各取少许溶液分别放入铜片 | B.分别与石蕊试液作用 |
| C.用玻璃棒各蘸少许液涂在纸上 | D.观察溶液的颜色 |
您最近一年使用:0次
2023·上海黄浦·一模
2 . 海洋元素“溴”的单质及其化合物的用途广泛。
(1)Br原子的最外层电子排布式为_______ ,其中未成对电子的电子云形状为_______ 。
(2)能作为溴、碘元素原子得电子能力递变规律的判断依据是_______ (填序号)。
a.IBr中溴为﹣1价 b.HBr、HI的酸性
c.HBr、HI的热稳定性 d.Br2、I2的熔点
(3)从原子结构角度解释氯的非金属性强于溴的原因:_______ 。
(4)Br2和碱金属单质形成的MBr熔点如表:
NaBr的电子式_______ ,MBr熔点呈现表中趋势的原因是_______ 。
(5)海水提溴过程中,先向酸化的浓缩海水中通入_______ ,将其中的Br—氧化,再用“空气吹出法”吹出Br2,并用纯碱吸收:Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),则吸收1mol Br2,转移电子_______ mol,反应中氧化产物为_______ 。
(6)随后用硫酸酸化吸收液,得到Br2和Na2SO4的混合溶液。相同条件下,若用盐酸酸化,则所得Br2的质量减少,可能原因是_______ 。
(1)Br原子的最外层电子排布式为
(2)能作为溴、碘元素原子得电子能力递变规律的判断依据是
a.IBr中溴为﹣1价 b.HBr、HI的酸性
c.HBr、HI的热稳定性 d.Br2、I2的熔点
(3)从原子结构角度解释氯的非金属性强于溴的原因:
(4)Br2和碱金属单质形成的MBr熔点如表:
| MBr | NaBr | KBr | RbBr | CsBr |
| 熔点/℃ | 747 | 734 | 693 | 636 |
(5)海水提溴过程中,先向酸化的浓缩海水中通入
(6)随后用硫酸酸化吸收液,得到Br2和Na2SO4的混合溶液。相同条件下,若用盐酸酸化,则所得Br2的质量减少,可能原因是
您最近一年使用:0次



