名校
1 . 蛇纹石是一类含水富镁硅酸盐矿物,主要成分为MgO和SiO2,含少量Fe、Ni的氧化物。可用于生产重要无机化工产品碱式碳酸镁[Mg2(OH)2CO3]。其制备流程如图所示:
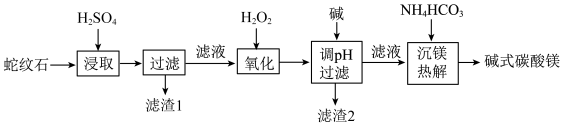
(1)滤渣1的主要成分从性质上来分,属于_______ 氧化物(填“酸性”“两性”或“碱性”),其用途很广泛,请写出一种:_______ 。如图表示该物质晶体的晶胞结构,1个该晶胞中含有_______ 个A-B键。
(2)滤渣2的主要成分是Fe(OH)3和Ni(OH)2,“氧化”过程中发现所用H2O2远高于理论用量,造成这一结果的主要原因有:①“氧化”过程中放热,温度升高加快了H2O2的分解速率、②_______ 。以下_______ (填序号)可以检验“氧化”过程已完全。
A.KSCN溶液 B.酸性KMnO4溶液 C.K3[Fe(CN)6]溶液 D.NaOH溶液
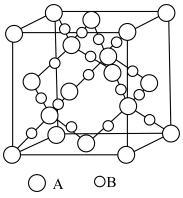
(3)Ni2+易形成[Ni(NH3)6]2+配合物,若[Ni(NH3)6]2+为正八面体构型(如图所示),则[Ni(CO)2(NH3)4]2+的结构有_______ 种。
(4)“沉镁热解”由连续的两步完成,第一步:沉镁生成正碳酸镁(MgCO3·3H2O),第二步:将正碳酸镁热解生成碱式碳酸镁。写出第一步的化学方程式:_______ 。
(5)用x吨含3MgO·2SiO2·2H2O(摩尔质量为a g/mol)为80%蛇纹石为原料,按以上流程制取[Mg2(OH)2CO3](摩尔质量为bg/mol),制得产品y吨,制取过程中镁元素的损失率为_______ ×100%(用含x、y、a、b的式子表示)。

(1)滤渣1的主要成分从性质上来分,属于

(2)滤渣2的主要成分是Fe(OH)3和Ni(OH)2,“氧化”过程中发现所用H2O2远高于理论用量,造成这一结果的主要原因有:①“氧化”过程中放热,温度升高加快了H2O2的分解速率、②
A.KSCN溶液 B.酸性KMnO4溶液 C.K3[Fe(CN)6]溶液 D.NaOH溶液
(3)Ni2+易形成[Ni(NH3)6]2+配合物,若[Ni(NH3)6]2+为正八面体构型(如图所示),则[Ni(CO)2(NH3)4]2+的结构有

(4)“沉镁热解”由连续的两步完成,第一步:沉镁生成正碳酸镁(MgCO3·3H2O),第二步:将正碳酸镁热解生成碱式碳酸镁。写出第一步的化学方程式:
(5)用x吨含3MgO·2SiO2·2H2O(摩尔质量为a g/mol)为80%蛇纹石为原料,按以上流程制取[Mg2(OH)2CO3](摩尔质量为bg/mol),制得产品y吨,制取过程中镁元素的损失率为
您最近一年使用:0次
2024-02-11更新
|
225次组卷
|
2卷引用:上海市宜川中学2023-2024学年高三上学期12月考试化学试题
2 . 氯及其化合物在日常生活中有广泛应用。某实验小组设计多组实验,对氯气及氯的化合物的性质进行研究
I.氯气的制备与性质研究
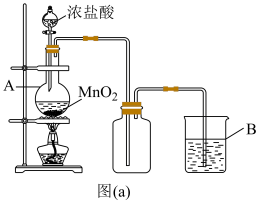
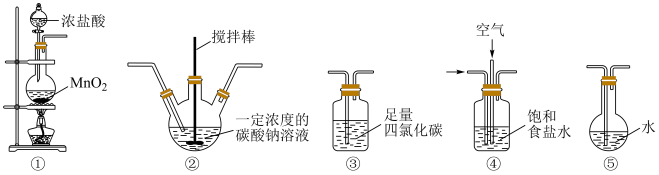
(1)实验室中常用如图(a)所示的装置制备氯气,反应的化学方程式为___________ 。
(2)图中仪器A的名称是___________ 。
(3)装置B内的溶液可以是___________ 。
(4)实验室中常用图(b)所示的装置制备氯气,并同时得到较浓的烧碱溶液。
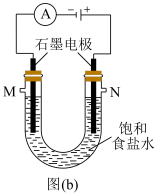
①图(b)反应的化学方程式为___________ 。
②检验制得的烧碱溶液中是否含有NaCl的实验方法是___________ 。
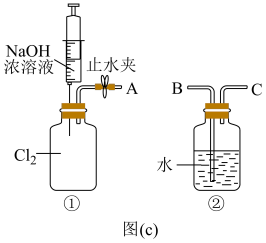
③用图(c)所示的组合装置验证氯气与烧碱溶液的反应。将A与B连接,打开止水夹,用注射器注入过量NaOH浓溶液,观察到的现象有___________ ;若其它操作不变,将A与C连接,②中观察到的现象有___________ 。
Ⅱ.次氯酸是重要的含氯化合物,应用于杀菌消毒、漂白等领域。学习小组以Cl2O为原料制备HClO。
i.常温常压下Cl2O是一种黄绿色气体
ii.将氯气和空气(不参与反应)通入足量的Na2CO3溶液,发生反应生成Cl2O。
iii.Cl2O易溶于水并与水立即反应生成HClO
iv.已知:HClO+2I-+H+=I2+Cl-+H2O,I2+2 =2I-+
=2I-+
(5)装置③中的液体不可燃、不助燃也不导电,关于其用途正确的是___________。
(6)各装置的连接顺序为___________ 。
①→___________→___________→___________→___________
(7)装置②中发生的化学反应中氧化产物与还原产物的物质的量之比为___________ 。
(8)装置④的作用有___________ 。(至少写出2点)
I.氯气的制备与性质研究

(1)实验室中常用如图(a)所示的装置制备氯气,反应的化学方程式为
(2)图中仪器A的名称是
(3)装置B内的溶液可以是
(4)实验室中常用图(b)所示的装置制备氯气,并同时得到较浓的烧碱溶液。

①图(b)反应的化学方程式为
②检验制得的烧碱溶液中是否含有NaCl的实验方法是
③用图(c)所示的组合装置验证氯气与烧碱溶液的反应。将A与B连接,打开止水夹,用注射器注入过量NaOH浓溶液,观察到的现象有

Ⅱ.次氯酸是重要的含氯化合物,应用于杀菌消毒、漂白等领域。学习小组以Cl2O为原料制备HClO。

i.常温常压下Cl2O是一种黄绿色气体
ii.将氯气和空气(不参与反应)通入足量的Na2CO3溶液,发生反应生成Cl2O。
iii.Cl2O易溶于水并与水立即反应生成HClO
iv.已知:HClO+2I-+H+=I2+Cl-+H2O,I2+2
 =2I-+
=2I-+
(5)装置③中的液体不可燃、不助燃也不导电,关于其用途正确的是___________。
| A.可浮于水溶液上方——隔绝空气 | B.与水互不相溶——萃取剂 |
| C.可隔绝空气——灭火剂 | D.遇碘变色——指示剂 |
(6)各装置的连接顺序为
①→___________→___________→___________→___________
(7)装置②中发生的化学反应中氧化产物与还原产物的物质的量之比为
(8)装置④的作用有
您最近一年使用:0次
名校
解题方法
3 . 亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似,有咸味,容易误食中毒。由于
)是一种用途广泛的工业盐,因其外观和食盐相似,有咸味,容易误食中毒。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:_______
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:_______ _______
_______ _______
_______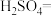 _______
_______ _______
_______ _______
_______ _______
_______ _______
_______ ;完成下列填空:
;完成下列填空:
(1)请配平上述化学反应并标出电子转移的方向和数目_______ :从物质分类角度来看, 属于
属于_______ (填字母)。
a.酸 b.酸式盐 c.正盐 d.碱方程式
氧化剂与还原剂的物质的量之比为_______ 。
(2)误食 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列_______(填字母)反应中
表现出的性质与下列_______(填字母)反应中 表现出的性质完全相同。
表现出的性质完全相同。
 )是一种用途广泛的工业盐,因其外观和食盐相似,有咸味,容易误食中毒。由于
)是一种用途广泛的工业盐,因其外观和食盐相似,有咸味,容易误食中毒。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:_______
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:_______ _______
_______ _______
_______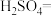 _______
_______ _______
_______ _______
_______ _______
_______ _______
_______ ;完成下列填空:
;完成下列填空:(1)请配平上述化学反应并标出电子转移的方向和数目
 属于
属于a.酸 b.酸式盐 c.正盐 d.碱方程式
氧化剂与还原剂的物质的量之比为
(2)误食
 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列_______(填字母)反应中
表现出的性质与下列_______(填字母)反应中 表现出的性质完全相同。
表现出的性质完全相同。A. |
B. |
C. |
D. |
您最近一年使用:0次
名校
解题方法
4 . 亚硝酸钠 是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性,能与
,其水溶液呈碱性,能与 溶液反应生成难溶于水、易溶于酸的
溶液反应生成难溶于水、易溶于酸的 。由于
。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下;
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下;
________ ________
________ ________=________
________=________ ________
________ ________
________ ________
________ ________
________
(1)补充并配平该化学方程式______ (若系数为1,请标注“1”)。
(2)从物质分类角度来看, 是
是________ (填字母)。
a.酸 b.酸式盐 c.碱 d.非电解质
e.电解质 f.离子化合物 g.共价化合物
(3)用上述反应来处理 并不是最佳方法,其原因是
并不是最佳方法,其原因是________ 。
(4)下列方法不能用来区分固体 和NaCl的是________(填字母)。
和NaCl的是________(填字母)。
(5)误食 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列________(填字母)反应中
表现出的性质与下列________(填字母)反应中 表现出的性质相同。
表现出的性质相同。
(6)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学方程式,并用单线桥表示其电子转移的方向和数目:________ 。
 是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性,能与
,其水溶液呈碱性,能与 溶液反应生成难溶于水、易溶于酸的
溶液反应生成难溶于水、易溶于酸的 。由于
。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下;
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下;________
 ________
________ ________=________
________=________ ________
________ ________
________ ________
________ ________
________
(1)补充并配平该化学方程式
(2)从物质分类角度来看,
 是
是a.酸 b.酸式盐 c.碱 d.非电解质
e.电解质 f.离子化合物 g.共价化合物
(3)用上述反应来处理
 并不是最佳方法,其原因是
并不是最佳方法,其原因是(4)下列方法不能用来区分固体
 和NaCl的是________(填字母)。
和NaCl的是________(填字母)。| A.分别溶于水 | B.分别溶于水并滴加 酸化的 酸化的 溶液 溶液 |
| C.分别加强热并收集气体检验 | D.用筷子分别蘸取固体品尝味道 |
 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列________(填字母)反应中
表现出的性质与下列________(填字母)反应中 表现出的性质相同。
表现出的性质相同。A. |
B. |
C.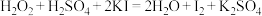 |
D.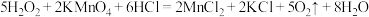 |
您最近一年使用:0次
21-22高一下·上海浦东新·阶段练习
5 . 亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性,能与
,其水溶液呈碱性,能与 溶液反应生成难溶于水、易溶于酸的
溶液反应生成难溶于水、易溶于酸的 。由于
。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
___________ ___________KI+___________=___________NO↑+___________
___________KI+___________=___________NO↑+___________ ___________
___________ ___________
___________ ___________
___________
(1)请完成该化学方程式并配平。___________
(2)从物质分类角度来看, 是
是___________ (填字母代号)。
a.酸 b.酸式盐 c.碱 d.非电解质 e.电解质 f.离子化合物 g.共价化合物
(3)用上述反应来处理 并不是最佳方法,其原因是
并不是最佳方法,其原因是___________ 。从环保角度来讲,要将 转化为氮气,所用物质的
转化为氮气,所用物质的___________ (填“氧化性”或“还原性”)应该比KI更___________ (填“强”或“弱”)。
(4)下列方法不能用来区分固体 和NaCl的是___________(填序号)。
和NaCl的是___________(填序号)。
(5)误食 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列___________(填序号)反应中
表现出的性质与下列___________(填序号)反应中 表现出的性质相同。
表现出的性质相同。
(6)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式,并用单线桥表示其电子转移的方向和数目:___________ 。
 )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性,能与
,其水溶液呈碱性,能与 溶液反应生成难溶于水、易溶于酸的
溶液反应生成难溶于水、易溶于酸的 。由于
。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:___________
 ___________KI+___________=___________NO↑+___________
___________KI+___________=___________NO↑+___________ ___________
___________ ___________
___________ ___________
___________
(1)请完成该化学方程式并配平。
(2)从物质分类角度来看,
 是
是a.酸 b.酸式盐 c.碱 d.非电解质 e.电解质 f.离子化合物 g.共价化合物
(3)用上述反应来处理
 并不是最佳方法,其原因是
并不是最佳方法,其原因是 转化为氮气,所用物质的
转化为氮气,所用物质的(4)下列方法不能用来区分固体
 和NaCl的是___________(填序号)。
和NaCl的是___________(填序号)。| A.分别溶于水 |
B.分别溶于水并滴加 酸化的 酸化的 溶液 溶液 |
| C.分别加强热并收集气体检验 |
| D.用筷子分别蘸取固体品尝味道 |
 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列___________(填序号)反应中
表现出的性质与下列___________(填序号)反应中 表现出的性质相同。
表现出的性质相同。A. |
B. |
C.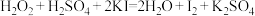 |
D. |
您最近一年使用:0次
名校
6 . 元素周期表中VIIA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子,其核外能量最高的电子所处的电子亚层是___________ ;碘元素在元素周期表中的位置是___________ 。少量液溴的保存通常采取的方法是___________ 。
(2)能作为氯、溴、碘元素非金属性递变规律的判断依据是___________(填序号)。
(3)CuCl(s)与 O2反应生成CuCl2(s)和一种黑色固体。在25°C、101kPa 下,已知该反应消耗1 mol CuCl(s),放热44.4kJ,该反应的热化学方程式是___________ 。
(4)碘化钾溶液中滴加适量硫酸铜溶液,就能得到碘化亚铜。请完成并配平上述反应:___________
KI+___________CuSO4→___________+___________Cu2I2↓+___________
该反应中氧化剂与还原剂的物质的量之比为___________
(5)往上述反应后溶液中加入淀粉,溶液变蓝,再滴加亚硫酸溶液,蓝色又褪去。写出KI、Cu2I2、 H2SO3的还原性由强到弱的顺序是___________ 。
(1)与氯元素同族的短周期元素的原子,其核外能量最高的电子所处的电子亚层是
(2)能作为氯、溴、碘元素非金属性递变规律的判断依据是___________(填序号)。
| A.Cl2、Br2、 I2的熔点 |
| B.HCl、 HBr、HI的沸点 |
| C.HCl、HBr、HI的热稳定性 |
| D.HClO4、 HBrO4、 HIO4 的酸性 |
(4)碘化钾溶液中滴加适量硫酸铜溶液,就能得到碘化亚铜。请完成并配平上述反应:
KI+___________CuSO4→___________+___________Cu2I2↓+___________
该反应中氧化剂与还原剂的物质的量之比为
(5)往上述反应后溶液中加入淀粉,溶液变蓝,再滴加亚硫酸溶液,蓝色又褪去。写出KI、Cu2I2、 H2SO3的还原性由强到弱的顺序是
您最近一年使用:0次
2021-12-12更新
|
165次组卷
|
2卷引用:上海市控江中学2021-2022学年高三上学期12月月考化学试题
名校
解题方法
7 . I.铁、铝是生活中常见金属,用途广泛。完成下列填空:
(1)在碱性溶液中,Al(OH)3的电离方程式为:___________ 。
(2)铝和氧化铁高温下反应得到的熔融物通常为铁铝合金,设计实验证明其含金属铝_____ 。
II.高铁酸钾 是一种集氧化、杀菌、吸附、凝聚等新型多功能高效水处理剂。
是一种集氧化、杀菌、吸附、凝聚等新型多功能高效水处理剂。 在水中发生发如下反应生成具有很强氧化、杀菌能力的新生态氧原子(用
在水中发生发如下反应生成具有很强氧化、杀菌能力的新生态氧原子(用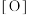 表示):___________
表示):___________ ___________
___________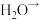 ___________
___________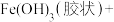 ___________
___________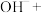 ___________
___________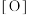
(3)配平上述反应_______ 。此过程中氧化剂是_________ 。(填化学物质)。
(4) 本身不具有吸附性,作为水处理剂为何具有吸附、凝聚等功能?
本身不具有吸附性,作为水处理剂为何具有吸附、凝聚等功能?_______ 。
III.溶液在工业上用于蚀刻铜箔制造电路板。从蚀刻后的废液中可以回收铜并使蚀刻液再生,流程如下(部分物质有省略):
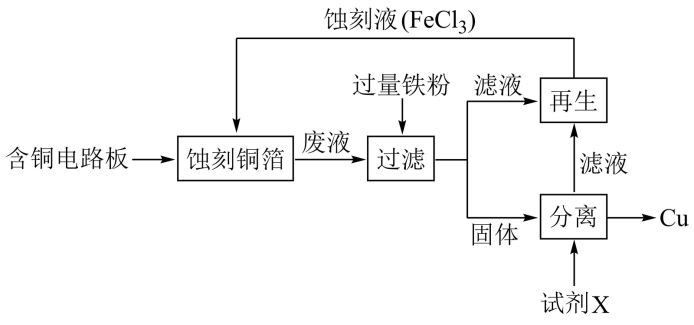
(5) 蚀刻铜箔反应的离子方程式为
蚀刻铜箔反应的离子方程式为___________ 。
(6)从固体中分离出铜,加入的试剂X可以是___________ 。
(7)使滤液再生为蚀刻液可采用的方法是___________ 。
(1)在碱性溶液中,Al(OH)3的电离方程式为:
(2)铝和氧化铁高温下反应得到的熔融物通常为铁铝合金,设计实验证明其含金属铝
II.高铁酸钾
 是一种集氧化、杀菌、吸附、凝聚等新型多功能高效水处理剂。
是一种集氧化、杀菌、吸附、凝聚等新型多功能高效水处理剂。 在水中发生发如下反应生成具有很强氧化、杀菌能力的新生态氧原子(用
在水中发生发如下反应生成具有很强氧化、杀菌能力的新生态氧原子(用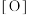 表示):___________
表示):___________ ___________
___________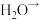 ___________
___________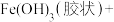 ___________
___________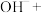 ___________
___________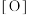
(3)配平上述反应
(4)
 本身不具有吸附性,作为水处理剂为何具有吸附、凝聚等功能?
本身不具有吸附性,作为水处理剂为何具有吸附、凝聚等功能?III.溶液在工业上用于蚀刻铜箔制造电路板。从蚀刻后的废液中可以回收铜并使蚀刻液再生,流程如下(部分物质有省略):

(5)
 蚀刻铜箔反应的离子方程式为
蚀刻铜箔反应的离子方程式为(6)从固体中分离出铜,加入的试剂X可以是
(7)使滤液再生为蚀刻液可采用的方法是
您最近一年使用:0次
2021-10-08更新
|
185次组卷
|
2卷引用:上海市杨浦高级中学2020-2021学年高二上学期第一次月考化学试题
名校
8 . 元素周期表中第VIIA族元素的单质及其化合物的用途广泛。
(1)第VIIA族原子半径最小的元素的原子结构示意图为_______ 。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是_______ (填序号)。
a.Cl2、Br2、I2的沸点 b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的稳定性 d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式:_______ ;
②II中转化的基本反应类型是_______ ,该反应过程能析出KClO3晶体而无其它晶体析出的主要原因是_______ 。
(4)一定条件,在水溶液中1molCl-、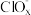 (x=1,2,3,4)的能量(kJ·mol-1)相对大小如图所示。
(x=1,2,3,4)的能量(kJ·mol-1)相对大小如图所示。
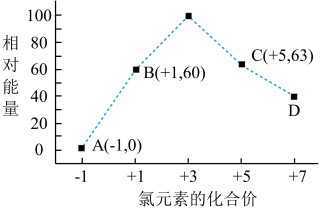
①上图中最不稳定的离子对应的酸是_______ (填写名称)。
②B→A+C反应的能量变化为_______ kJ·mol-1。
(1)第VIIA族原子半径最小的元素的原子结构示意图为
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是
a.Cl2、Br2、I2的沸点 b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的稳定性 d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液
 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体①完成I中反应的总化学方程式:
②II中转化的基本反应类型是
(4)一定条件,在水溶液中1molCl-、
 (x=1,2,3,4)的能量(kJ·mol-1)相对大小如图所示。
(x=1,2,3,4)的能量(kJ·mol-1)相对大小如图所示。
①上图中最不稳定的离子对应的酸是
②B→A+C反应的能量变化为
您最近一年使用:0次
2021-07-28更新
|
292次组卷
|
3卷引用:上海市吴淞中学2021-2022学年高三上学期第二次月考化学试题
上海市吴淞中学2021-2022学年高三上学期第二次月考化学试题江西省吉安市吉水县第二中学2020-2021学年高一下学期期中考试化学试题(已下线)专题八 原子结构与元素周期表(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)
9 . 碳形成的化合物种类繁多,硅是构成地壳岩石的主要元素。碳在自然界有两种稳定的同位素,有关数据如下表:
请列出碳元素近似相对原子质量的计算式_____________________________________ 。
(1)Si原子的14个电子排布在_______ 个能级上;与硅元素同周期、其原子核外有2个未成对电子的元素的最外层电子排布式为_____________ 。
(2)SiO2用途广泛,以下叙述错误的是______________ 。
a.SiO2是二氧化硅的分子式 b.SiO2中1个Si原子结合4个O原子
c.SiO2是酸性氧化物 d.SiO2熔沸点较高,属于原子晶体
(3)通常状况下,SiF4呈气态。以下叙述正确的是___________ 。
a.Si原子难以形成Si4+ b.SiF4是有极性键的非极性分子
c.固态SiF4是原子晶体 d.相同压强时,SiF4的沸点高于SiCl4
(4)Fe3O4可以写成FeO•Fe2O3,也可写成盐的形式:Fe[Fe2O4]。Pb3O4中含+2价的Pb和+4价的Pb,请将Pb3O4写成两种氧化物的形式___________ ,写成盐的形式__________ 。
(5)Pb的+2价化合物稳定,+4价的Pb能氧化浓盐酸生成Cl2。写出Pb3O4与盐酸反应的化学方程式____________________________________________ 。
| 同位素 | 相对原子质量 | 丰度(原子分数) |
| 12C | 12(整数,相对原子质量的基准) | 0.9893 |
| 13C | 13.003354826 | 0.0107 |
请列出碳元素近似相对原子质量的计算式
(1)Si原子的14个电子排布在
(2)SiO2用途广泛,以下叙述错误的是
a.SiO2是二氧化硅的分子式 b.SiO2中1个Si原子结合4个O原子
c.SiO2是酸性氧化物 d.SiO2熔沸点较高,属于原子晶体
(3)通常状况下,SiF4呈气态。以下叙述正确的是
a.Si原子难以形成Si4+ b.SiF4是有极性键的非极性分子
c.固态SiF4是原子晶体 d.相同压强时,SiF4的沸点高于SiCl4
(4)Fe3O4可以写成FeO•Fe2O3,也可写成盐的形式:Fe[Fe2O4]。Pb3O4中含+2价的Pb和+4价的Pb,请将Pb3O4写成两种氧化物的形式
(5)Pb的+2价化合物稳定,+4价的Pb能氧化浓盐酸生成Cl2。写出Pb3O4与盐酸反应的化学方程式
您最近一年使用:0次
14-15高三上·上海宝山·阶段练习
名校
解题方法
10 . 高铁酸盐(K2FeO4)在能源、环保等方面有着广泛的用途.湿法、干法制备高铁酸盐的原理如下表所示.
(1)写出干法制备K2FeO4的化学方程式为,_____________________________________ ,该
反应中氧化剂与还原剂的物质的量之比为_______________________________ 。
(2)高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为_______________________________ ,它能净水的原因是_____________________________________ 。
(3)在实验室配制Fe(NO3)3溶液时,若用蒸馏水直接配制,所得溶液往往较浑浊,其原因是(用离子方程式表示)____________________________ ,因此,正确的配制操作是在溶液中加入少量的(填试剂名称)_____________ ,其目的是__________________________ 。
(4)Fe2O3是一种____________ 色的氧化物,写出它和盐酸反应的离子方程式___________ 。
(5)检验Fe3+的方法很多,写出其中的一种检验方法_______________________________ 。
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
反应中氧化剂与还原剂的物质的量之比为
(2)高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为
(3)在实验室配制Fe(NO3)3溶液时,若用蒸馏水直接配制,所得溶液往往较浑浊,其原因是(用离子方程式表示)
(4)Fe2O3是一种
(5)检验Fe3+的方法很多,写出其中的一种检验方法
您最近一年使用:0次



