1 . Ⅰ.氧化铁是重要工业颜料,用废铁屑制备氧化铁的流程如图:
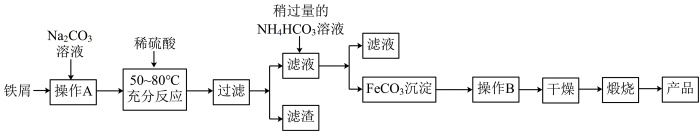
回答下列问题:
(1)检验“操作B”是否彻底的操作为_______ 。
(2)写出加入稍过量的NH4HCO3溶液得到FeCO3的离子方程式:_______ 。
(3)写出在空气中充分加热煅烧FeCO3的化学方程式:_______ 。
Ⅱ.上述流程中,若煅烧不充分,最终产品中会含有少量的FeO杂质。某同学为测定产品中Fe2O3的含量,进行如下实验:
a.称取样品8.00 g,加入足量稀H2SO4溶解,并加水稀释至100 mL;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用酸化的0. 010 00 mol·L-1KMnO4标准液滴定至终点;
d.重复操作b、c 2~3次,得出消耗KMnO4溶液体积的平均值为20.00 mL。
(4)确定滴定达到终点的操作及现象为_______ 。
(5)上述样品的质量分数为_______ 。
(6)下列操作会导致样品中Fe2O3的质量分数测定结果偏低的有_______(填字母) 。

回答下列问题:
(1)检验“操作B”是否彻底的操作为
(2)写出加入稍过量的NH4HCO3溶液得到FeCO3的离子方程式:
(3)写出在空气中充分加热煅烧FeCO3的化学方程式:
Ⅱ.上述流程中,若煅烧不充分,最终产品中会含有少量的FeO杂质。某同学为测定产品中Fe2O3的含量,进行如下实验:
a.称取样品8.00 g,加入足量稀H2SO4溶解,并加水稀释至100 mL;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用酸化的0. 010 00 mol·L-1KMnO4标准液滴定至终点;
d.重复操作b、c 2~3次,得出消耗KMnO4溶液体积的平均值为20.00 mL。
(4)确定滴定达到终点的操作及现象为
(5)上述样品的质量分数为
(6)下列操作会导致样品中Fe2O3的质量分数测定结果偏低的有_______(填字母) 。
| A.未干燥锥形瓶 |
| B.盛装标准液的滴定管没有用标准液润洗 |
| C.滴定开始时平视刻度线读数,滴定结束时仰视刻度线读数 |
| D.量取待测液的滴定管没有润洗 |
您最近一年使用:0次
解题方法
2 . 为了研究不同浓度硝酸的性质,某小组设计了如下实验(固定装置和尾气处理装置略)。
(1)实验I中氧化剂和还原剂的物质的量之比是多少______ ?
(2)对实验I和实验II发生不同反应的原因提出如下解释:
①极稀的硝酸与金属锌反应时无气体产生,写出此时生成的硝酸盐的化学式______ 。
②浓硝酸具有较强的氧化性,可将NO转化为 ,请写出其反应的化学方程式
,请写出其反应的化学方程式______ 。
(3)对实验I所得溶液呈绿色,而实验II所得溶液呈蓝色的原因提出猜想:
查阅资料:i. 溶于浓硝酸后呈黄色;
溶于浓硝酸后呈黄色;
ii. 。
。 是弱酸,不稳定。
是弱酸,不稳定。
猜想一: 溶于浓硝酸,与蓝色溶液混合而呈现绿色。
溶于浓硝酸,与蓝色溶液混合而呈现绿色。
猜想二: 电离出的
电离出的 与
与 结合为绿色的
结合为绿色的 。
。
①向浓硝酸中先通入 ,再滴加少量蓝色
,再滴加少量蓝色 溶液,证实猜想一合理。上述两步操作所得溶液的颜色分别为
溶液,证实猜想一合理。上述两步操作所得溶液的颜色分别为_______ 、_______ 。
②向蒸馏水中通入 得到无色溶液,向其中滴加蓝色的
得到无色溶液,向其中滴加蓝色的 溶液,溶液变为绿色,再滴加少量硝酸,结果溶液由绿色又变为蓝色。由此推出,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,请说明理由
溶液,溶液变为绿色,再滴加少量硝酸,结果溶液由绿色又变为蓝色。由此推出,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,请说明理由______ 。
(4)金可溶于王水(浓盐酸和浓硝酸按体积比3:1混合而成)生成 ,同时产生无色气体(露置在空气中变为红棕色),请写出该反应的化学方程式
,同时产生无色气体(露置在空气中变为红棕色),请写出该反应的化学方程式______ ,并分析该反应不直接生成 的原因
的原因______ 。
| 装置 | 编号 | 试剂a | 现象 |
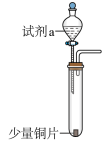 | I | 4mL浓硝酸(过量) | 铜片完全溶解,溶液变绿,出现大量红棕色气体 |
| II | 4mL稀硝酸(过量) | 铜片完全溶解,溶液变蓝,液面上方气体呈浅红棕色 |
(2)对实验I和实验II发生不同反应的原因提出如下解释:
①极稀的硝酸与金属锌反应时无气体产生,写出此时生成的硝酸盐的化学式
②浓硝酸具有较强的氧化性,可将NO转化为
 ,请写出其反应的化学方程式
,请写出其反应的化学方程式(3)对实验I所得溶液呈绿色,而实验II所得溶液呈蓝色的原因提出猜想:
查阅资料:i.
 溶于浓硝酸后呈黄色;
溶于浓硝酸后呈黄色;ii.
 。
。 是弱酸,不稳定。
是弱酸,不稳定。猜想一:
 溶于浓硝酸,与蓝色溶液混合而呈现绿色。
溶于浓硝酸,与蓝色溶液混合而呈现绿色。猜想二:
 电离出的
电离出的 与
与 结合为绿色的
结合为绿色的 。
。①向浓硝酸中先通入
 ,再滴加少量蓝色
,再滴加少量蓝色 溶液,证实猜想一合理。上述两步操作所得溶液的颜色分别为
溶液,证实猜想一合理。上述两步操作所得溶液的颜色分别为②向蒸馏水中通入
 得到无色溶液,向其中滴加蓝色的
得到无色溶液,向其中滴加蓝色的 溶液,溶液变为绿色,再滴加少量硝酸,结果溶液由绿色又变为蓝色。由此推出,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,请说明理由
溶液,溶液变为绿色,再滴加少量硝酸,结果溶液由绿色又变为蓝色。由此推出,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,请说明理由(4)金可溶于王水(浓盐酸和浓硝酸按体积比3:1混合而成)生成
 ,同时产生无色气体(露置在空气中变为红棕色),请写出该反应的化学方程式
,同时产生无色气体(露置在空气中变为红棕色),请写出该反应的化学方程式 的原因
的原因
您最近一年使用:0次
3 . 风绪小组探究 的相关性质。
的相关性质。
(1)对于 和水反应放出氧气的现象,他们推测,可能和
和水反应放出氧气的现象,他们推测,可能和 有关。通过实验发现,用冷水时,该反应放出气体的速率相对慢,而换用热水相对快。从而推测可能是
有关。通过实验发现,用冷水时,该反应放出气体的速率相对慢,而换用热水相对快。从而推测可能是 在水中反应生成了
在水中反应生成了 ,后
,后 分解。通过查阅资料得知:
分解。通过查阅资料得知: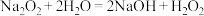 ,
,
①借助资料和实验,发现可以通过 溶于冷水制备少量的
溶于冷水制备少量的 。使用冷水的原因是
。使用冷水的原因是_______ 。
②为验证资料的真实性,他们向溶液中滴加适量的酸性 溶液,发现产生气泡,产生气泡的原因是(用方程式表示)
溶液,发现产生气泡,产生气泡的原因是(用方程式表示)_______ 。
(2)在有同学做实验时,还观察到了棕褐色沉淀,他们推测是 。猜测可能是
。猜测可能是 与
与 发生了反应。为验证猜想以及探究实验现象不一样的原因,他们做了如下实验。
发生了反应。为验证猜想以及探究实验现象不一样的原因,他们做了如下实验。
①先向沉淀中加入浓盐酸并加热,观察到有_______ 气体产生,发生反应_______ 。证明了猜想正确。
②后续得知,同学在制酸性 溶液时,加入的硫酸的量不一样。推测可能是
溶液时,加入的硫酸的量不一样。推测可能是 浓度不同造成的。于是,他们改用有
浓度不同造成的。于是,他们改用有 的
的 溶液滴入
溶液滴入 溶液中,仅观察到了
溶液中,仅观察到了_______ 沉淀,并证明是 ,反应方程式是
,反应方程式是_______ 。
(3) 在反应时,表现氧化性还是还原性,和
在反应时,表现氧化性还是还原性,和_______ 有关。
 的相关性质。
的相关性质。(1)对于
 和水反应放出氧气的现象,他们推测,可能和
和水反应放出氧气的现象,他们推测,可能和 有关。通过实验发现,用冷水时,该反应放出气体的速率相对慢,而换用热水相对快。从而推测可能是
有关。通过实验发现,用冷水时,该反应放出气体的速率相对慢,而换用热水相对快。从而推测可能是 在水中反应生成了
在水中反应生成了 ,后
,后 分解。通过查阅资料得知:
分解。通过查阅资料得知: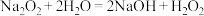 ,
,
①借助资料和实验,发现可以通过
 溶于冷水制备少量的
溶于冷水制备少量的 。使用冷水的原因是
。使用冷水的原因是②为验证资料的真实性,他们向溶液中滴加适量的酸性
 溶液,发现产生气泡,产生气泡的原因是(用方程式表示)
溶液,发现产生气泡,产生气泡的原因是(用方程式表示)(2)在有同学做实验时,还观察到了棕褐色沉淀,他们推测是
 。猜测可能是
。猜测可能是 与
与 发生了反应。为验证猜想以及探究实验现象不一样的原因,他们做了如下实验。
发生了反应。为验证猜想以及探究实验现象不一样的原因,他们做了如下实验。①先向沉淀中加入浓盐酸并加热,观察到有
②后续得知,同学在制酸性
 溶液时,加入的硫酸的量不一样。推测可能是
溶液时,加入的硫酸的量不一样。推测可能是 浓度不同造成的。于是,他们改用有
浓度不同造成的。于是,他们改用有 的
的 溶液滴入
溶液滴入 溶液中,仅观察到了
溶液中,仅观察到了 ,反应方程式是
,反应方程式是(3)
 在反应时,表现氧化性还是还原性,和
在反应时,表现氧化性还是还原性,和
您最近一年使用:0次
解题方法
4 . “消洗灵”是具有消毒、杀菌、漂白和洗涤等综合功效的固体粉末,消毒原理与“84消毒液”相似,化学组成可以表示为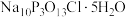 (磷酸三钠次氯酸钠)。某兴趣小组制备“消洗灵”的装置如图所示(夹持装置已略去):
(磷酸三钠次氯酸钠)。某兴趣小组制备“消洗灵”的装置如图所示(夹持装置已略去):
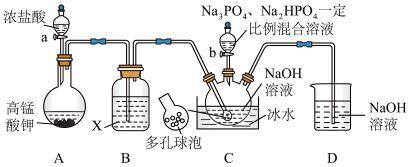
回答下列问题:
(1)①写出X试剂的名称______________ 。
②写出C中采用多孔球泡的目的______________ 。
③写出D装置的作用______________ 。
(2)打开仪器a的活塞及弹簧夹K,制备 碱性溶液;关闭仪器a的活塞及弹簧夹K,打开装置C中滴液漏斗活塞;一段时间后,取出装置C中溶液,经“一系列操作”,得到粗产品。
碱性溶液;关闭仪器a的活塞及弹簧夹K,打开装置C中滴液漏斗活塞;一段时间后,取出装置C中溶液,经“一系列操作”,得到粗产品。
① “一系列操作”包括___________ 、___________ 、过滤、洗涤、低温干燥。
②若C中的 与
与 按物质的量之比
按物质的量之比 混合,写出C中制备“消洗灵”的总反应的化学方程式
混合,写出C中制备“消洗灵”的总反应的化学方程式______________ 。
③若生成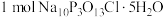 ,写出理论上至少消耗
,写出理论上至少消耗 的物质的量
的物质的量______________ 。
(3)“消洗灵”消毒时对金属腐蚀性小,原因是成分中的磷酸钠与空气共同作用,在金属表面形成不溶性磷酸盐膜,对金属具有良好的保护作用。写出用“消洗灵”对镁合金消毒,形成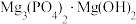 保护层的反应的化学方程式
保护层的反应的化学方程式______________ 。
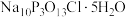 (磷酸三钠次氯酸钠)。某兴趣小组制备“消洗灵”的装置如图所示(夹持装置已略去):
(磷酸三钠次氯酸钠)。某兴趣小组制备“消洗灵”的装置如图所示(夹持装置已略去):
回答下列问题:
(1)①写出X试剂的名称
②写出C中采用多孔球泡的目的
③写出D装置的作用
(2)打开仪器a的活塞及弹簧夹K,制备
 碱性溶液;关闭仪器a的活塞及弹簧夹K,打开装置C中滴液漏斗活塞;一段时间后,取出装置C中溶液,经“一系列操作”,得到粗产品。
碱性溶液;关闭仪器a的活塞及弹簧夹K,打开装置C中滴液漏斗活塞;一段时间后,取出装置C中溶液,经“一系列操作”,得到粗产品。① “一系列操作”包括
②若C中的
 与
与 按物质的量之比
按物质的量之比 混合,写出C中制备“消洗灵”的总反应的化学方程式
混合,写出C中制备“消洗灵”的总反应的化学方程式③若生成
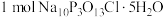 ,写出理论上至少消耗
,写出理论上至少消耗 的物质的量
的物质的量(3)“消洗灵”消毒时对金属腐蚀性小,原因是成分中的磷酸钠与空气共同作用,在金属表面形成不溶性磷酸盐膜,对金属具有良好的保护作用。写出用“消洗灵”对镁合金消毒,形成
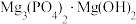 保护层的反应的化学方程式
保护层的反应的化学方程式
您最近一年使用:0次
名校
解题方法
5 . 氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如图:
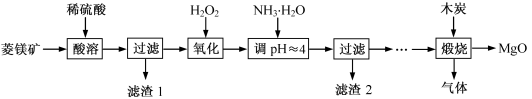
(1)MgCO3与稀硫酸反应的离子方程式为____ 。
(2)加入H2O2氧化时,发生反应的化学方程式为____ 。
(3)滤渣2的成分是____ (填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑;
2MgO+2SO2↑+CO2↑;
MgSO4+C MgO+SO2↑+CO↑;
MgO+SO2↑+CO↑;
MgSO4+3C MgO+S↑+3CO↑。
MgO+S↑+3CO↑。
利用如图装置对煅烧产生的气体进行分步吸收或收集。

①D中收集的气体是____ (填化学式)。
②A中得到的淡黄色固体能与热的NaOH溶液反应,产物中元素的最高价态为+4,写出该反应的离子方程式:____ 。

(1)MgCO3与稀硫酸反应的离子方程式为
(2)加入H2O2氧化时,发生反应的化学方程式为
(3)滤渣2的成分是
(4)煅烧过程存在以下反应:
2MgSO4+C
 2MgO+2SO2↑+CO2↑;
2MgO+2SO2↑+CO2↑;MgSO4+C
 MgO+SO2↑+CO↑;
MgO+SO2↑+CO↑;MgSO4+3C
 MgO+S↑+3CO↑。
MgO+S↑+3CO↑。利用如图装置对煅烧产生的气体进行分步吸收或收集。

①D中收集的气体是
②A中得到的淡黄色固体能与热的NaOH溶液反应,产物中元素的最高价态为+4,写出该反应的离子方程式:
您最近一年使用:0次
2022-06-21更新
|
328次组卷
|
2卷引用:陕西省西安高级中学2021-2022学年高一上学期竞赛化学试题



