名校
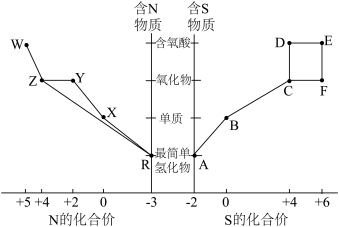
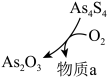
1 . 元素的“价类二维图”体现了化学变化之美。部分含硫、氮物质的类别与硫元素和氮元素化合价的对应关系如下图所示。回答下列问题: 反应的化学方程式
反应的化学方程式______
(2)下列有关图中所示含N、S物质的叙述,正确的是______ (填标号)。
a.在催化剂的作用下,R可将Y、Z还原为X
b.图中所示的物质中,只有W、D、E属于电解质
c.用玻璃棒分别蘸取浓的R溶液和浓的W溶液,玻璃棒靠近时有白烟产生
d.Z、C、F均能与NaOH溶液反应,都是酸性氧化物
e.制备焦亚硫酸钠( ),从氧化还原反应的角度分析,可选择B和D反应
),从氧化还原反应的角度分析,可选择B和D反应
(3)写出B与氢氧化钠溶液反应的离子反应方程式______
(4)将物质W的稀溶液加入物质D的溶液中,可生成物质E,该反应的离子方程式是______ 。
(5) (S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入
(S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入 的
的 溶液中,可制得该物质:
溶液中,可制得该物质: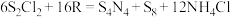 ,上述反应中,物质R体现的性质有
,上述反应中,物质R体现的性质有______ ,该反应每生成 转移电子
转移电子______ mol。
 反应的化学方程式
反应的化学方程式(2)下列有关图中所示含N、S物质的叙述,正确的是
a.在催化剂的作用下,R可将Y、Z还原为X
b.图中所示的物质中,只有W、D、E属于电解质
c.用玻璃棒分别蘸取浓的R溶液和浓的W溶液,玻璃棒靠近时有白烟产生
d.Z、C、F均能与NaOH溶液反应,都是酸性氧化物
e.制备焦亚硫酸钠(
 ),从氧化还原反应的角度分析,可选择B和D反应
),从氧化还原反应的角度分析,可选择B和D反应(3)写出B与氢氧化钠溶液反应的离子反应方程式
(4)将物质W的稀溶液加入物质D的溶液中,可生成物质E,该反应的离子方程式是
(5)
 (S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入
(S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入 的
的 溶液中,可制得该物质:
溶液中,可制得该物质: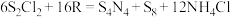 ,上述反应中,物质R体现的性质有
,上述反应中,物质R体现的性质有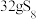 转移电子
转移电子
您最近半年使用:0次
2 . Ⅰ.高铁酸钾(K2FeO4) 是一种高效、无毒的强氧化剂,常温下为紫色固体,微溶于浓KOH溶液,能溶于水,且能与水反应放出氧气,并生成Fe(OH)3胶体。稳定性随pH的下降而减弱,酸性条件下易分解。
(1)下列有关铁及其化合物的性质与用途具有对应关系的是___________
Ⅱ.K2FeO4的净水原理如图所示:
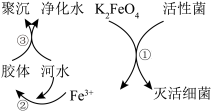
(2)下列说法错误的是___________
(3)写出K2FeO4与水反应的化学方程式___________ 。
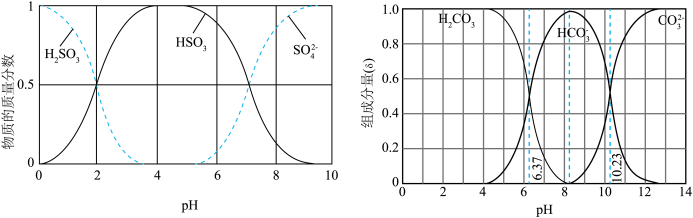
Ⅲ.已知可用Cl2与Fe(NO3)3制备K2FeO4(含副产品KCl、KNO3),查阅资料得知高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图所示:
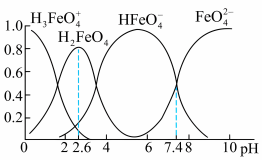
(4)①为获得尽可能纯净的高铁酸盐,pH应控制在___________ 。
②写出在此条件下,反应的离子方程式:___________ ;每生成39.6g K2FeO4,转移的电子数目为___________ ;
(5)已知溶液的酸碱性及离子浓度会对反应试剂的氧化性、还原性产生影响。
某实验小组研究不同反应试剂对K2FeO4产率的影响,对比实验如下:
注:上述实验中,溶液总体积、FeCl3和Fe(NO3)3的物质的量、Cl2的通入量均相同。
①由实验I、II的现象可知,Fe3+的还原性随溶液碱性的增强而___________ (填“增强”、“减弱”或“不变”);
②实验II中K2FeO4的产率比实验III低,试解释其可能的原因:___________ ;
③向实验II所得紫色溶液中继续通入Cl2,观察到溶液紫色变浅,试解释其可能的原因:___________ 。
(6)实验室测定含少量杂质的K2FeO4样品的纯度:称取0.1500g K2FeO4样品溶于碱性KI溶液中,调节pH至弱酸性使混合液充分反应。用0.1000 mol·L−1的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液25.00 mL。滴定时,发生反应的离子方程式:FeO + 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O
+ 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O = S4O
= S4O + 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:
+ 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:___________ (写出计算过程)。
(1)下列有关铁及其化合物的性质与用途具有对应关系的是___________
| A.铁粉具有还原性,可防止食物氧化变质 | B.高铁酸钾能溶于水,可作氧化剂 |
| C.氢氧化铁胶体具有碱性,可用于净水 | D.纯铁无杂质,可用作建筑材料 |
Ⅱ.K2FeO4的净水原理如图所示:

(2)下列说法错误的是___________
| A.K2FeO4中铁元素显+6价 |
| B.过程①中K2FeO4被细菌还原 |
| C.过程②中的Fe(OH)3胶体粒子带正电荷 |
| D.过程③中聚沉是由于胶体发生了渗析 |
(3)写出K2FeO4与水反应的化学方程式
Ⅲ.已知可用Cl2与Fe(NO3)3制备K2FeO4(含副产品KCl、KNO3),查阅资料得知高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图所示:

(4)①为获得尽可能纯净的高铁酸盐,pH应控制在
②写出在此条件下,反应的离子方程式:
(5)已知溶液的酸碱性及离子浓度会对反应试剂的氧化性、还原性产生影响。
某实验小组研究不同反应试剂对K2FeO4产率的影响,对比实验如下:
| 实验编号 | 反应试剂 | 实验现象 |
| Ⅰ | Cl2、FeCl3和少量KOH | 无明显现象 |
| Ⅱ | Cl2、FeCl3和过量KOH | 得到紫色溶液,无紫色固体 |
| Ⅲ | Cl2、Fe(NO3)3和过量KOH | 得到紫色溶液(颜色比Ⅱ深),有紫色固体 |
①由实验I、II的现象可知,Fe3+的还原性随溶液碱性的增强而
②实验II中K2FeO4的产率比实验III低,试解释其可能的原因:
③向实验II所得紫色溶液中继续通入Cl2,观察到溶液紫色变浅,试解释其可能的原因:
(6)实验室测定含少量杂质的K2FeO4样品的纯度:称取0.1500g K2FeO4样品溶于碱性KI溶液中,调节pH至弱酸性使混合液充分反应。用0.1000 mol·L−1的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液25.00 mL。滴定时,发生反应的离子方程式:FeO
 + 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O
+ 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O = S4O
= S4O + 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:
+ 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:
您最近半年使用:0次
名校
解题方法
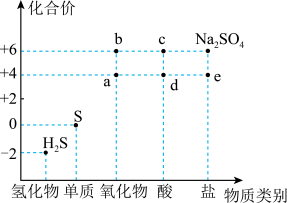
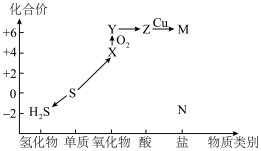
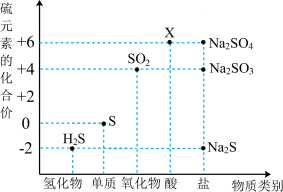
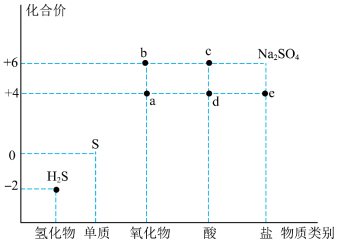
3 . 如图是硫元素的常见化合价与部分物质类别的对应关系。回答下列问题:_____ ,体现了c的_____ 性。
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质是_____ (填化学式)。
(3)将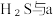 混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为
混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为_____ 。
(4)配平下列反应:_____ 。
_____
(5)为防止多余的a气体污染环境,应将尾气通入_____ 溶液中;
(6)将足量的 溶液中,下列说法正确的是
溶液中,下列说法正确的是_____ (填字母)。
A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入 ,则溶液中均会出现白色沉淀
,则溶液中均会出现白色沉淀

(7)将 片浸在不同质量分数的c溶液中,经4小时腐蚀后的质量损失情况如图所示,当c的浓度大于63%时,
片浸在不同质量分数的c溶液中,经4小时腐蚀后的质量损失情况如图所示,当c的浓度大于63%时, 被腐蚀的速率逐渐降低的可能原因为
被腐蚀的速率逐渐降低的可能原因为_____ 。 的污染并变废为宝,我国正在探索在一定条件下,用
的污染并变废为宝,我国正在探索在一定条件下,用 还原,
还原, 得到单质硫的方法来除去
得到单质硫的方法来除去 。写出该反应的化学方程式:
。写出该反应的化学方程式:_____ 。
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质是
(3)将
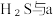 混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为
混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为(4)配平下列反应:
_____

(5)为防止多余的a气体污染环境,应将尾气通入
(6)将足量的
 溶液中,下列说法正确的是
溶液中,下列说法正确的是A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入
 ,则溶液中均会出现白色沉淀
,则溶液中均会出现白色沉淀
(7)将
 片浸在不同质量分数的c溶液中,经4小时腐蚀后的质量损失情况如图所示,当c的浓度大于63%时,
片浸在不同质量分数的c溶液中,经4小时腐蚀后的质量损失情况如图所示,当c的浓度大于63%时, 被腐蚀的速率逐渐降低的可能原因为
被腐蚀的速率逐渐降低的可能原因为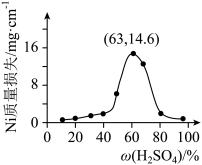
 的污染并变废为宝,我国正在探索在一定条件下,用
的污染并变废为宝,我国正在探索在一定条件下,用 还原,
还原, 得到单质硫的方法来除去
得到单质硫的方法来除去 。写出该反应的化学方程式:
。写出该反应的化学方程式:
您最近半年使用:0次
名校
4 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系: 的电子式为
的电子式为________ ;将 与X混合,可生成黄色固体,该反应氧化产物与还原产物的质量之比为
与X混合,可生成黄色固体,该反应氧化产物与还原产物的质量之比为________ 。
(2)S粉与热的Z浓溶液反应可转化为________ ,反应的化学方程式为________ 。
(3)配平下列反应:_____
____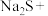 ____
____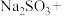 ____
____ ____
____ ____
____ ____
____
(4)下列有关硫及其化合物的性质,说法正确的是
(5)某同学为探究Cu与浓硫酸的反应,用如图所示的装置进行有关实验。________ 。
②C的作用是________ ,装置D中试管口放置的棉花应浸有一种液体,这种液体是________ 。
 的电子式为
的电子式为 与X混合,可生成黄色固体,该反应氧化产物与还原产物的质量之比为
与X混合,可生成黄色固体,该反应氧化产物与还原产物的质量之比为(2)S粉与热的Z浓溶液反应可转化为
(3)配平下列反应:
____
 ____
____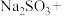 ____
____ ____
____ ____
____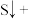 ____
____
(4)下列有关硫及其化合物的性质,说法正确的是
| A.X能使溴水褪色,证明X有漂白性 | B.将X通入 溶液中有白色沉淀生成 溶液中有白色沉淀生成 |
C.硫在过量的 中燃烧可以生成Y 中燃烧可以生成Y | D.若N为钠盐,则N与Z的稀溶液反应可生成 |
(5)某同学为探究Cu与浓硫酸的反应,用如图所示的装置进行有关实验。

②C的作用是
您最近半年使用:0次
名校
5 . 硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。___________ 、___________ 。
(2) 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是___________ 。
(3)已知 能被酸性
能被酸性 氧化为
氧化为 ,则
,则 的
的 溶液与
溶液与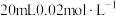 的
的 溶液恰好反应时,发生的离子方程式为:
溶液恰好反应时,发生的离子方程式为:___________ 。
(4)过二硫酸钠( )有强氧化性,在碱性条件下
)有强氧化性,在碱性条件下 溶液能将
溶液能将 氧化成
氧化成 ,且反应后的溶液滴入
,且反应后的溶液滴入 溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为
溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为___________ 。
(5)雌黄( )和雄黄(
)和雄黄( )在自然界中共生且可以相互转化(两者的硫元素价态均为
)在自然界中共生且可以相互转化(两者的硫元素价态均为 价)。
价)。
① 和
和 在盐酸中恰好完全反应转化为
在盐酸中恰好完全反应转化为 和
和 并放出
并放出 气体。则参加反应的
气体。则参加反应的 和
和 的物质的量之比为
的物质的量之比为___________ 。
② 和
和 可以相互转化,转化过程中存在如图所示的步骤。若
可以相互转化,转化过程中存在如图所示的步骤。若 参加反应时,转移
参加反应时,转移 电子,则物质a为
电子,则物质a为___________ 。

(2)
 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是(3)已知
 能被酸性
能被酸性 氧化为
氧化为 ,则
,则 的
的 溶液与
溶液与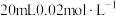 的
的 溶液恰好反应时,发生的离子方程式为:
溶液恰好反应时,发生的离子方程式为:(4)过二硫酸钠(
 )有强氧化性,在碱性条件下
)有强氧化性,在碱性条件下 溶液能将
溶液能将 氧化成
氧化成 ,且反应后的溶液滴入
,且反应后的溶液滴入 溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为
溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为(5)雌黄(
 )和雄黄(
)和雄黄( )在自然界中共生且可以相互转化(两者的硫元素价态均为
)在自然界中共生且可以相互转化(两者的硫元素价态均为 价)。
价)。①
 和
和 在盐酸中恰好完全反应转化为
在盐酸中恰好完全反应转化为 和
和 并放出
并放出 气体。则参加反应的
气体。则参加反应的 和
和 的物质的量之比为
的物质的量之比为②
 和
和 可以相互转化,转化过程中存在如图所示的步骤。若
可以相互转化,转化过程中存在如图所示的步骤。若 参加反应时,转移
参加反应时,转移 电子,则物质a为
电子,则物质a为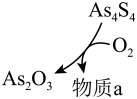
您最近半年使用:0次
2024-03-11更新
|
303次组卷
|
2卷引用:湖北省武汉市第二中学2023-2024学年高一下学期化学周练A卷(1)试卷
名校
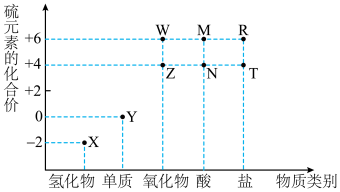
6 . 利用元素的化合价物质类别的坐标系,可以对含某元素的各物质性质有整体的认识。如图是硫元素的常见化合价与部分物质类别的对应关系。______ ;检验其阴离子的方法是______ 。
(2)化石燃料的燃烧可产生 ,在上述图表中它是
,在上述图表中它是______ (图中的字母),为避免过多 进入大气造成酸雨,沿海的火电站可利用天然海水(显弱碱性的微粒主要是
进入大气造成酸雨,沿海的火电站可利用天然海水(显弱碱性的微粒主要是 )吸收该物质,成本低廉。其过程如下。
)吸收该物质,成本低廉。其过程如下。 时,发生的主要反应的离子方程式为
时,发生的主要反应的离子方程式为______ 。
②氧化的目的是将硫元素全部转化为 ,该过程中溶液pH
,该过程中溶液pH______ (填“升高”“不变”或“降低”)。
③排放海水与原海水相比,减少的 与增加的
与增加的 的物质的量之比的为
的物质的量之比的为______ 。
(3) 溶液脱除空气污染物X并再生的原理如图所示。反应I的离子方程式为
溶液脱除空气污染物X并再生的原理如图所示。反应I的离子方程式为______ ;每脱除170kg X,消耗标准状况下 的体积为
的体积为______ L。
(2)化石燃料的燃烧可产生
 ,在上述图表中它是
,在上述图表中它是 进入大气造成酸雨,沿海的火电站可利用天然海水(显弱碱性的微粒主要是
进入大气造成酸雨,沿海的火电站可利用天然海水(显弱碱性的微粒主要是 )吸收该物质,成本低廉。其过程如下。
)吸收该物质,成本低廉。其过程如下。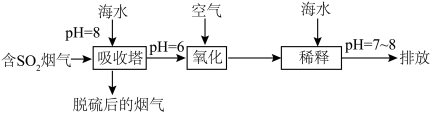
 时,发生的主要反应的离子方程式为
时,发生的主要反应的离子方程式为②氧化的目的是将硫元素全部转化为
 ,该过程中溶液pH
,该过程中溶液pH③排放海水与原海水相比,减少的
 与增加的
与增加的 的物质的量之比的为
的物质的量之比的为(3)
 溶液脱除空气污染物X并再生的原理如图所示。反应I的离子方程式为
溶液脱除空气污染物X并再生的原理如图所示。反应I的离子方程式为 的体积为
的体积为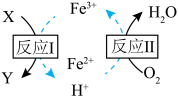
您最近半年使用:0次
名校
7 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
(1)X的浓溶液与碳在一定条件下可以发生反应,体现了X的___________ 性。从硫元素化合价变化的角度分析,图中只有还原性的物质有___________ (填化学式)。
(2)收集了一些含有S元素的酸雨,放置一段时间后,pH变小,小攀认为可能是因为酸雨中的亚硫酸被氧化为了___________ 。小登觉得可以设计实验验证这一推论,具体操作是___________ 。
(3)配平下列反应:___________
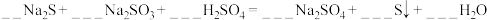 。
。
(4)如图是验证二氧化硫性质的实验装置。
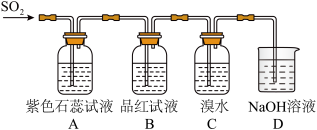
二氧化硫具有:①漂白性、②酸性氧化物性质、③还原性、④氧化性,上述装置中对应表现出的性质是:A中___________ (填序号,下同);B中___________ ;C中___________ 。D装置的作用是___________ 。

(1)X的浓溶液与碳在一定条件下可以发生反应,体现了X的
(2)收集了一些含有S元素的酸雨,放置一段时间后,pH变小,小攀认为可能是因为酸雨中的亚硫酸被氧化为了
(3)配平下列反应:
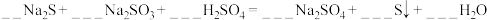 。
。(4)如图是验证二氧化硫性质的实验装置。

二氧化硫具有:①漂白性、②酸性氧化物性质、③还原性、④氧化性,上述装置中对应表现出的性质是:A中
您最近半年使用:0次
8 . 硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。
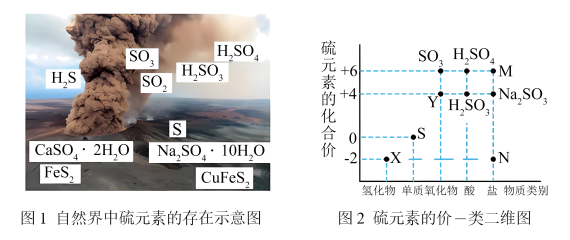
(1)图1中与图2中M、N对应的物质分别是
(2)X与Y反应中氧化剂与还原剂的物质的量之比为
(3)
 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是(4)已知
 能被酸性
能被酸性 氧化为
氧化为 ,则
,则 的
的 溶液与
溶液与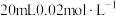 的
的 溶液恰好反应时,发生的离子方程式为:
溶液恰好反应时,发生的离子方程式为:(5)过二硫酸钠
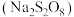 有强氧化性,在碱性条件下
有强氧化性,在碱性条件下 溶液能将
溶液能将 氧化成
氧化成 ,且反应后的溶液滴入
,且反应后的溶液滴入 溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为
溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为(6)雌黄
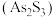 和雄黄
和雄黄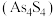 在自然界中共生且可以相互转化(两者的硫元素价态均为-2价)。
在自然界中共生且可以相互转化(两者的硫元素价态均为-2价)。① 和
和 在盐酸中恰好完全反应转化为
在盐酸中恰好完全反应转化为 和
和 并放出
并放出 气体。则参加反应的
气体。则参加反应的 和
和 的物质的量之比为
的物质的量之比为
② 和
和 可以相互转化,转化过程中存在如图所示的步骤。若
可以相互转化,转化过程中存在如图所示的步骤。若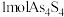 参加反应时,转移
参加反应时,转移 电子,则物质
电子,则物质 为
为
您最近半年使用:0次
名校
9 . 利用物质类别及核心元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系。回答下列问题:_____ 。
(2)c的浓溶液能与 反应的化学方程为
反应的化学方程为_____
(3)将足量的a通入 溶液中,下列说法正确的是
溶液中,下列说法正确的是_____ (填标号)。
A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入 或
或 ,则溶液中均会出现白色沉淀
,则溶液中均会出现白色沉淀
(4)实验室洗涤试管壁上附着的硫单质可用热的 溶液洗涤,该反应原理为
溶液洗涤,该反应原理为
①在该反应中,氧化剂和还原剂的物质的量之比为_____ 。
②向上述反应的溶液中再加入适量的稀 ,会产生淡黄色沉淀,写出该反应的离子方程式:
,会产生淡黄色沉淀,写出该反应的离子方程式:_____ 。
(5)已知e为正盐,能被酸性 氧化为
氧化为 被还原为
被还原为 ,写出此反应的离子方程式:
,写出此反应的离子方程式:_____ 。
(6)下列反应过程中的能量变化可用图表示的是_____ 。(填序号)
⑤食物因氧化而腐败;⑥ 与
与 反应;⑦氧化钙与水反应
反应;⑦氧化钙与水反应
(2)c的浓溶液能与
 反应的化学方程为
反应的化学方程为(3)将足量的a通入
 溶液中,下列说法正确的是
溶液中,下列说法正确的是A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入
 或
或 ,则溶液中均会出现白色沉淀
,则溶液中均会出现白色沉淀(4)实验室洗涤试管壁上附着的硫单质可用热的
 溶液洗涤,该反应原理为
溶液洗涤,该反应原理为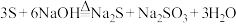
①在该反应中,氧化剂和还原剂的物质的量之比为
②向上述反应的溶液中再加入适量的稀
 ,会产生淡黄色沉淀,写出该反应的离子方程式:
,会产生淡黄色沉淀,写出该反应的离子方程式:(5)已知e为正盐,能被酸性
 氧化为
氧化为 被还原为
被还原为 ,写出此反应的离子方程式:
,写出此反应的离子方程式:(6)下列反应过程中的能量变化可用图表示的是
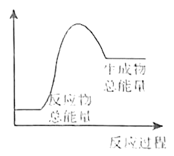
⑤食物因氧化而腐败;⑥
 与
与 反应;⑦氧化钙与水反应
反应;⑦氧化钙与水反应
您最近半年使用:0次
名校
10 . I.某同学通过查阅资料得知,常温下 和浓盐酸可以制备氯气。为此该同学和小组其他同学利用如图装置在实验室制取
和浓盐酸可以制备氯气。为此该同学和小组其他同学利用如图装置在实验室制取 并探究其有关性质:
并探究其有关性质:

(1)装置A中存在一处错误,改正这处错误:_______ 。有同学认为,上述装置还有另外一处的缺陷,并给出了改进措施。该改进措施是_______ 。
(2)配平装置A中发生反应的化学方程式: _______
_______ _______
_______ _______
_______ _______
_______
_______ 。
(3)为除去氯气中的氯化氢,需要在装置A、B之间添加装置E,其中加入_______ (填试剂名称),为了探究有色布条褪色的原理,需再添加装置E,其中加入浓硫酸,在整套装置中的添加位置为_______ (填序号)。
a.A、B之间 b.B、C之间 c.C、D之间 d.D之后
II.利用“价—类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。回答下列问题:
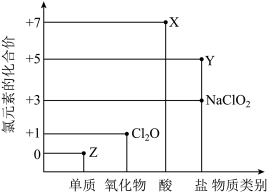
(4)X的电离方程式为_______ 。
(5)Y可用于实验室制 ,其焰色试验为紫色,则Y含有的化学键类型为
,其焰色试验为紫色,则Y含有的化学键类型为_______ ;Y在400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1,生成的两种盐的化学式分别为_______ 。
 和浓盐酸可以制备氯气。为此该同学和小组其他同学利用如图装置在实验室制取
和浓盐酸可以制备氯气。为此该同学和小组其他同学利用如图装置在实验室制取 并探究其有关性质:
并探究其有关性质:
(1)装置A中存在一处错误,改正这处错误:
(2)配平装置A中发生反应的化学方程式:
 _______
_______ _______
_______ _______
_______ _______
_______
(3)为除去氯气中的氯化氢,需要在装置A、B之间添加装置E,其中加入
a.A、B之间 b.B、C之间 c.C、D之间 d.D之后
II.利用“价—类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。回答下列问题:

(4)X的电离方程式为
(5)Y可用于实验室制
 ,其焰色试验为紫色,则Y含有的化学键类型为
,其焰色试验为紫色,则Y含有的化学键类型为
您最近半年使用:0次
2023-03-28更新
|
282次组卷
|
3卷引用:天津市第五十四中学2023-2024学年高一上学期期末化学试卷
天津市第五十四中学2023-2024学年高一上学期期末化学试卷天津市新华中学2022-2023学年高一上学期期末考试化学试题(已下线)专题05 氯及其化合物-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(天津专用)



