名校
解题方法
1 . 工业上可用盐酸、饱和食盐水和二氧化锰浸取方铅矿(主要成分为 ,含有
,含有 等杂质)。
等杂质)。
已知:ⅰ、常温下, 难溶于水;
难溶于水; 可以与
可以与 形成
形成
ⅱ、 可溶于一定浓度的盐酸。
可溶于一定浓度的盐酸。
ⅲ、浸取过程中还存在如下图的反应。
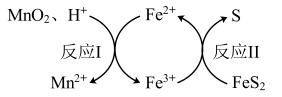
下列说法不正确的是
 ,含有
,含有 等杂质)。
等杂质)。已知:ⅰ、常温下,
 难溶于水;
难溶于水; 可以与
可以与 形成
形成
ⅱ、
 可溶于一定浓度的盐酸。
可溶于一定浓度的盐酸。ⅲ、浸取过程中还存在如下图的反应。

下列说法不正确的是
A.浸取方铅矿时,饱和食盐水的作用主要是提高含 物质的溶解性 物质的溶解性 |
B.反应Ⅰ中,每消耗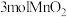 ,生成 ,生成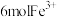 |
C.反应Ⅱ中,发生反应的离子方程式为: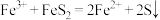 |
D.反应Ⅱ速率逐渐变慢,其原因可能是生成的 覆盖在 覆盖在 固体表面 固体表面 |
您最近一年使用:0次
2023-04-29更新
|
398次组卷
|
3卷引用:北京市丰台区2023届高三下学期二模考试化学试题
名校
2 . 研究 的利用对促进低碳社会的构建具有重要意义。下列有关
的利用对促进低碳社会的构建具有重要意义。下列有关 的应用中,涉及氧化还原反应的是
的应用中,涉及氧化还原反应的是
 的利用对促进低碳社会的构建具有重要意义。下列有关
的利用对促进低碳社会的构建具有重要意义。下列有关 的应用中,涉及氧化还原反应的是
的应用中,涉及氧化还原反应的是A.用 制纯碱 制纯碱 | B.用 制甲醇 制甲醇 |
| C.用干冰制造“云雾” | D.用 制碳酸饮料 制碳酸饮料 |
您最近一年使用:0次
2023-04-29更新
|
617次组卷
|
4卷引用:北京市丰台区2023届高三下学期二模考试化学试题
3 . 北京冬奥会成功举办、神舟十三号顺利往返、“天宫课堂”如期开讲及“华龙一号”核电海外投产等,均展示了我国科技发展的巨大成就。下列相关叙述正确的是
A.冬奥会“飞扬”火炬所用的燃料 为氧化性气体 为氧化性气体 |
| B.飞船返回舱表层材料中的玻璃纤维属于天然有机高分子 |
| C.乙酸钠过饱和溶液析出晶体并放热的过程仅涉及化学变化 |
D.核电站反应堆所用铀棒中含有的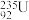 与 与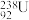 互为同位素 互为同位素 |
您最近一年使用:0次
2022-06-10更新
|
14824次组卷
|
30卷引用:北京市丰台区2022-2023学年高一下学期期末考试化学试题
北京市丰台区2022-2023学年高一下学期期末考试化学试题2022年新高考广东化学高考真题(已下线)2022年广东卷高考真题变式题(1-10)(已下线)专题01 STSE化学用语-2022年高考真题模拟题分项汇编(已下线)专题01 STSE 化学用语-三年(2020-2022)高考真题分项汇编(已下线)专题06 物质结构元素周期律-三年(2020-2022)高考真题分项汇编(已下线)考点01 物质的分类和转化-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第03讲 物质的组成、性质和分类(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第01讲 物质的分类及转化(讲)-2023年高考化学一轮复习讲练测(新教材新高考)河南省濮阳市第一高级中学2022-2023学年高三上学期第一次月考化学试题(已下线)专题02 化学基本概念-备战2023年高考化学母题题源解密(广东卷)宁夏平罗中学2022-2023学年高三上学期第一次月考化学试题湖南攸县第四中学2022-2023学年高三上学期第一次月考化学试题北京市第一七一中学2022-2023学年高三上学期期中考试化学试题(已下线)专题01 STSE 物质的分类、性质与变化(讲)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题二 化学与STSE-实战高考·二轮复习核心突破(已下线)专题一 物质的组成分类-实战高考·二轮复习核心突破坚持素养导向 突出创新命题山东省临沂第一中学2022-2023学年高三上学期过程性检测化学试题情境4 聚焦时事热点 挖掘高考素材(已下线)题型7 物质的组成、性质在实际中的应用(已下线)回归教材重难点01 化学与STSE-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)题型3 科研成果-高考必备50个题型(已下线)专题01 化学与STSE(已下线)专题01 化学与STSE(已下线)第1讲 物质的分类-新(已下线)专题01 化学与STSE 物质的组成、性质和用途-2023年高考化学真题题源解密(新高考专用)(已下线)专题01 化学与STSE 物质的组成、性质和用途-2023年高考化学真题题源解密(全国通用)河北省涞水北雄高级中学2022-2023学年高三下学期3月月考化学试题海南省海口市第一中学2023-2024学年高二上学期第一次月考化学试题
名校
4 . 下列物质的用途涉及氧化还原反应的是
| A.用NaHCO3作食品膨松剂 |
| B.用暖宝贴(成分:铁粉、水、食盐、活性炭等)供热 |
| C.用饱和Na2CO3溶液和盐酸处理水垢中的CaSO4 |
| D.用可溶性的铁盐、铝盐作净水剂 |
您最近一年使用:0次
2022-04-29更新
|
276次组卷
|
3卷引用:北京市丰台区2022届高三二模化学试题
名校
解题方法
5 . 硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法不正确 的是


| A.过程①中,生成CuS的反应为H2S+Cu2+=CuS↓+2H+ |
| B.过程②中,CuS作还原剂 |
| C.过程③中,各元素化合价均未改变 |
| D.回收S的总反应为2H2S+O2=2H2O+2S↓ |
您最近一年使用:0次
2022-01-25更新
|
1122次组卷
|
6卷引用:北京市丰台区2021-2022学年高一上学期期末考试化学试题
6 . 某小组同学探究Cu和H2O2的反应。
【猜想预测】
猜想1:Cu与H2O2不发生反应;
猜想2:Cu与H2O2可能发生氧化还原反应,H2O2作氧化剂。
【实验探究】
实验ⅰ:向装有0.5 g Cu的烧杯中加入20 mL 30% H2O2溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
(1)通过该实验证明了猜想2成立,写出该反应的化学方程式:________ 。
【继续探究】
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
资料:Cu2++ 4NH3⇌[ Cu(NH3)4]2+,[ Cu(NH3)4]2+为深蓝色;Cu(OH)2可溶于氨水形成深蓝色溶液。
(2)实验ⅱ中:溶液变蓝的原因是________ (用化学用语解释);经检验产生的气体为氧气,产生氧气的原因是________ 。
(3)对比实验ⅰ和ⅲ,为探究氨水对Cu的还原性或H2O2氧化性的影响,该同学利用如图装置继续实验。
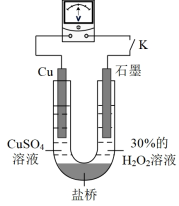
已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U形管右侧溶液中滴加氨水后,电压不变。
c.继续向U形管左侧溶液中滴加氨水后,电压增大了y。
该实验的结论:_________ 。利用该方法也可证明酸性增强可提高H2O2的氧化性,导致Cu溶解速率加快。
(4)对比实验ⅱ和ⅲ,实验ⅲ中产生氧气速率明显更快,可能的原因是_______ 。
(5)实验ⅲ有少量蓝色不溶物,小组同学加入少量NH4Cl可使其溶解,结合文字和化学用语解释不溶物溶解的原因:________ 。
(6)基于以上实验,影响Cu与H2O2反应速率的因素有________ 。
【猜想预测】
猜想1:Cu与H2O2不发生反应;
猜想2:Cu与H2O2可能发生氧化还原反应,H2O2作氧化剂。
【实验探究】
实验ⅰ:向装有0.5 g Cu的烧杯中加入20 mL 30% H2O2溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
(1)通过该实验证明了猜想2成立,写出该反应的化学方程式:
【继续探究】
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
资料:Cu2++ 4NH3⇌[ Cu(NH3)4]2+,[ Cu(NH3)4]2+为深蓝色;Cu(OH)2可溶于氨水形成深蓝色溶液。
| 装置 | 序号 | 试剂a | 现象 |
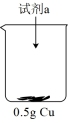 | ⅱ | 20 mL 30% H2O2与4 mL 5 mol/L H2SO4混合液 | Cu表面很快生产少量气泡,溶液逐渐变蓝,产生较多气泡 |
| ⅲ | 20 mL 30% H2O2与4 mL5 mol/L氨水混合液 | 溶液立即变为深蓝色,产生大量气泡,Cu表面有少量蓝色不溶物 |
(2)实验ⅱ中:溶液变蓝的原因是
(3)对比实验ⅰ和ⅲ,为探究氨水对Cu的还原性或H2O2氧化性的影响,该同学利用如图装置继续实验。

已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U形管右侧溶液中滴加氨水后,电压不变。
c.继续向U形管左侧溶液中滴加氨水后,电压增大了y。
该实验的结论:
(4)对比实验ⅱ和ⅲ,实验ⅲ中产生氧气速率明显更快,可能的原因是
(5)实验ⅲ有少量蓝色不溶物,小组同学加入少量NH4Cl可使其溶解,结合文字和化学用语解释不溶物溶解的原因:
(6)基于以上实验,影响Cu与H2O2反应速率的因素有
您最近一年使用:0次
2020-06-06更新
|
339次组卷
|
3卷引用:北京市丰台区2020届高三下学期高三综合练习(二)化学试题
7 . NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒.已知NaNO2能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是___ ,氧化产物是___ (填写化学式)。
(2)根据上述反应,鉴别NaNO2、NaCl.可选用的物质有:①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有______ (填序号)。
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是______ (填编号)。
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(4)化学方程式:10Al+6NaNO3+4NaOH═10NaAlO2+3N2↑+2H2O.若反应过程中转移5mole-,则生成标准状况下N2的体积为______ L。
(1)上述反应中氧化剂是
(2)根据上述反应,鉴别NaNO2、NaCl.可选用的物质有:①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(4)化学方程式:10Al+6NaNO3+4NaOH═10NaAlO2+3N2↑+2H2O.若反应过程中转移5mole-,则生成标准状况下N2的体积为
您最近一年使用:0次
2019-11-26更新
|
111次组卷
|
3卷引用:北京师范大学实验中学丰台学校2019-2020学年高三上学期期中考试化学试题
11-12高一上·湖北荆州·期中
名校
8 . 氢化钙可作为生氢剂,反应的化学方程式为CaH2+2H2O===Ca(OH)2+2H2↑,下列说法错误的是( )
| A.CaH2既是氧化剂,又是还原剂 |
| B.H2既是氧化产物,又是还原产物 |
| C.CaH2是还原剂,H2O是氧化剂 |
| D.氧化产物与还原产物的质量比为1∶1 |
您最近一年使用:0次
2018-09-08更新
|
607次组卷
|
25卷引用:北京市第十八中学2023-2024学年高一上学期10月阶段性检测化学试题
北京市第十八中学2023-2024学年高一上学期10月阶段性检测化学试题(已下线)2011-2012年湖北省荆州中学高一上学期期中考试化学试卷(已下线)2013-2014山西省大同一中高一12月月考化学试卷(已下线)2015届甘肃省民乐县一中高三第一次诊断考试化学试卷2015-2016学年安徽合肥168中高一上开学考试化学试卷2015-2016学年山西阳泉十五中高三第一次阶段考试化学试卷2016届河南省宜阳县实验学校高三第二次月考化学试卷2016届山西省太原市外国语学校高三上学期11月半月考试化学试卷 2018-2019学年高中化学鲁科版必修1 章末综合测评2(已下线)【新东方】高中化学5037安徽省定远县育才学校2020-2021学年高一上学期11月质量检测化学试题湖南省平江县第一中学2020-2021学年高一上学期第一次月考化学试题安徽省合肥瑶海区合肥市第十一中学2020-2021学年高一上学期期中考试化学试题湖南省常德市第一中学2020-2021学年高一上学期第2次月考化学试题(已下线)【浙江新东方】在线化学 (24)(已下线)【浙江新东方】在线化学40北京市朝阳区中国人民大学附属中学朝阳学校2019-2020学年高一上学期10月月考化学试卷安徽省安庆市怀宁县第二中学2022-2023学年高一上学期期中考试化学试题上海市回民中学2022-2023学年高一上学期期末考试化学试题陕西省西安市高新第一中学2021-2022学年高一上学期期末考试化学试题甘肃省张掖市2022-2023学年高一下学期第一次全市联考化学试题甘肃省张掖市2023届高三下学期第一次联考化学试题湖南省长沙市南雅中学2023-2024学年高一上学期第一次月考化学试题北京市第八十中学2023-2024学年高一上学期10月月考化学试题新疆阿克苏市实验中学2022-2023学年高一下学期第一次月考化学试题
名校
9 . 处理超标电镀废水,使其NaCN含量低于0.5 mg/L,即可达到排放标准,反应分两步进行。第一步NaCN与NaClO反应,生成NaOCN和NaCl。第二步NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2。已知HCN是弱酸,易挥发,有剧毒;HCN、HOCN中N元素的化合价相同。下列说法正确的是
| A.处理NaCN超标电镀废水的过程中无元素化合价的改变 |
| B.第一步反应溶液应调节为酸性,可避免生成有毒物质HCN |
| C.第二步发生的反应为2OCN- + 3ClO- =2CO2↑ + CO32− + 3Cl- + N2↑ |
| D.处理100 m3含NaCN 10.3 mg/L的废水实际至少需要50 mol NaClO |
您最近一年使用:0次
2018-01-20更新
|
523次组卷
|
7卷引用:北京市丰台区2018届高三上学期期末考试化学试题



