1 . 下列粒子组在水溶液中能否共存的结论及解释完全正确的是
| 选项 | 粒子组 | 是否共存 | 解释 |
| A | 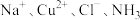 | 否 | 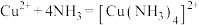 |
| B | 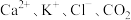 | 否 |  |
| C | 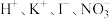 | 能 | 离子间不反应 |
| D |
| 否 |
|
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
2 . 下列各组粒子在溶液中能大量共存,且在加入试剂X后,发生反应的离子方程式正确的是
| 选项 | 粒子 | 试剂X | 发生的离子反应 |
| A |  | 少量醋酸 |  |
| B |  | 少量硫化钠 |  |
| C |  | 少量纯碱 |  |
| D | 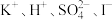 | 少量氧化铁 |  |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
3 . 利用废电池材料 (含炭黑及少量
(含炭黑及少量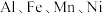 等元素)回收金属资源的工艺流程如下:
等元素)回收金属资源的工艺流程如下: 如下表:
如下表:
②电极电位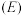 表示溶液中某微粒获得电子被还原的趋势(即氧化性);如电极反应
表示溶液中某微粒获得电子被还原的趋势(即氧化性);如电极反应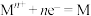 的
的 越大,表示
越大,表示 的氧化性越强。
的氧化性越强。
酸性条件: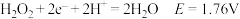 ;
;
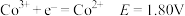
碱性条件: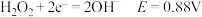 ;
;
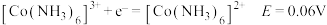
③丁二酮肟是不溶于水的固体,溶于乙醇后可与 反应生成丁二酮肟镍。
反应生成丁二酮肟镍。 转化后的钴离子价电子排布式为
转化后的钴离子价电子排布式为______ ,滤渣1为______ 。
(2)“氧化调 "中,
"中, 转化为
转化为 ,滤渣2中还有
,滤渣2中还有______ ,调节 范围为
范围为______ 。
(3)“转化”时,加入浓氨水将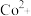 转化为
转化为 的原因是
的原因是______ ,加 目的是
目的是______ 。
(4)“沉镍”后,从滤渣3中回收丁二酮肟固体的操作是______ 。
(5)由 溶液制备催化剂
溶液制备催化剂 的步骤为:第一步加入尿素
的步骤为:第一步加入尿素 生成
生成 沉淀(有
沉淀(有 气体产生),第二步焙烧得到
气体产生),第二步焙烧得到 。写出第一步的离子方程式
。写出第一步的离子方程式______ 。
(6)由 制备得一种锂离子电池材料
制备得一种锂离子电池材料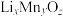 ,其晶胞分别由4个
,其晶胞分别由4个 个
个 立方单元构成。则
立方单元构成。则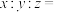
______ 。
 (含炭黑及少量
(含炭黑及少量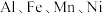 等元素)回收金属资源的工艺流程如下:
等元素)回收金属资源的工艺流程如下:
 如下表:
如下表:氢氧化物 |
|
|
|
|
完全沉淀 | 9.2 | 1.3 | 4.7 | 3.1 |
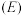 表示溶液中某微粒获得电子被还原的趋势(即氧化性);如电极反应
表示溶液中某微粒获得电子被还原的趋势(即氧化性);如电极反应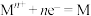 的
的 越大,表示
越大,表示 的氧化性越强。
的氧化性越强。酸性条件:
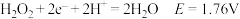 ;
;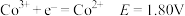
碱性条件:
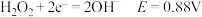 ;
;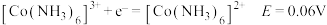
③丁二酮肟是不溶于水的固体,溶于乙醇后可与
 反应生成丁二酮肟镍。
反应生成丁二酮肟镍。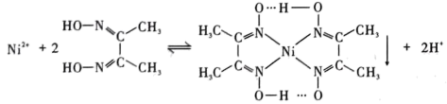
 转化后的钴离子价电子排布式为
转化后的钴离子价电子排布式为(2)“氧化调
 "中,
"中, 转化为
转化为 ,滤渣2中还有
,滤渣2中还有 范围为
范围为(3)“转化”时,加入浓氨水将
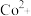 转化为
转化为 的原因是
的原因是 目的是
目的是(4)“沉镍”后,从滤渣3中回收丁二酮肟固体的操作是
(5)由
 溶液制备催化剂
溶液制备催化剂 的步骤为:第一步加入尿素
的步骤为:第一步加入尿素 生成
生成 沉淀(有
沉淀(有 气体产生),第二步焙烧得到
气体产生),第二步焙烧得到 。写出第一步的离子方程式
。写出第一步的离子方程式(6)由
 制备得一种锂离子电池材料
制备得一种锂离子电池材料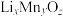 ,其晶胞分别由4个
,其晶胞分别由4个 个
个 立方单元构成。则
立方单元构成。则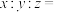

您最近半年使用:0次
名校
4 . 标准电极电位指离子有效浓度为1mol/L时相对标准氢电极的电极电位差值,电对的标准电极电势 越高,其电对中氧化剂的氧化性越强。酸性介质中,以下电对的标准电极电势为:①
越高,其电对中氧化剂的氧化性越强。酸性介质中,以下电对的标准电极电势为:①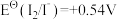 ;②
;②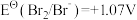 ;③
;③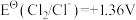 ;④
;④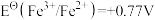 ;⑤
;⑤ ;⑥
;⑥ 。下列有关说法正确的是
。下列有关说法正确的是
 越高,其电对中氧化剂的氧化性越强。酸性介质中,以下电对的标准电极电势为:①
越高,其电对中氧化剂的氧化性越强。酸性介质中,以下电对的标准电极电势为:①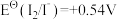 ;②
;②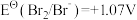 ;③
;③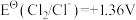 ;④
;④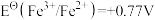 ;⑤
;⑤ ;⑥
;⑥ 。下列有关说法正确的是
。下列有关说法正确的是A.向1mol/L的HBr溶液中滴加 溶液,无明显现象发生 溶液,无明显现象发生 |
B.2mol/L的 与2mol/L的稀盐酸等体积混合有大量 与2mol/L的稀盐酸等体积混合有大量 产生 产生 |
C.在含 、 、 、 、 的混合溶液中若仅氧化 的混合溶液中若仅氧化 ,最佳的氧化剂是 ,最佳的氧化剂是 |
D.浓度相等时,还原性: |
您最近半年使用:0次
名校
解题方法
5 . 下列过程中的化学反应对应的离子方程式正确的是
A. 胶体的制备: 胶体的制备: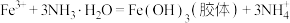 |
B.含氟牙膏防龋齿[牙齿表面含有羟基磷灰石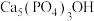 ]: ]: |
C.向含有 明矾溶液中滴加 明矾溶液中滴加 溶液至铝离子完全沉淀: 溶液至铝离子完全沉淀: |
D.向含有 的溶液中通入一定量氯气发生反应,当转移电子数为 的溶液中通入一定量氯气发生反应,当转移电子数为 时: 时: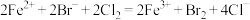 |
您最近半年使用:0次
6 . 已知X、Y、Z、W是短周期原子序数依次增大的四种元素。其中Z的单质是如今常见电子设备的电池负极中失电子的物质,W的原子序数是X、Y、Z三者最外层电子数之和的四倍。下列说法错误的是
| A.X是宇宙中含量最高的元素 |
| B.Y元素单质由单原子分子组成 |
| C.Z元素的原子半径是同周期所有元素中最小的 |
| D.W元素既能形成氧化性很强的物质,又能形成还原性很强的物质 |
您最近半年使用:0次
7 . 磷精矿主要成分为Ca5F(PO4)3,含少量REPO4、FeO、Fe2O3、SiO2,其中RE代表稀土元素。从磷精矿分离稀土元素的工业流程如下:

(1)RE属于ⅢB族,其中Sc的基态原子核外电子排布式为_______ 。
(2)“酸浸”过程HNO3与Ca5F(PO4)3反应生成两种酸,写出其化学方程式_______ 。
(3)“萃取”的目的是富集RE,但其余元素也会按一定比例进入萃取剂中。通过3ROH+POCl3⇌(RO)3PO+3HCl制得有机磷萃取剂(RO)3PO,其中−R代表烃基,其对(RO)3PO产率的影响如下表。
由表可知,随着碳原子数增加,烃基_______ (填“推电子”或“吸电子”)能力增强,O−H键更难断裂,(RO)3PO产率降低。
(4)“反萃取”的目的是分离RE和Fe元素。向“萃取液”中通入NH3,Fe2+、Fe3+、Re3+的沉淀率随pH变化如图。
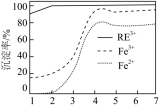
①试剂X为_______ (填“Na2SO3”或“NaClO”),应调节pH为_______ 。
②通入NH3得到REPO4沉淀的过程为:i.H3PO4+3NH3=(NH4)3PO4
ii._______ (写出该过程的离子方程式)
(5)若略去“净化”过程,则制得的草酸稀土会混有_______ 杂质(填化学式)。
(6)在整个工艺中,可从副产物中提取_______ 、_______ (填名称),用于生产氮肥。

(1)RE属于ⅢB族,其中Sc的基态原子核外电子排布式为
(2)“酸浸”过程HNO3与Ca5F(PO4)3反应生成两种酸,写出其化学方程式
(3)“萃取”的目的是富集RE,但其余元素也会按一定比例进入萃取剂中。通过3ROH+POCl3⇌(RO)3PO+3HCl制得有机磷萃取剂(RO)3PO,其中−R代表烃基,其对(RO)3PO产率的影响如下表。
| −R | −CH2CH3 | −CH2CH2CH3 | −CH2CH2CH2CH3 |
| (RO)3PO产率/% | 82 | 62 | 20 |
(4)“反萃取”的目的是分离RE和Fe元素。向“萃取液”中通入NH3,Fe2+、Fe3+、Re3+的沉淀率随pH变化如图。

①试剂X为
②通入NH3得到REPO4沉淀的过程为:i.H3PO4+3NH3=(NH4)3PO4
ii.
(5)若略去“净化”过程,则制得的草酸稀土会混有
(6)在整个工艺中,可从副产物中提取
您最近半年使用:0次
23-24高三上·辽宁·期中
8 . 硫代碳酸钠能用于处理废水中的重金属离子,可通过如下反应制备:
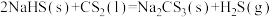
下列说法错误的是
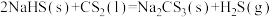
下列说法错误的是
A.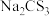 具有还原性 具有还原性 | B. 是直线形非极性分子 是直线形非极性分子 |
C.该反应中 是氧化产物 是氧化产物 | D.电负性: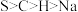 |
您最近半年使用:0次
2023-12-14更新
|
142次组卷
|
3卷引用:选择题6-10
9 . 探究卤族元素单质及其化合物的性质,下列方案设计现象和结论都正确的是
| 选项 | 实验方案 | 现象 | 结论 |
| A | 往碘的 溶液中加入等体积浓KI溶液,振荡 溶液中加入等体积浓KI溶液,振荡 | 分层,下层紫红色变浅粉红色,上层呈棕黄色 | 碘在浓KI溶液中溶解能力大于在 中溶解能力 中溶解能力 |
| B | 用玻璃棒蘸取次氯酸钠溶液点在pH试纸上 | 试纸变白 | 次氯酸钠溶液呈中性 |
| C | 将酸化的 溶液滴入 溶液滴入 溶液中 溶液中 | 溶液变黄色 |  的氧化性大于 的氧化性大于 |
| D | 取两份新制氯水,分别滴加 溶液和淀粉KI溶液 溶液和淀粉KI溶液 | 前者有白色沉淀,后者溶液变蓝 | 氯气与水的反应存在限度 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
10 .  、
、 都是大气污染物。请回答下列有关问题:
都是大气污染物。请回答下列有关问题:
(1)碘循环工艺能吸收 ,降低环境污染,同时又能制得氢气,反应过程如下图:
,降低环境污染,同时又能制得氢气,反应过程如下图:_______ ,氧化剂与还原剂的物质的量之比为_______ ,反应温度控制在20~100℃的原因是_______ 。
②若有196g 生成,理论上产生氢气的体积为
生成,理论上产生氢气的体积为_______ L(标准状况)。
(2)工业上用 溶液吸收
溶液吸收 ,生成等物质的量的两种钠盐,其中一种为
,生成等物质的量的两种钠盐,其中一种为 ,同时还有一种气体生成,则该反应的离子方程式为
,同时还有一种气体生成,则该反应的离子方程式为_______ 。
(3)工业上脱出 ,也可以在加热和催化剂作用下用
,也可以在加热和催化剂作用下用 还原生成
还原生成 和
和 ,实验测得温度高于400℃时,
,实验测得温度高于400℃时, 脱出率减小,其原因可能是
脱出率减小,其原因可能是_______ 。
(4)工业上可用 吸收含
吸收含 的烟气得到
的烟气得到 ,将50.7g
,将50.7g 受热分解,分解过程中的热重曲线(固体质量随温度变化的曲线)如图所示。
受热分解,分解过程中的热重曲线(固体质量随温度变化的曲线)如图所示。_______ 。
②1160℃时,所得固体的化学式为_______ 。
 、
、 都是大气污染物。请回答下列有关问题:
都是大气污染物。请回答下列有关问题:(1)碘循环工艺能吸收
 ,降低环境污染,同时又能制得氢气,反应过程如下图:
,降低环境污染,同时又能制得氢气,反应过程如下图: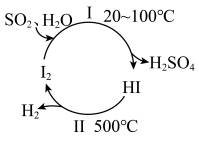
②若有196g
 生成,理论上产生氢气的体积为
生成,理论上产生氢气的体积为(2)工业上用
 溶液吸收
溶液吸收 ,生成等物质的量的两种钠盐,其中一种为
,生成等物质的量的两种钠盐,其中一种为 ,同时还有一种气体生成,则该反应的离子方程式为
,同时还有一种气体生成,则该反应的离子方程式为(3)工业上脱出
 ,也可以在加热和催化剂作用下用
,也可以在加热和催化剂作用下用 还原生成
还原生成 和
和 ,实验测得温度高于400℃时,
,实验测得温度高于400℃时, 脱出率减小,其原因可能是
脱出率减小,其原因可能是(4)工业上可用
 吸收含
吸收含 的烟气得到
的烟气得到 ,将50.7g
,将50.7g 受热分解,分解过程中的热重曲线(固体质量随温度变化的曲线)如图所示。
受热分解,分解过程中的热重曲线(固体质量随温度变化的曲线)如图所示。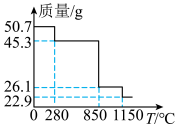
②1160℃时,所得固体的化学式为
您最近半年使用:0次
2023-11-05更新
|
139次组卷
|
2卷引用:重庆市2023-2024学年高三上学期11月调研测试化学试题

 、
、 、
、 、
、
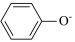 +
+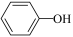 +
+






