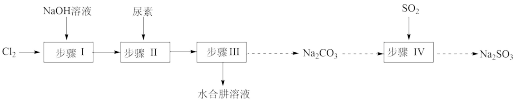
1 . 以Cl2、NaOH、CO(NH2)2(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如图:
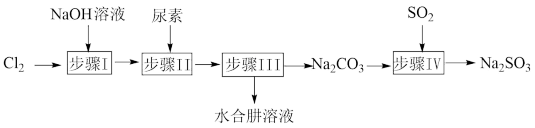
已知:①Cl2+2OH-=ClO-+Cl-+H2O是放热反应;②N2H4·H2O沸点约118°C,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤I为制备NaClO溶液,若温度超过40°C,则Cl2与NaOH溶液反应生成NaClO3和NaCl。该反应的离子方程式为_______ ;实验中为避免反应过于剧烈,放出大量的热而导致温度升高,副反应加剧,除可以用冰水浴控制温度外,还可以采取的措施为_______ 。
(2)步骤II为合成N2H4·H2O的装置如图1所示。NaClO碱性溶液与尿素水溶液在40°C以下反应一段时间后,再迅速升温至110°C继续反应。
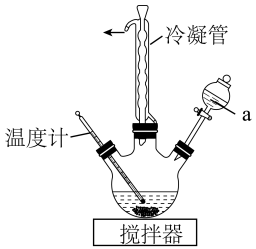
①图1中仪器a的名称为_______ ,其盛装的溶液是_______ [填“NaClO碱性溶液”或“CO(NH2)2水溶液”]。
②写出合N2H4·H2O发生的反应的离子方程式:_______ ;使用冷凝管的目的是_______ 。
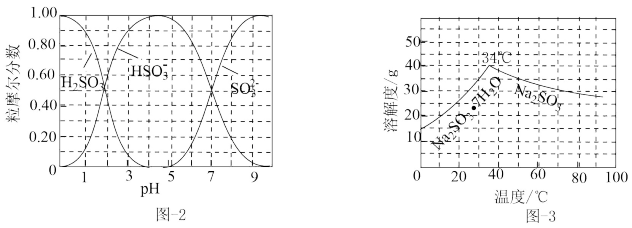
(3)步骤IV为用步骤III得到的副产品Na2CO3溶液制备无水Na2SO3(已知水溶液中H2SO3、HSO 、SO
、SO 随pH的分布如图2所示,Na2SO3的溶解度曲线如图3所示)。
随pH的分布如图2所示,Na2SO3的溶解度曲线如图3所示)。

①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定停止通SO2的实验操作为_______ 。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为_______ 时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于_______ °C条件下趁热过滤,用少量无水乙醇洗涤,干燥,密封保存。

已知:①Cl2+2OH-=ClO-+Cl-+H2O是放热反应;②N2H4·H2O沸点约118°C,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤I为制备NaClO溶液,若温度超过40°C,则Cl2与NaOH溶液反应生成NaClO3和NaCl。该反应的离子方程式为
(2)步骤II为合成N2H4·H2O的装置如图1所示。NaClO碱性溶液与尿素水溶液在40°C以下反应一段时间后,再迅速升温至110°C继续反应。

①图1中仪器a的名称为
②写出合N2H4·H2O发生的反应的离子方程式:
(3)步骤IV为用步骤III得到的副产品Na2CO3溶液制备无水Na2SO3(已知水溶液中H2SO3、HSO
 、SO
、SO 随pH的分布如图2所示,Na2SO3的溶解度曲线如图3所示)。
随pH的分布如图2所示,Na2SO3的溶解度曲线如图3所示)。
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定停止通SO2的实验操作为
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为
您最近一年使用:0次
名校
解题方法
2 . Ⅰ.二氯砜(SO2Cl2)是一种发烟液体,遇水剧烈水解,69.1℃时沸腾。某小组拟用干燥的Cl2和SO2在活性炭催化下制备二氯砜。反应的方程式为: ,实验装置如图所示(部分夹持装置略去):
,实验装置如图所示(部分夹持装置略去):

(1)装置A中发生反应的离子反应方程式为___________ 。
(2)仪器C的名称为___________ ,冷凝管的进水口为___________ (选填“a”或“b”)。
(3)分液漏斗中盛放的最佳试剂为___________ ,装置B、D的作用为___________ 。
(4)装置F的作用为___________ 。
Ⅱ.二氯亚砜(SO2Cl2)也是一种发烟液体,常用作脱水剂,遇水会形成白雾,并有刺激性气味的气体逸出。
(5)写出二氯亚砜与水反应的化学方程式___________ 。
(6)用硫磺、液氯和SO3为原料,在一定条件下合成二氯亚砜(SOCl2),原子利用率可达 ,则三者的物质的量之比为
,则三者的物质的量之比为___________ 。
 ,实验装置如图所示(部分夹持装置略去):
,实验装置如图所示(部分夹持装置略去):
(1)装置A中发生反应的离子反应方程式为
(2)仪器C的名称为
(3)分液漏斗中盛放的最佳试剂为
(4)装置F的作用为
Ⅱ.二氯亚砜(SO2Cl2)也是一种发烟液体,常用作脱水剂,遇水会形成白雾,并有刺激性气味的气体逸出。
(5)写出二氯亚砜与水反应的化学方程式
(6)用硫磺、液氯和SO3为原料,在一定条件下合成二氯亚砜(SOCl2),原子利用率可达
 ,则三者的物质的量之比为
,则三者的物质的量之比为
您最近一年使用:0次
2021-11-11更新
|
773次组卷
|
3卷引用:甘肃省天水市第一中学2021-2022高三上学期第三次考试化学试题
3 . 三氯化铁在工农业生产中具有重要的用途。
(1)已知三氯化铁的熔点为306℃,沸点为315℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如图探究实验。
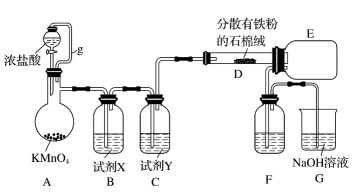
①写出A中的离子方程式___ 。
②装置B的作用是___ ;如果拆去装置B,可能的后果是___ 。
③为了提高FeCl3的产率,装置F中应该盛试剂___ (写名称)。
(2)利用上述装置制备的FeCl3作催化剂合成环己烯。反应原理如下:
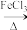 环己烯(粗品)
环己烯(粗品)
①浓硫酸也可作该反应的催化剂,选择FeCl3而不用浓硫酸的原因为___ (填序号)。
a.浓硫酸易使原料炭化并产生SO2
b.FeCl3污染小、可循环使用,符合绿色化学理念
c.同等条件下,用FeCl3比浓硫酸的平衡转化率高
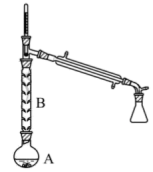
②合成环己烯的反应使用图的装置(加热和夹持装置已略去)。烧瓶A中进行的可逆反应化学方程式为___ ,仪器B的作用为___ 。
(1)已知三氯化铁的熔点为306℃,沸点为315℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如图探究实验。

①写出A中的离子方程式
②装置B的作用是
③为了提高FeCl3的产率,装置F中应该盛试剂
(2)利用上述装置制备的FeCl3作催化剂合成环己烯。反应原理如下:

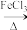 环己烯(粗品)
环己烯(粗品)①浓硫酸也可作该反应的催化剂,选择FeCl3而不用浓硫酸的原因为
a.浓硫酸易使原料炭化并产生SO2
b.FeCl3污染小、可循环使用,符合绿色化学理念
c.同等条件下,用FeCl3比浓硫酸的平衡转化率高
②合成环己烯的反应使用图的装置(加热和夹持装置已略去)。烧瓶A中进行的可逆反应化学方程式为

您最近一年使用:0次
名校
4 . 以下是应对新冠肺炎的一些认识和做法,不正确的是
| A.治疗新冠肺炎的药物如氯喹的合成与分离与化学知识息息相关 |
| B.生产N95口罩的主要原料是聚丙烯,聚丙烯不能使酸性高锰酸钾溶液褪色 |
| C.酒精能使蛋白质失去生理活性,喷洒75%的酒精溶液消毒时要注意防火 |
| D.公共场所用“84消毒液”和“洁厕灵”(主要成分为盐酸)的混合溶液杀菌消毒效果会更好 |
您最近一年使用:0次
2020-04-26更新
|
320次组卷
|
4卷引用:吉林省吉林市第一中学2021-2022学年高三下学期第一次月考理科综合化学试题
5 . 以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:
已知:①Cl2+2OH− ClO−+Cl−+H2O是放热反应。
ClO−+Cl−+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________ ;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________ 。
(2)步骤Ⅱ合成N2H4·H2O的装置如图−1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________ ;使用冷凝管的目的是_________________________________ 。

(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、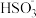 、
、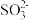 随pH的分布如图−2所示,Na2SO3的溶解度曲线如图−3所示)。
随pH的分布如图−2所示,Na2SO3的溶解度曲线如图−3所示)。
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________ 。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:_______________________ ,用少量无水乙醇洗涤,干燥,密封包装。

已知:①Cl2+2OH−
 ClO−+Cl−+H2O是放热反应。
ClO−+Cl−+H2O是放热反应。②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为
(2)步骤Ⅱ合成N2H4·H2O的装置如图−1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是

(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、
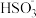 、
、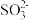 随pH的分布如图−2所示,Na2SO3的溶解度曲线如图−3所示)。
随pH的分布如图−2所示,Na2SO3的溶解度曲线如图−3所示)。
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:
您最近一年使用:0次
2018-06-10更新
|
6333次组卷
|
17卷引用:河南省许昌高级中学2020届高三上学期第一次月考化学试题
河南省许昌高级中学2020届高三上学期第一次月考化学试题河北省石家庄市行唐县三中2020届高三11月月考化学试题甘肃省武威第六中学2020届高三上学期第五次过关考试化学试题河南省洛阳市第一高级中学2021届高三上学期10月月考化学试题(已下线)【一飞冲天】名家原创卷1江苏省南通市通州区金沙中学2022-2023学年高一下学期6月质量监测化学试题2018年全国普通高等学校招生统一考试化学(江苏卷)【全国百强校】山西省临汾第一中学2017-2018学年高二下学期期末考试化学试题江西省南昌三中2019届高二下期末考试 化学(已下线)2018年高考题及模拟题汇编 专题15 工艺流程题四川省射洪县射洪中学2018-2019学年高二上学期开学考试化学试题【全国百强校】河南省实验中学2019届高三上学期质量预测模拟(三)化学试题江西省宜春市万载中学2019-2020学年高二上学期期中考试化学试题(衔接班)2020届高三化学选修4二轮专题练——酸碱中和滴定的曲线分析【精编25题】专题5.2 化学实验的设计与评价(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升天津市咸水沽第一中学2023届高三上学期第一次模拟考试化学试题天津西青区2022-2023学年高三上学期期末考试化学试题
6 . 亚硝酰氯(C1NO)是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验室用C12和NO制备C1NO并测定其纯度。请回答:
(I)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

(1)若制备C12发生装置选A,则反应的离子方程式为____________ 。若制备NO发生装置选B,锥形瓶中放的是Cu片,则分液漏斗中的试剂为________
(2)欲收集一瓶干燥纯净的氯气,选择装置,其连接顺序为:a→f→___ →___→___→d→___→___→___(按气流方向,用小写字母表示),其中F装置的作用为____________ 。

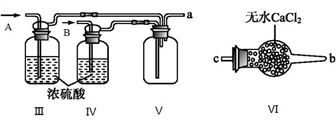
(II) 乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
(3)为了使气体充分反应,从A处进入的气体是____________ (填Cl2或NO)。
(4)装置Ⅲ、Ⅳ除可干燥NO、Cl2外,另一个作用是________________________ 。
(5)装置Ⅷ的烧杯中盛放的试剂是_____________ (填编号①水②热水③冰水)
(6)装置Ⅶ中吸收尾气时,NOCl发生反应的化学方程式为__________________ 。
(I)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

(1)若制备C12发生装置选A,则反应的离子方程式为
(2)欲收集一瓶干燥纯净的氯气,选择装置,其连接顺序为:a→f→


(II) 乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
(3)为了使气体充分反应,从A处进入的气体是
(4)装置Ⅲ、Ⅳ除可干燥NO、Cl2外,另一个作用是
(5)装置Ⅷ的烧杯中盛放的试剂是
(6)装置Ⅶ中吸收尾气时,NOCl发生反应的化学方程式为
您最近一年使用:0次
7 . N2H4·H2O(水合肼)极毒且不稳定,100℃以上易分解失水,常用作还原剂和除氧剂(通常生成N2和H2O),其熔点为-40℃,沸点118.5℃。现以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O和无水Na2SO3,其主要流程如下:
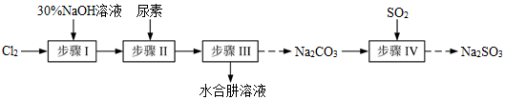
已知:Cl2(g)+2OH-(aq)=ClO-(aq)+Cl-(aq)+H2O(aq) △H<0
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒、烧杯外,还需要_____________ (填标号)。
A.容量瓶 B.胶头滴管 C.玻璃棒 D.锥形瓶
(2)步骤Ⅰ制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液充分反应生成NaClO3和NaCl。实验中为控制反应温度除了用冰水浴、充分搅拌外,还需采取的措施是_______________________ 。
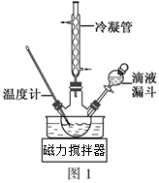
(3)步骤Ⅱ合成N2H4·H2O的装置如图1所示。NaClO碱性溶液与尿素水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________ (填字母);
a.尿素溶液 b.NaClO碱性溶液 c.尿素溶液或NaClO溶液任选其一
理由是____________________________________ 。
(4)步骤Ⅲ中分离出N2H4·H2O应该采用的方法最合理是____________________ 。
(5)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、HSO3-、SO32-随pH的分布如图2所示,Na2SO3的溶解度曲线如图3所示)。

①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的方法是______________ 。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:_____________________ ,用少量无水乙醇洗涤,干燥,密封包装。
(6)工业上还可以用水合肼还原法制取碘化钠,工艺流程如图:
还原过程中可用硫化钠或铁屑等物质替代水合肼,但水合肼还原法制得的产品纯度更高,原因是_______________________ 。

已知:Cl2(g)+2OH-(aq)=ClO-(aq)+Cl-(aq)+H2O(aq) △H<0
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒、烧杯外,还需要
A.容量瓶 B.胶头滴管 C.玻璃棒 D.锥形瓶
(2)步骤Ⅰ制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液充分反应生成NaClO3和NaCl。实验中为控制反应温度除了用冰水浴、充分搅拌外,还需采取的措施是
(3)步骤Ⅱ合成N2H4·H2O的装置如图1所示。NaClO碱性溶液与尿素水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。实验中通过滴液漏斗滴加的溶液是
a.尿素溶液 b.NaClO碱性溶液 c.尿素溶液或NaClO溶液任选其一
理由是

(4)步骤Ⅲ中分离出N2H4·H2O应该采用的方法最合理是
(5)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、HSO3-、SO32-随pH的分布如图2所示,Na2SO3的溶解度曲线如图3所示)。

①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的方法是
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:
(6)工业上还可以用水合肼还原法制取碘化钠,工艺流程如图:

还原过程中可用硫化钠或铁屑等物质替代水合肼,但水合肼还原法制得的产品纯度更高,原因是
您最近一年使用:0次
2018-10-28更新
|
720次组卷
|
5卷引用:浙江省温州市龙湾中学2019-2020学年高二下学期第1次居家月考化学试题
8 . 四氯化锡(SnCl4)是合成有机锡化合物的原料,其熔点为﹣33℃,沸点为114℃,在潮湿的空气中强烈水解产生有刺激性的白色烟雾,产物之一为SnO2。实验室制备四氯化锡的操作是:将金属锡熔融,然后泼入冷水,制成锡花,将干燥的锡花加入反应器中;再向反应器中缓慢地通入干燥的氯气。

(1)I.图1是实验室制备干燥氯气的实验装置(夹持装置已略)
(1)a的仪器名称_________________ 该装置制备氯气选用的药品为漂粉精固体[主要成分Ca(ClO)2]和浓盐酸,B中发生反应的化学方程式为________________________________________
(2)装置C中饱和食盐水的作用____________________________________ 同时装置C亦是安全瓶,能检测实验进行时D中是否发生堵塞,请写出发生堵塞时C中的现象_______________________________________
(3)试剂X可能为______________ (填写字母)
A.无水氯化钙 B.浓硫酸 C.碱石灰 D.五氧化二磷
(4)四氯化锡在潮湿空气中水解的化学方程式__________________________________
(5)用锡花代替锡粒的目的是__________________________________
(2)II.(6)图2是蒸馏SnCl4的装置
①蒸馏前若发现烧瓶中液体呈黄色,可采取的措施是________________________
②该装置尚有两处不当之处,它们分别是______________ ,___________________
③写出III中发生反应的离子方程式_______________________________________

(1)I.图1是实验室制备干燥氯气的实验装置(夹持装置已略)
(1)a的仪器名称
(2)装置C中饱和食盐水的作用
(3)试剂X可能为
A.无水氯化钙 B.浓硫酸 C.碱石灰 D.五氧化二磷
(4)四氯化锡在潮湿空气中水解的化学方程式
(5)用锡花代替锡粒的目的是
(2)II.(6)图2是蒸馏SnCl4的装置
①蒸馏前若发现烧瓶中液体呈黄色,可采取的措施是
②该装置尚有两处不当之处,它们分别是
③写出III中发生反应的离子方程式
您最近一年使用:0次



