名校
解题方法
1 . 三氯化硼 是一种无色气体,沸点为12.4℃、易水解生成
是一种无色气体,沸点为12.4℃、易水解生成 和HCl,在潮湿的环境中可腐蚀玻璃。在实验室中采用硼酸三甲酯
和HCl,在潮湿的环境中可腐蚀玻璃。在实验室中采用硼酸三甲酯 和Cl2制备BCl3,同时有CO气体生成,其装置如下:
和Cl2制备BCl3,同时有CO气体生成,其装置如下:
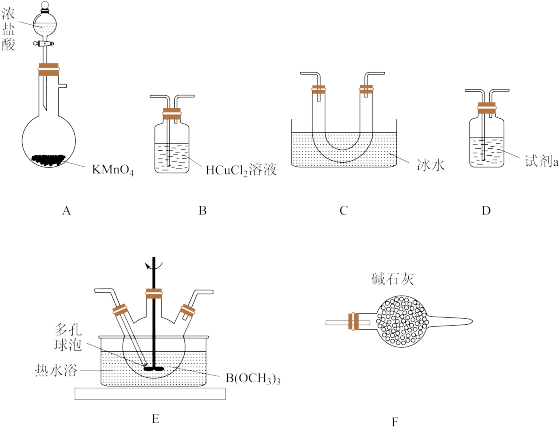
已知: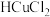 溶液可吸收CO。请回答下列问题:
溶液可吸收CO。请回答下列问题:
(1)装置A中盛放 固体的仪器名称为
固体的仪器名称为_______ ,试剂a的名称为_______ 。
(2)装置E中发生反应的化学方程式为_______ 。
(3)该实验中装置的连接顺序为_______ (填大写字母)。
(4)测定 产品中氯元素的含量。称取w g样品置于蒸馏水中完全水解,并配制成250mL溶液;取出25mL于锥形瓶中,向其中加入
产品中氯元素的含量。称取w g样品置于蒸馏水中完全水解,并配制成250mL溶液;取出25mL于锥形瓶中,向其中加入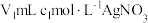 溶液使
溶液使 充分沉淀,再加入一定量硝基苯用力振荡、静置;然后再滴加少量
充分沉淀,再加入一定量硝基苯用力振荡、静置;然后再滴加少量 溶液,用
溶液,用 标准溶液滴定
标准溶液滴定 (发生反应为
(发生反应为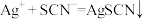 ),达到滴定终点时,消耗标准溶液
),达到滴定终点时,消耗标准溶液 。
。
①达到滴定终点的现象为_______ ,加入硝基苯的目的为_______ 。
②样品中Cl元素的质量分数为_______ (列出表达式即可),若实验操作正确,但所测样品中Cl元素的含量高于 中Cl元素含量,可能的原因为
中Cl元素含量,可能的原因为_______ 。
 是一种无色气体,沸点为12.4℃、易水解生成
是一种无色气体,沸点为12.4℃、易水解生成 和HCl,在潮湿的环境中可腐蚀玻璃。在实验室中采用硼酸三甲酯
和HCl,在潮湿的环境中可腐蚀玻璃。在实验室中采用硼酸三甲酯 和Cl2制备BCl3,同时有CO气体生成,其装置如下:
和Cl2制备BCl3,同时有CO气体生成,其装置如下:
已知:
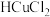 溶液可吸收CO。请回答下列问题:
溶液可吸收CO。请回答下列问题:(1)装置A中盛放
 固体的仪器名称为
固体的仪器名称为(2)装置E中发生反应的化学方程式为
(3)该实验中装置的连接顺序为
(4)测定
 产品中氯元素的含量。称取w g样品置于蒸馏水中完全水解,并配制成250mL溶液;取出25mL于锥形瓶中,向其中加入
产品中氯元素的含量。称取w g样品置于蒸馏水中完全水解,并配制成250mL溶液;取出25mL于锥形瓶中,向其中加入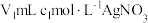 溶液使
溶液使 充分沉淀,再加入一定量硝基苯用力振荡、静置;然后再滴加少量
充分沉淀,再加入一定量硝基苯用力振荡、静置;然后再滴加少量 溶液,用
溶液,用 标准溶液滴定
标准溶液滴定 (发生反应为
(发生反应为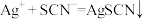 ),达到滴定终点时,消耗标准溶液
),达到滴定终点时,消耗标准溶液 。
。①达到滴定终点的现象为
②样品中Cl元素的质量分数为
 中Cl元素含量,可能的原因为
中Cl元素含量,可能的原因为
您最近一年使用:0次
2022-09-03更新
|
494次组卷
|
4卷引用:河南省名校联盟2022-2023学年高三上学期9月联考化学试题
名校
解题方法
2 . 工业上用 和碱制漂白粉、漂粉精及漂白液。请回答下列问题:
和碱制漂白粉、漂粉精及漂白液。请回答下列问题:
(1) Ca(ClO)2中Cl元素的化合价是___________ ;工业上将氯气制成漂白粉的主要目的是___________ 。工业上制成漂白粉的化学方程式:___________ 。
(2)下列物质露置在空气中会变质,在变质过程中既有非氧化还原反应发生,又有氧化还原反应发生的是___________(填字母)。
(3)浸泡衣物时加入漂粉精(有效成分Ca(ClO)2)在空气中放置一段时间漂白效果更好,请用化学方程式解释原因:___________ 。
(4)若将漂白液(有效成分NaClO)与洁厕灵(主要成分是盐酸)混合使用,则会产生有毒气体,其反应的离子方程式是___________ 。
(5)有效氯是漂白粉中有效成分Ca(ClO)2含量大小的标志。
已知:①Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;
②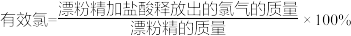 。
。
若某漂粉精的有效氯为60%,该漂粉精中Ca(ClO)2的质量分数为___________ (计算结果保留一位小数)。
 和碱制漂白粉、漂粉精及漂白液。请回答下列问题:
和碱制漂白粉、漂粉精及漂白液。请回答下列问题:(1) Ca(ClO)2中Cl元素的化合价是
(2)下列物质露置在空气中会变质,在变质过程中既有非氧化还原反应发生,又有氧化还原反应发生的是___________(填字母)。
| A.生石灰 | B.漂白粉 |
| C.NaOH | D. |
(4)若将漂白液(有效成分NaClO)与洁厕灵(主要成分是盐酸)混合使用,则会产生有毒气体,其反应的离子方程式是
(5)有效氯是漂白粉中有效成分Ca(ClO)2含量大小的标志。
已知:①Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;
②
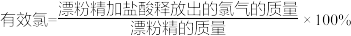 。
。若某漂粉精的有效氯为60%,该漂粉精中Ca(ClO)2的质量分数为
您最近一年使用:0次
3 . 无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备。流程如图所示:

已知:AlCl3、FeCl3分别在183℃、315℃时升华;FeCl2的熔点为672℃。
(1)AlCl3属于______ (选填“强”、“弱”)电解质,它的晶体类型为______ 。
(2)写出氯化炉中Al2O3、Cl2和焦炭在高温下发生反应的化学方程式______ ,制取1molAlCl3,至少要消耗碳______ mol。
(3)向升华器中加入Al粉,其作用是______ 。
(4)700℃时,升华器中物质经充分反应后需降温实现FeCl3和AlCl3的分离。请选择合适的温度范围______ 。
a.低于183℃ b.介于183℃和315℃之间 c.高于315℃
(5)称取AlCl3样品(含少量FeCl3)m克,用重量法方案测定AlCl3含量,流程如图:
m克样品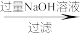
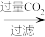
 n克固体
n克固体
氯化铝的质量分数为______ 。

已知:AlCl3、FeCl3分别在183℃、315℃时升华;FeCl2的熔点为672℃。
(1)AlCl3属于
(2)写出氯化炉中Al2O3、Cl2和焦炭在高温下发生反应的化学方程式
(3)向升华器中加入Al粉,其作用是
(4)700℃时,升华器中物质经充分反应后需降温实现FeCl3和AlCl3的分离。请选择合适的温度范围
a.低于183℃ b.介于183℃和315℃之间 c.高于315℃
(5)称取AlCl3样品(含少量FeCl3)m克,用重量法方案测定AlCl3含量,流程如图:
m克样品
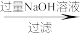
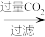
 n克固体
n克固体氯化铝的质量分数为
您最近一年使用:0次
名校
解题方法
4 . 疫情期间,公共场所需要经常进行消毒,75%的医用酒精和84消毒液都能有效消灭病毒。某化学兴趣小组探究84消毒液(有效成分为NaClO)与75%医用酒精能否反应,进行如图实验:

(1)实验室制备84消毒液的化学方程式为_______ 。
(2)将25mL无水乙醇配成75%医用酒精,所给仪器中不需要使用的有_______(填序号)。
(3)实验结果:实验Ⅰ的淀粉碘化钾试纸在3 min时变蓝,实验Ⅱ的淀粉碘化钾试纸在8 min时变蓝。
①实验Ⅰ中,使湿润的淀粉碘化钾试纸变蓝的物质是_______ (写化学式)。
②实验II中,湿润的淀粉碘化钾试纸也变蓝的原因可能是_______ 。
③通过对比实验Ⅰ和Ⅱ的现象,可以说明84消毒液与75%医用酒精能够反应,理由是_______ 。
(4)为了测定84消毒液与医用酒精1:1反应后溶液中残留的NaClO的含量(假设反应生成的气体已全部逸出),小组进行了如下实验:取7.45 mL反应后溶液(密度约1 g·mL-1)于锥形瓶,加入过量KI溶液和适量硫酸,在冷暗处静置4-5min后,再加入少量淀粉指示剂,用0.1000 mol·L-1 Na2S2O3标准液滴定,消耗标准液体积为24.00 mL。(已知:I2+2S2O =2I-+S4O
=2I-+S4O )
)
①NaClO与KI反应的离子方程式为_______ 。
②判断滴定终点的方法是_______ ,上述实验中84消毒液与医用酒精1:1反应后溶液中残留的NaClO的质量分数为_______ (计算结果保留两位有效数字)。

(1)实验室制备84消毒液的化学方程式为
(2)将25mL无水乙醇配成75%医用酒精,所给仪器中不需要使用的有_______(填序号)。
A. | B. | C. | D. |
①实验Ⅰ中,使湿润的淀粉碘化钾试纸变蓝的物质是
②实验II中,湿润的淀粉碘化钾试纸也变蓝的原因可能是
③通过对比实验Ⅰ和Ⅱ的现象,可以说明84消毒液与75%医用酒精能够反应,理由是
(4)为了测定84消毒液与医用酒精1:1反应后溶液中残留的NaClO的含量(假设反应生成的气体已全部逸出),小组进行了如下实验:取7.45 mL反应后溶液(密度约1 g·mL-1)于锥形瓶,加入过量KI溶液和适量硫酸,在冷暗处静置4-5min后,再加入少量淀粉指示剂,用0.1000 mol·L-1 Na2S2O3标准液滴定,消耗标准液体积为24.00 mL。(已知:I2+2S2O
 =2I-+S4O
=2I-+S4O )
)①NaClO与KI反应的离子方程式为
②判断滴定终点的方法是
您最近一年使用:0次
2021-09-01更新
|
493次组卷
|
7卷引用:广东省深圳市六校2022届高三第一次联考化学试题
5 . 某校化学兴趣小组为研究氯气的性质并模拟工业制备漂白粉,设计了下列装置进行实验。
已知:①A中反应为KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;
②石灰乳的主要成分为Ca(OH)2,其他杂质不参与反应。
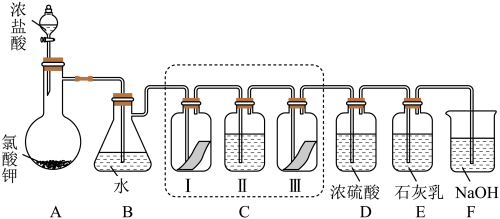
(1)写出B装置中反应的离子方程式_______ 。实验结束后,立即将B中溶液滴几滴在紫色石蕊试纸上,可观察到的现象是_______ 。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III 处依次放入的物质正确的是_______ (填编号)。
(3)F 装置的作用是(用离子方程式表示)_______
(4)为测定E中所得漂白粉的有效成分含量。称取 a g 漂白粉样品溶解,往所得溶液中通入 CO2至不再产生沉淀为止,若反应生成沉淀的物质的量为 b mol,则该漂白粉中有效成分的质量分数为_______ (用含 a、b 的式子表示)。
已知:①A中反应为KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;
②石灰乳的主要成分为Ca(OH)2,其他杂质不参与反应。

(1)写出B装置中反应的离子方程式
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III 处依次放入的物质正确的是
编号 | I | II | III |
A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
B | 干燥的有色布条 | 浓硫酸 | 湿润的有色布条 |
C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
D | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
(4)为测定E中所得漂白粉的有效成分含量。称取 a g 漂白粉样品溶解,往所得溶液中通入 CO2至不再产生沉淀为止,若反应生成沉淀的物质的量为 b mol,则该漂白粉中有效成分的质量分数为
您最近一年使用:0次
名校
6 . 氯化氨基汞[Hg(NH2)Cl]是祛斑霜中常用的添加剂,可由反应:Hg+2NH3+Cl2=Hg(NH2)Cl↓+NH4Cl制备,某学习小组在实验室中利用下列装置制备氯化氨基汞,回答下列问题。

(1)A中发生反应的离子方程式为____________________________________________ 。
(2)F中发生反应的化学方程式为______________________________________________ 。
(3)盛装碱石灰的仪器作用为____________________________ 。
(4)整个装置的仪器连接顺序为A→___________________________ (装置不能重复使用)。该实验的不足之处是________________________________________________________ 。
(5)E中短导管a通入的气体是______________ 。
(6)氯化氨基汞产品中氯化氨基汞的含量测定:称取ag样品,加入水及稀硫酸溶解向溶解后的溶液中加入0.1mol/L KI溶液,立即出现橙红色沉淀,继续滴加KI溶液至沉淀消失,溶液呈无色[已知Hg2++2I-=HgI2↓(橙红色),HgI2+2I-= (无色)],共消耗V mL KI溶液。测定产品中氯化氨基汞的质量分数为
(无色)],共消耗V mL KI溶液。测定产品中氯化氨基汞的质量分数为______________________ 。

(1)A中发生反应的离子方程式为
(2)F中发生反应的化学方程式为
(3)盛装碱石灰的仪器作用为
(4)整个装置的仪器连接顺序为A→
(5)E中短导管a通入的气体是
(6)氯化氨基汞产品中氯化氨基汞的含量测定:称取ag样品,加入水及稀硫酸溶解向溶解后的溶液中加入0.1mol/L KI溶液,立即出现橙红色沉淀,继续滴加KI溶液至沉淀消失,溶液呈无色[已知Hg2++2I-=HgI2↓(橙红色),HgI2+2I-=
 (无色)],共消耗V mL KI溶液。测定产品中氯化氨基汞的质量分数为
(无色)],共消耗V mL KI溶液。测定产品中氯化氨基汞的质量分数为
您最近一年使用:0次
名校
7 . 某校化学兴趣小组为研究氯气的性质并模拟工业制备漂白粉,设计了下列装置进行实验。已知:
①A中反应为KClO3+6HCl(浓) = KCl+3Cl2↑+3H2O;
②石灰乳的主要成分为Ca(OH)2,其他杂质不参与反应。

(1)A反应中氧化产物和还原产物的质量比为________ 。
(2)写出B装置中反应的离子方程式_________ 。实验结束后,立即将B中溶液滴几滴在蓝色石蕊试纸上,可观察到的现象是________ 。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III 处依次放入的物质正确的是___________ (填编号)。
(4)待E中物质完全反应后,经过一系列加工处理,得到漂白粉样品,其有效成分为___________ (填化学式)。
(5)F装置的作用是____________ (用离子方程式表示)。
(6)为测定(4)中所得漂白粉的有效成分含量。称取ag漂白粉样品溶解,往所得溶液中通入CO2至不再产生沉淀为止,若反应生成沉淀的物质的量为bmol,则该漂白粉中有效成分的质量分数为___________ (用含 a、b的式子表示)。
①A中反应为KClO3+6HCl(浓) = KCl+3Cl2↑+3H2O;
②石灰乳的主要成分为Ca(OH)2,其他杂质不参与反应。

(1)A反应中氧化产物和还原产物的质量比为
(2)写出B装置中反应的离子方程式
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III 处依次放入的物质正确的是
| 编号 | I | II | III |
| A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| B | 干燥的有色布条 | 浓硫酸 | 湿润的有色布条 |
| C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| D | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
(5)F装置的作用是
(6)为测定(4)中所得漂白粉的有效成分含量。称取ag漂白粉样品溶解,往所得溶液中通入CO2至不再产生沉淀为止,若反应生成沉淀的物质的量为bmol,则该漂白粉中有效成分的质量分数为
您最近一年使用:0次
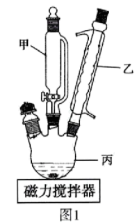
8 . 实验室通常以次氯酸钠、氢氧化锂和叔丁醇等为原料制备次氯酸锂。相关实验步骤如下:①在10 ℃以下的条件下,取一定体积的叔丁醇[(CH3)3COH]与质量分数为10%的NaClO水溶液混合于如图1装置的仪器丙中,通过仪器甲逐滴加入一定体积的12 mol·L -1盐酸,同时进行搅拌:
②避光、保持温度10 ℃ 以下搅拌3分钟,进行操作I ,得到黄色油状液体次氯酸叔丁酯[(CH3)3COCl]和溶液I.
③用饱和Na2CO3溶液洗涤黄色油状液体,然后分液,再加入无水CaCl2干燥有机相,得到无水次氯酸叔丁酯:
④在步骤③所得的无水次氯酸叔丁酯中加入一定量的LiOH和适量蒸馏水,充分反应5分钟,进行操作II,得到叔丁醇[ (CH3)3COH] 和次氯酸锂溶液:
⑤将所得次氯酸锂溶液在40 ℃下缓慢蒸发,得到次氯酸锂晶体。
已知:
i.次氯酸叔丁酯[ (CH3)3COCl]的相对分子质量为108. 5,具有强挥发性及强烈刺激性气味,悬难溶于水的油状液体,密度为0.96g.·mL-1。
ii.将Cl2通入NaOH稀溶液中有NnClO生成,该反应为放热反应;若NaOH溶液浓度较大或反应体系温度稍高,则会有NaClO3生成。
请回答:
(1)实验室通常采用氯气与NaOH稀溶液反应获得次氯酸钠。实验装置如图2所示。


制取氯气时,在图2装置①的烧瓶中加入一定量的MnO2,通过分液漏斗向烧瓶中加入适量的浓盐酸。装置①中导管a的作用是__________________________ 。请在图3装置A、B、C中选择一个合适的装置放在图2②处:________________________ 。有人认为上述装置存在缺点,他们指出在图2①、②装置之间应增加如图3 D所示的装置,你认为D中所盛液体及其作用____________________________________________________________ 。
(2)图1装置中仪器乙的名称是______________________________ ; 浓盐酸逐滴加入的目的为______________________________________ 。
(3)写出步骤④中所发生反应的化学方程式_____________________________ 。
(4)步骤⑤需控制温度在40 ℃ ,所采用的操作方法为__________________________ ; 该操作力法的优点有_______________________________ (写两点即可)。
(5)操作I需用到分液漏斗,下列有关分液漏斗的使用方法表述合理的是____________ (填字母)。
a.分液漏斗使用前必须检漏,旋塞处和上口塞子处均不漏水才可使用
b.分液漏斗内的液体经振摇后,静置正放,分层后,在下口先后放出下层液体和上层液体
c.萃取时振荡分液漏斗后需要进行放气操作,放气时,漏斗略倒置,慢慢打开旋塞
d.萃取和分液操作所用的漏斗必须是梨形分液漏斗,不能用球形分液漏斗
(6)实验所得次氯酸锂产品中一般会含有Cl-,而残留的Cl-可通过色谱法进行测定。如图4是经换算后得到的吸光度(A)与产品溶液中Cl-浓度的关系:
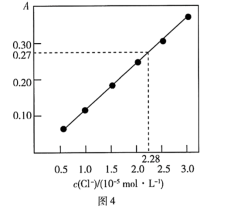
准确称取1.0000 g次氯酸锂产品,用蒸馏水溶解并定容至100 mL,准确移取该溶液10. 00 mL,测得产品溶液的吸光度A=0.27 ,则产品中残留Cl-的含量为_________________ (以质量分数表示)。

②避光、保持温度10 ℃ 以下搅拌3分钟,进行操作I ,得到黄色油状液体次氯酸叔丁酯[(CH3)3COCl]和溶液I.
③用饱和Na2CO3溶液洗涤黄色油状液体,然后分液,再加入无水CaCl2干燥有机相,得到无水次氯酸叔丁酯:
④在步骤③所得的无水次氯酸叔丁酯中加入一定量的LiOH和适量蒸馏水,充分反应5分钟,进行操作II,得到叔丁醇[ (CH3)3COH] 和次氯酸锂溶液:
⑤将所得次氯酸锂溶液在40 ℃下缓慢蒸发,得到次氯酸锂晶体。
已知:
i.次氯酸叔丁酯[ (CH3)3COCl]的相对分子质量为108. 5,具有强挥发性及强烈刺激性气味,悬难溶于水的油状液体,密度为0.96g.·mL-1。
ii.将Cl2通入NaOH稀溶液中有NnClO生成,该反应为放热反应;若NaOH溶液浓度较大或反应体系温度稍高,则会有NaClO3生成。
请回答:
(1)实验室通常采用氯气与NaOH稀溶液反应获得次氯酸钠。实验装置如图2所示。


制取氯气时,在图2装置①的烧瓶中加入一定量的MnO2,通过分液漏斗向烧瓶中加入适量的浓盐酸。装置①中导管a的作用是
(2)图1装置中仪器乙的名称是
(3)写出步骤④中所发生反应的化学方程式
(4)步骤⑤需控制温度在40 ℃ ,所采用的操作方法为
(5)操作I需用到分液漏斗,下列有关分液漏斗的使用方法表述合理的是
a.分液漏斗使用前必须检漏,旋塞处和上口塞子处均不漏水才可使用
b.分液漏斗内的液体经振摇后,静置正放,分层后,在下口先后放出下层液体和上层液体
c.萃取时振荡分液漏斗后需要进行放气操作,放气时,漏斗略倒置,慢慢打开旋塞
d.萃取和分液操作所用的漏斗必须是梨形分液漏斗,不能用球形分液漏斗
(6)实验所得次氯酸锂产品中一般会含有Cl-,而残留的Cl-可通过色谱法进行测定。如图4是经换算后得到的吸光度(A)与产品溶液中Cl-浓度的关系:

准确称取1.0000 g次氯酸锂产品,用蒸馏水溶解并定容至100 mL,准确移取该溶液10. 00 mL,测得产品溶液的吸光度A=0.27 ,则产品中残留Cl-的含量为
您最近一年使用:0次
9 . 现有NH3、Cl2、Fe3O4、S、Na2O、Na2O2、SO2、NO2八种中学常见物质。请回答下列问题:
Ⅰ.(1)上述物质中通常为淡黄色固体的化合物,其电子式为____________ 。
(2)上述物质中,水溶液呈碱性的气体可与新制水溶液具有强氧化性的气体反应,写出其反应的化学方程式:____________ 。
Ⅱ.纳米Fe3O4由于具有高的比表面、高的比饱和磁化强度和剩磁为零的超顺磁性而被广泛地用作磁流体的磁性粒子。水热法制备Fe3O4纳米颗粒的反应为3Fe2++2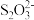 +O2+xOH-=Fe3O4+
+O2+xOH-=Fe3O4+ +2H2O。工业上也常用该反应制备打印机墨粉。
+2H2O。工业上也常用该反应制备打印机墨粉。
(1)水热法所制得的水基磁流体30天以上无分层和浑浊现象,因为该分散系是____________ 。
(2)上述反应方程式中x=____________ 。
(3)墨粉中Fe3O4的含量是衡量墨粉质量优劣的重要指标之一,某化学兴趣小组设计如下方案,已知:I2+2Na2S2O3=Na2S4O6+2NaI。
取mg墨粉 Fe2+、Fe3+滤液
Fe2+、Fe3+滤液 Fe3+溶液
Fe3+溶液 含I2的溶液
含I2的溶液 计算含量
计算含量
试问:①试剂1最好选择____________ ,如何判断恰好反应完全____________ 。
②该墨粉中Fe3O4的质量分数为____________ 。
Ⅰ.(1)上述物质中通常为淡黄色固体的化合物,其电子式为
(2)上述物质中,水溶液呈碱性的气体可与新制水溶液具有强氧化性的气体反应,写出其反应的化学方程式:
Ⅱ.纳米Fe3O4由于具有高的比表面、高的比饱和磁化强度和剩磁为零的超顺磁性而被广泛地用作磁流体的磁性粒子。水热法制备Fe3O4纳米颗粒的反应为3Fe2++2
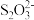 +O2+xOH-=Fe3O4+
+O2+xOH-=Fe3O4+ +2H2O。工业上也常用该反应制备打印机墨粉。
+2H2O。工业上也常用该反应制备打印机墨粉。(1)水热法所制得的水基磁流体30天以上无分层和浑浊现象,因为该分散系是
(2)上述反应方程式中x=
(3)墨粉中Fe3O4的含量是衡量墨粉质量优劣的重要指标之一,某化学兴趣小组设计如下方案,已知:I2+2Na2S2O3=Na2S4O6+2NaI。
取mg墨粉
 Fe2+、Fe3+滤液
Fe2+、Fe3+滤液 Fe3+溶液
Fe3+溶液 含I2的溶液
含I2的溶液 计算含量
计算含量试问:①试剂1最好选择
②该墨粉中Fe3O4的质量分数为
您最近一年使用:0次
10 . 某校化学兴趣小组为研究氯气的性质并模拟工业制备漂白粉,设计了下列装置进行实验。已知:①A中反应为 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;
②石灰乳的主要成分为Ca(OH)2,其他杂质不参与反应。
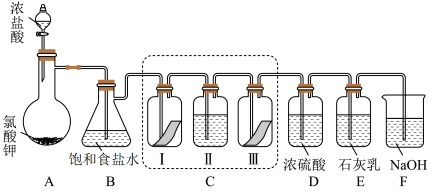
(1)B装置作用____ 。实验结束后,立即将 B 中溶液滴几滴在紫色石蕊试纸上,可观察到的现象是_____ 。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III 处依次放入的物质正确的是___ (填编号)。
(3)待E中物质完全反应后,经过一系列加工处理,得到漂白粉样品,其主要成分为___ (填化学式)
(4)F装置的作用是(用化学方程式表示)____ 。
(5)为测定(3)中所得漂白粉的有效成分含量。称取ag漂白粉样品溶解,往所得溶液中通入 CO2至产生沉淀最大值时,该过程的化学方程式为_____ ,若反应生成沉淀的物质的量为bmol,则该漂白粉中有效成分的质量分数为_____ (用含a、b的式子表示)。
②石灰乳的主要成分为Ca(OH)2,其他杂质不参与反应。

(1)B装置作用
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III 处依次放入的物质正确的是
| 编号 | I | II | III |
| A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| B | 干燥的有色布条 | 浓硫酸 | 湿润的有色布条 |
| C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| D | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
(4)F装置的作用是(用化学方程式表示)
(5)为测定(3)中所得漂白粉的有效成分含量。称取ag漂白粉样品溶解,往所得溶液中通入 CO2至产生沉淀最大值时,该过程的化学方程式为
您最近一年使用:0次
2019-10-15更新
|
481次组卷
|
3卷引用:福建省龙岩市连城县第一中学2019-2020学年高一上学期第一次月考化学试题



