名校
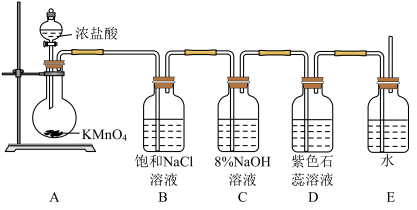
1 . 寒冬袭来,病毒肆虐,含氯消毒剂在控制病原微生物污染和传播等方面有着重要作用。某校课外化学小组设计如图所示装置制备少量氯气并进行系列实验(夹持仪器已略)。
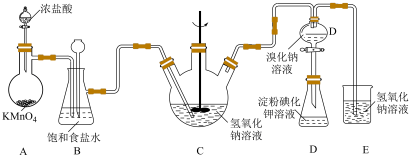
已知淀粉溶液遇碘单质变蓝;卤素单质在水中的颜色如表所示:
(1)请写出实验室用 与浓盐酸制氯气的化学方程式
与浓盐酸制氯气的化学方程式___________ ;
(2)装置B的作用是___________ ;
(3)装置C中生成各物质的物质的量和溶液的温度随时间的变化如下图所示。写出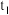 分钟后氧化产物只有
分钟后氧化产物只有 的反应,对应的化学方程式
的反应,对应的化学方程式___________ ;
(4)设计装置D、E的目的是验证氧化性 。当向D中缓缓通入一定量氯气时,可以看到D中无色溶液逐渐变为
。当向D中缓缓通入一定量氯气时,可以看到D中无色溶液逐渐变为___________ 色,若打开装置D的活塞,使D中溶液滴入装置E,可以观察到的现象是___________ ,经认真考虑,有同学提出该实验方案仍有不足,你若同意该建议,请说明其中不足的原因是___________ ;(若不同意,则该空不用写)
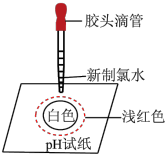
(5)某同学在pH试纸上滴几滴新制的氯水,现象如图所示,下列有关该实验的说法中正确的是___________。

已知淀粉溶液遇碘单质变蓝;卤素单质在水中的颜色如表所示:
| 卤素单质 |  |  |  |
| 水溶液颜色 | 黄绿色 | 橙黄色 | 棕黄色 |
(1)请写出实验室用
 与浓盐酸制氯气的化学方程式
与浓盐酸制氯气的化学方程式(2)装置B的作用是
(3)装置C中生成各物质的物质的量和溶液的温度随时间的变化如下图所示。写出
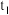 分钟后氧化产物只有
分钟后氧化产物只有 的反应,对应的化学方程式
的反应,对应的化学方程式
(4)设计装置D、E的目的是验证氧化性
 。当向D中缓缓通入一定量氯气时,可以看到D中无色溶液逐渐变为
。当向D中缓缓通入一定量氯气时,可以看到D中无色溶液逐渐变为(5)某同学在pH试纸上滴几滴新制的氯水,现象如图所示,下列有关该实验的说法中正确的是___________。

A.该实验说明 分子具有漂白性 分子具有漂白性 |
B.该实验说明 扩散速率比HClO分子快 扩散速率比HClO分子快 |
| C.将实验后变白的pH试纸再滴入盐酸又会变红 |
| D.若用久置的氯水进行实验,现象相同 |
您最近一年使用:0次
2024-01-25更新
|
85次组卷
|
2卷引用:四川省绵阳市绵阳中学2023-2024学年高一上学期期末模拟测试化学试题
名校
2 . 氯及其化合物在工业生产和人类生活中应用广泛。
(1)实验室利用将氯气通入碱液制备NaClO和 ,装置如图所示:
,装置如图所示:
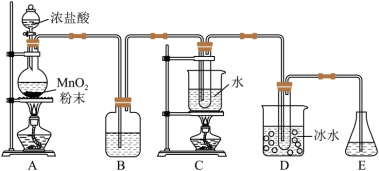
①盛放浓盐酸的仪器名称是______ ,A中发生反应的化学方程式为______ 。
②B的作用是______ 。
③用8.7 g 与足量浓盐酸充分反应,生成
与足量浓盐酸充分反应,生成 的质量为
的质量为______ 。
(2)C中试管内盛放的试剂为______ ,其发生反应反应的离子方程式为:______ 。
(3)实验室可以将氯气通入冷而稀的氢氧化钠溶液获得“84消毒液”,
①制备“84消毒液”的离子方程式______ 。
②空气中喷洒“84消毒液”可以达到对环境消毒的目的,其消毒原理为______ (请结合方程式和文字说明)。
③“84消毒液”与洁厕灵(主要成分为盐酸)混用,会产生黄绿色有毒气体。反应离子方程式为______ 。
④将“84消毒液”与 同时用于织物漂白,效果不佳,原因
同时用于织物漂白,效果不佳,原因______ (用离子方程式表示)。
(4)某同学设计实验探究84消毒液的漂白性。
I.在2 mL 84消毒液中加入2 mL水后,放入红色纸片,观察到纸片慢慢褪色。
II.在2 mL 84消毒液中加入2 mL白醋后,放入红色纸片,观察到纸片迅速褪色。
III.在不同温度时,测得84消毒液ORP值随时间的变化曲线如图所示。
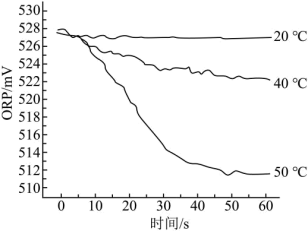
已知:ORP表示水溶液中物质的氧化性或还原性强弱。ORP值越大,氧化性越强。
①实验I、II现象不同的原因是为______ 。
②实验III中,随时间的变化ORP值不同的原因可能是______ 。
③针对不同物品的消毒,需将84消毒液稀释到不同的浓度。已知某品牌84消毒液中次氯酸钠的质量分数为12.6%,若取该消毒液100 g,加水稀释为8%的溶液,则需加水的质量为______ g。
(1)实验室利用将氯气通入碱液制备NaClO和
 ,装置如图所示:
,装置如图所示:
①盛放浓盐酸的仪器名称是
②B的作用是
③用8.7 g
 与足量浓盐酸充分反应,生成
与足量浓盐酸充分反应,生成 的质量为
的质量为(2)C中试管内盛放的试剂为
(3)实验室可以将氯气通入冷而稀的氢氧化钠溶液获得“84消毒液”,
①制备“84消毒液”的离子方程式
②空气中喷洒“84消毒液”可以达到对环境消毒的目的,其消毒原理为
③“84消毒液”与洁厕灵(主要成分为盐酸)混用,会产生黄绿色有毒气体。反应离子方程式为
④将“84消毒液”与
 同时用于织物漂白,效果不佳,原因
同时用于织物漂白,效果不佳,原因(4)某同学设计实验探究84消毒液的漂白性。
I.在2 mL 84消毒液中加入2 mL水后,放入红色纸片,观察到纸片慢慢褪色。
II.在2 mL 84消毒液中加入2 mL白醋后,放入红色纸片,观察到纸片迅速褪色。
III.在不同温度时,测得84消毒液ORP值随时间的变化曲线如图所示。

已知:ORP表示水溶液中物质的氧化性或还原性强弱。ORP值越大,氧化性越强。
①实验I、II现象不同的原因是为
②实验III中,随时间的变化ORP值不同的原因可能是
③针对不同物品的消毒,需将84消毒液稀释到不同的浓度。已知某品牌84消毒液中次氯酸钠的质量分数为12.6%,若取该消毒液100 g,加水稀释为8%的溶液,则需加水的质量为
您最近一年使用:0次
3 . 化学小组同学为研究氯气制备和氯水的成分及性质进行了如下实验。
【实验1】制备氯气。下图是实验室制取纯净、干燥氯气装置图。
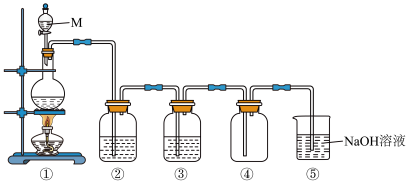
(1)M仪器的名称是___________ ,①中反应的反应的化学方程式是___________ 。
(2)③中存放的试剂是___________ 。
(3)⑤中反应的离子方程式是___________ 。
【实验2】研究氯水性质。实验操作及现象如下表。
资料:淀粉的特征反应——遇 变蓝色
变蓝色
(4)实验2-1可证明氧化性
___________  (填“>”或“<”);实验2-2中使溶液褪色的粒子是
(填“>”或“<”);实验2-2中使溶液褪色的粒子是___________ 。
(5)证明氯水中含有氯离子的方案是___________ 。
(6)同学们发现久置的氯水会失去漂白性,溶液由黄绿色变为无色。为探究氯水失效的原因,进行实验:用强光照射盛有氯水的密闭广口瓶,并用传感器测定广口瓶中数据,得到如下曲线。
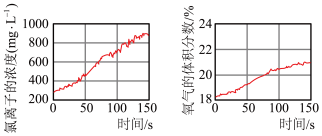
上两图中曲线变化的原因是___________ 。
【实验1】制备氯气。下图是实验室制取纯净、干燥氯气装置图。

(1)M仪器的名称是
(2)③中存放的试剂是
(3)⑤中反应的离子方程式是
【实验2】研究氯水性质。实验操作及现象如下表。
资料:淀粉的特征反应——遇
 变蓝色
变蓝色| 实验2-1 | 实验2-2 | |
| 实验操作(氯水均为新制) | 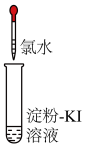 | 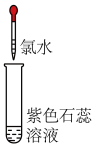 |
| 实验现象 | 溶液变蓝 | 石蕊溶液先变红,后褪色 |

 (填“>”或“<”);实验2-2中使溶液褪色的粒子是
(填“>”或“<”);实验2-2中使溶液褪色的粒子是(5)证明氯水中含有氯离子的方案是
(6)同学们发现久置的氯水会失去漂白性,溶液由黄绿色变为无色。为探究氯水失效的原因,进行实验:用强光照射盛有氯水的密闭广口瓶,并用传感器测定广口瓶中数据,得到如下曲线。

上两图中曲线变化的原因是
您最近一年使用:0次
解题方法
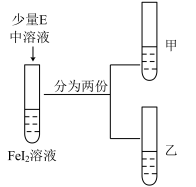
4 . 某研究小组利用下图装置制备“84”消毒液并探究 的化学性质。已知:
的化学性质。已知: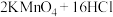 (浓)
(浓)
回答下列问题:
(1)盛装 的仪器名称是
的仪器名称是_______ ,本实验制备 的反应中,氧化剂与还原剂的物质的量之比为
的反应中,氧化剂与还原剂的物质的量之比为_______ 。
(2)若将B与C装置的位置对调,对“84”消毒液有效成分产量的影响是______ (填“提高”“降低”或“无影响”),向制得的“84”消毒液中加入较多硫酸时会产生氯气,发生反应的离子方程式为______ 。
(3)D中可观察到的现象是_______ ,说明溶液中存在的微粒有_______ 。
(4)从环保角度考虑,对本实验装置的改进措施是_______ 。
(5)已知,还原性: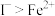 。按如下方案对其进行了证明,完成表格有关内容。
。按如下方案对其进行了证明,完成表格有关内容。
 的化学性质。已知:
的化学性质。已知: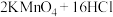 (浓)
(浓)

回答下列问题:
(1)盛装
 的仪器名称是
的仪器名称是 的反应中,氧化剂与还原剂的物质的量之比为
的反应中,氧化剂与还原剂的物质的量之比为(2)若将B与C装置的位置对调,对“84”消毒液有效成分产量的影响是
(3)D中可观察到的现象是
(4)从环保角度考虑,对本实验装置的改进措施是
(5)已知,还原性:
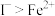 。按如下方案对其进行了证明,完成表格有关内容。
。按如下方案对其进行了证明,完成表格有关内容。
| 实验步骤 | 现象 |
| ①向甲试管中滴加淀粉溶液 | |
| ②向乙试管中滴加 |
您最近一年使用:0次
2023-02-18更新
|
180次组卷
|
2卷引用:四川省绵阳市2022-2023学年高一上学期期末考试化学试题
名校
5 . 下列操作正确且能达到实验目的是
| 选项 | 实验操作 | 实验目的 |
| A | 将混合气体通过饱和的碳酸钠的洗气瓶 | 除去CO2中的HCl |
| B | 向25mL的沸水中逐滴滴加5~6滴饱和FeCl3溶液,继续加热至产生红褐色沉淀 | 制备Fe(OH)3胶体 |
| C | 将混合气体通过盛有碱石灰的干燥管 | 除去Cl2中的水蒸气 |
| D | 用棉花包裹Na2O2,放入充满CO2的集气瓶中 | 证明Na2O2与CO2反应是放热反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-01-25更新
|
178次组卷
|
3卷引用:四川省南充市2020-2021学年高一上学期期末考试化学试题
6 . 在实验室里可用如图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
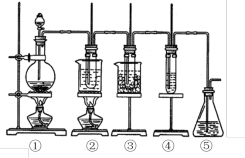
图中①为氯气发生装置;②的试管里盛有15mL 30%KOH溶液,并置于水浴中;③的试管里盛有15mL 8%NaOH溶液,并置于冰水浴中;④的试管里加有几滴紫色石蕊试液;⑤为尾气吸收装置。
(1)制取氯气时,在______ (填仪器名称)里加入一定量的二氧化锰,通过分液漏斗向其中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有________ 的洗气瓶。
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,两者的差别是_____ 。
(3)①中制取氯气的化学方程式为________ ;③中制取次氯酸钠的离子方程式为_____ 。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白。
(5)⑤为尾气处理装置,可选用的试剂_____________ 。
A.饱和食盐水 B. Na2S C.高锰酸钾 D. Ca(OH)2

图中①为氯气发生装置;②的试管里盛有15mL 30%KOH溶液,并置于水浴中;③的试管里盛有15mL 8%NaOH溶液,并置于冰水浴中;④的试管里加有几滴紫色石蕊试液;⑤为尾气吸收装置。
(1)制取氯气时,在
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,两者的差别是
(3)①中制取氯气的化学方程式为
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白。
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | |
| 然后溶液从无色逐渐变为 |
A.饱和食盐水 B. Na2S C.高锰酸钾 D. Ca(OH)2
您最近一年使用:0次
2021-02-01更新
|
142次组卷
|
2卷引用:四川省眉山市2020-2021学年高一上期期末考试化学试题
7 . 某化学研究性学习小组以干燥、纯净的 和铁粉为原料,模拟工业制备无水
和铁粉为原料,模拟工业制备无水 ,装置如图。
,装置如图。
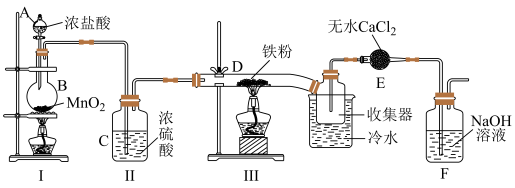
经查阅资料得知:无水 在潮湿环境中易潮解:加热易升华,遇冷易凝华。
在潮湿环境中易潮解:加热易升华,遇冷易凝华。
(1)Ⅰ中装置A的名称___________ ,烧瓶B中发生反应的离子方程式为:___________ 。
(2)开始实验时,先点燃装置___________ (填Ⅰ或Ⅲ)处酒精灯,再点燃另一处酒精灯:上述装置中有一处明显的缺陷,如何改进___________ 。
(3)E装置的作用是___________ ,F中发生反应的离子方程式___________ 。
(4)取少许产品溶于蒸馏水,静置后,向上层清液中滴加KSCN溶液,溶液不变红,产生此现象的可能原因___________ (请用必要的文字或化学方程式解释)
 和铁粉为原料,模拟工业制备无水
和铁粉为原料,模拟工业制备无水 ,装置如图。
,装置如图。
经查阅资料得知:无水
 在潮湿环境中易潮解:加热易升华,遇冷易凝华。
在潮湿环境中易潮解:加热易升华,遇冷易凝华。(1)Ⅰ中装置A的名称
(2)开始实验时,先点燃装置
(3)E装置的作用是
(4)取少许产品溶于蒸馏水,静置后,向上层清液中滴加KSCN溶液,溶液不变红,产生此现象的可能原因
您最近一年使用:0次
8 . 某实验小组设计如下装置(夹持装置未画出)模拟工业生产氯水和漂白粉。

(1)气体发生装置A应选用___________ (填“甲”、“乙”或“丙”),反应的化学方程式为___________ 。
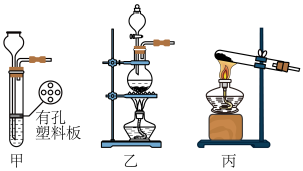
(2)装置B中试剂为___________ 。
(3)制备氯水的装置是___________ (填字母序号)。
(4)装置D用以制备漂白粉,三颈烧瓶中盛装冷的___________ (写试剂名称);采用多孔球泡而非常规导管导气的原因是___________ 。
(5)探究新制氯水的性质:用胶头滴管将氯水滴加到含有酚酞的 稀溶液中,当滴到一定量时,红色突然褪去。
稀溶液中,当滴到一定量时,红色突然褪去。
①[提出猜想]红色褪去的原因可能有两种:
猜想Ⅰ:氯水具有漂白性;
猜想Ⅱ:___________ 。
②[验证猜想]向褪色后的溶液中滴加___________ ,若溶液变红,则证明猜想Ⅱ正确;反之则猜想Ⅰ正确。

(1)气体发生装置A应选用

(2)装置B中试剂为
(3)制备氯水的装置是
(4)装置D用以制备漂白粉,三颈烧瓶中盛装冷的
(5)探究新制氯水的性质:用胶头滴管将氯水滴加到含有酚酞的
 稀溶液中,当滴到一定量时,红色突然褪去。
稀溶液中,当滴到一定量时,红色突然褪去。①[提出猜想]红色褪去的原因可能有两种:
猜想Ⅰ:氯水具有漂白性;
猜想Ⅱ:
②[验证猜想]向褪色后的溶液中滴加
您最近一年使用:0次
9 . 人类对氯的认识经历了漫长的过程。回答下列问题:
(1)18世纪70年代,瑞典化学家舍勒将软锰矿(主要成分是MnO2)与浓盐酸混合加热,首次制得Cl2,该反应的离子方程式是___________ 。
(2)1785年,贝托雷最早利用氯气的水溶液做漂白剂,可以永久性地漂白纸张和鲜花,且在阳光下能够分解产生氧气。某实验小组利用如下实验装置探究氯气是否具有漂白性。___________ ,装置接口的连接顺序是a→______→______→______→______→f。___________
②装置乙中的试剂Y是___________ 。
③实验开始后,关闭装置乙中的开关K,观察到干燥有色布条___________ (填“褪色”或“不褪色”);打开开关K,观察到干燥有色布条___________ (填“褪色”或“不褪色”),证明氯气没有漂白性,但氯气与水反应的产物___________ 具有漂白性。
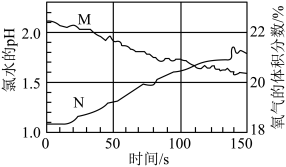
④实验小组利用数字传感器测定广口瓶中的氯水在光照条件下的pH和瓶中氧气的体积分数变化曲线如下图所示,其中表示氯水的pH变化的曲线是___________ (填“M”或“N”),据此分析,此时广口瓶中发生反应的化学方程式是___________ 。___________ 。
(1)18世纪70年代,瑞典化学家舍勒将软锰矿(主要成分是MnO2)与浓盐酸混合加热,首次制得Cl2,该反应的离子方程式是
(2)1785年,贝托雷最早利用氯气的水溶液做漂白剂,可以永久性地漂白纸张和鲜花,且在阳光下能够分解产生氧气。某实验小组利用如下实验装置探究氯气是否具有漂白性。

②装置乙中的试剂Y是
③实验开始后,关闭装置乙中的开关K,观察到干燥有色布条
④实验小组利用数字传感器测定广口瓶中的氯水在光照条件下的pH和瓶中氧气的体积分数变化曲线如下图所示,其中表示氯水的pH变化的曲线是
您最近一年使用:0次
2024-01-24更新
|
45次组卷
|
2卷引用:四川省凉山州宁南中学2023-2024学年高一上学期期末考试化学模拟试题(一)
名校
解题方法
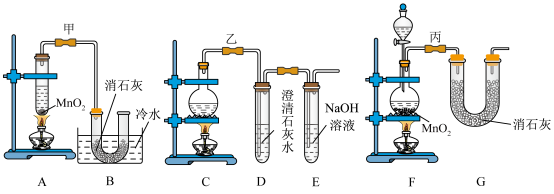
10 . 实验室使用浓盐酸、二氧化锰共热制氯气,并用氯气和氢氧化钙反应制取少量漂白粉(该反应放热)。氯气和氢氧化钙在温度较高时会生成副产物氯酸钙,甲、乙、丙三位同学分别设计了三个实验装置如下图所示:
(1)请写出实验室使用浓盐酸、二氧化锰共热制氯气的离子方程式:___________ 。
(2)哪位同学的装置能够有效地防止副反应的发生?___________ 。
(3)请写出氯气和氢氧化钙制备漂白粉的化学方程式:___________ 。
(4)上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成,从上述甲、乙、丙三套装置中选出合理的部分(按气流从左至右的流向)组装一套较完善的实验装置(填所选部分的字母)___________ 。
(5)实验中若用12mol·L-1的浓盐酸200mL与足量二氧化锰反应,最终生成的次氯酸钙的物质的量总小于0.3mol,其可能的主要原因是___________ (假定各步反应均无反应损耗且无副反应发生)。

(1)请写出实验室使用浓盐酸、二氧化锰共热制氯气的离子方程式:
(2)哪位同学的装置能够有效地防止副反应的发生?
(3)请写出氯气和氢氧化钙制备漂白粉的化学方程式:
(4)上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成,从上述甲、乙、丙三套装置中选出合理的部分(按气流从左至右的流向)组装一套较完善的实验装置(填所选部分的字母)
(5)实验中若用12mol·L-1的浓盐酸200mL与足量二氧化锰反应,最终生成的次氯酸钙的物质的量总小于0.3mol,其可能的主要原因是
您最近一年使用:0次
2024-01-02更新
|
26次组卷
|
2卷引用:四川省宜宾市叙州区第一中学校2023-2024学年高一上学期1月期末化学试题



