名校
解题方法
1 . 为了防控疫情,家居、学校等公共场所都要定时进行消毒。
Ⅰ.工业上使用氯气与氢氧化钠反应制取“84消毒液”
(1)写出“84消毒液”中的有效成分___________ 。
(2)“84消毒液”使用时应按比例稀释,放置20~30min,放置过程中有生成碳酸氢钠,该反应的离子方程式为___________ 。
Ⅱ.“消毒液”中氯元素的存在形态与溶液的pH关系如表:
(3)写出pH降低时产生氯气的离子方程式___________ 。
Ⅲ.同学猜测“84消毒液”(以下简称“84”)可漂白米醋【米醋是一种用稻谷酿制的食用醋,含少量醋酸( ),因含有有机色素而成棕色】,进行了如下实验:
),因含有有机色素而成棕色】,进行了如下实验:
(4)实验二的目的是:
①排除米醋因为挥发产生刺激性气味气体的可能;
②___________ 。
(5)结合反应的方程式,解释实验一立即褪色的原因___________ 。
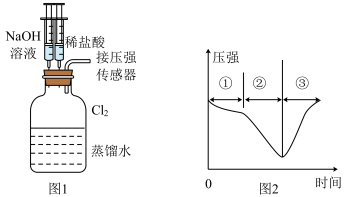
(6)若用氯气做如图1的实验,向装有一瓶氯气的集气瓶中添加适量的蒸馏水,振荡,先利用注射器滴加NaOH溶液,再利用注射器滴加稀盐酸,用压强传感器测得集气瓶内的压强随时间变化的曲线如图2所示。下列说法正确的是___________。
(7)若将一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00 NaOH溶液恰好完全吸收,测得溶液中NaClO的物质的量浓度为0.6
NaOH溶液恰好完全吸收,测得溶液中NaClO的物质的量浓度为0.6 (忽略溶液体积的变化),则:
(忽略溶液体积的变化),则:
①所得溶液中 的物质的量浓度为
的物质的量浓度为___________ ;
②氯气和参加反应的氢气的物质的量之比为___________ 。
Ⅰ.工业上使用氯气与氢氧化钠反应制取“84消毒液”
(1)写出“84消毒液”中的有效成分
(2)“84消毒液”使用时应按比例稀释,放置20~30min,放置过程中有生成碳酸氢钠,该反应的离子方程式为
Ⅱ.“消毒液”中氯元素的存在形态与溶液的pH关系如表:
| 溶液pH | >9 | 5~6 | 4~5 | 2~3 | <2 |
| 主要成分 | NaClO | HCl与NaClO(少量) | HCl与 (少量) (少量) | HClO与 |  |
(3)写出pH降低时产生氯气的离子方程式
Ⅲ.同学猜测“84消毒液”(以下简称“84”)可漂白米醋【米醋是一种用稻谷酿制的食用醋,含少量醋酸(
 ),因含有有机色素而成棕色】,进行了如下实验:
),因含有有机色素而成棕色】,进行了如下实验:| 编号 | 实验一 | 实验二 |
| 实验操作 |  |  |
| 实验现象 | 滴入米醋后立即褪色,闻到刺激性气味 | 溶液为浅棕色,无刺激性气味 |
(4)实验二的目的是:
①排除米醋因为挥发产生刺激性气味气体的可能;
②
(5)结合反应的方程式,解释实验一立即褪色的原因
(6)若用氯气做如图1的实验,向装有一瓶氯气的集气瓶中添加适量的蒸馏水,振荡,先利用注射器滴加NaOH溶液,再利用注射器滴加稀盐酸,用压强传感器测得集气瓶内的压强随时间变化的曲线如图2所示。下列说法正确的是___________。

| A.阶段①说明氯气溶于水,溶于水的氯气全部与水反应 |
| B.阶段②的压强变小,该过程发生了氧化还原反应 |
C.阶段③的压强变大,该过程是NaClO分解产生 的原因 的原因 |
D.若将 换成 换成 ,所得的压强变化趋势与图2相似 ,所得的压强变化趋势与图2相似 |
(7)若将一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00
 NaOH溶液恰好完全吸收,测得溶液中NaClO的物质的量浓度为0.6
NaOH溶液恰好完全吸收,测得溶液中NaClO的物质的量浓度为0.6 (忽略溶液体积的变化),则:
(忽略溶液体积的变化),则:①所得溶液中
 的物质的量浓度为
的物质的量浓度为②氯气和参加反应的氢气的物质的量之比为
您最近一年使用:0次
名校
2 . 2020年突如其来的“新冠肺炎”使人们认识到日常杀菌消毒的重要性。其中含氯消毒剂在生产生活中有着广泛的用途。
(1)写出实验室中制取氯气的离子方程式_______ 。
(2)常温下,氯气与烧碱溶液反应得“84”消毒液,NaClO是“84”消毒液的有效成分,在此次抗击新冠病毒中发挥了重要作用。
①用化学方程式表示“84”消毒液的生成过程:_______ 。工业上用氯气与石灰乳反应制备漂白粉,其有效成分为_______ 。(填化学式)
②居家消毒时,不能将“84”消毒液与洁厕灵(有效成分为盐酸)混合使用,原因是_______ 。
③某温度下,将氯气通入NaOH溶液中,得到NaCl、NaClO和 的混合溶液,经测定
的混合溶液,经测定 与
与 的离子个数比为1:3。该反应中,被氧化的Cl与被还原的Cl的质量之比为
的离子个数比为1:3。该反应中,被氧化的Cl与被还原的Cl的质量之比为_______ 。
(3)世界卫生组织将ClO2定为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有广泛应用。消毒效率是用单位质量的消毒剂得电子数来表示的,ClO2作消毒剂时和氯气一样,还原产物均为 ,ClO2的消毒效率是氯气的
,ClO2的消毒效率是氯气的_______ 倍(保留两位小数)。
(1)写出实验室中制取氯气的离子方程式
(2)常温下,氯气与烧碱溶液反应得“84”消毒液,NaClO是“84”消毒液的有效成分,在此次抗击新冠病毒中发挥了重要作用。
①用化学方程式表示“84”消毒液的生成过程:
②居家消毒时,不能将“84”消毒液与洁厕灵(有效成分为盐酸)混合使用,原因是
③某温度下,将氯气通入NaOH溶液中,得到NaCl、NaClO和
 的混合溶液,经测定
的混合溶液,经测定 与
与 的离子个数比为1:3。该反应中,被氧化的Cl与被还原的Cl的质量之比为
的离子个数比为1:3。该反应中,被氧化的Cl与被还原的Cl的质量之比为(3)世界卫生组织将ClO2定为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有广泛应用。消毒效率是用单位质量的消毒剂得电子数来表示的,ClO2作消毒剂时和氯气一样,还原产物均为
 ,ClO2的消毒效率是氯气的
,ClO2的消毒效率是氯气的
您最近一年使用:0次
20-21高一·浙江·阶段练习
3 . Cl2与NaOH溶液反应可生成NaCl、NaClO和NaClO3,c(Cl-)和c(ClO-)的比值与反应温度有关。用32gNaOH配成的100mL溶液,与Cl2恰好完全反应(忽略Cl2与水的反应、盐类的水解及溶液体积变化)。
(1)参加反应的Cl2的物质的量是__ 。
(2)某温度下,反应后溶液中c(Cl-)=8c(ClO ),则溶液中c(ClO-)=
),则溶液中c(ClO-)=__ 。
(1)参加反应的Cl2的物质的量是
(2)某温度下,反应后溶液中c(Cl-)=8c(ClO
 ),则溶液中c(ClO-)=
),则溶液中c(ClO-)=
您最近一年使用:0次
21-22高一上·浙江·阶段练习
4 . 实验室制取氯气,将多余的氯气用100 mL 1.7 mol·L-1的氢氧化钠溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH- )=0.1 mol·L-1 (不考虑反应前后溶液的体积变化)。ClO-和ClO 的物质的量浓度之比为5:1。
的物质的量浓度之比为5:1。
(1)吸收氯气消耗氢氧化钠的物质的量为_______ 。
(2)被氧化氯气与被还原氯气的物质的量之比为_______ 。
 的物质的量浓度之比为5:1。
的物质的量浓度之比为5:1。(1)吸收氯气消耗氢氧化钠的物质的量为
(2)被氧化氯气与被还原氯气的物质的量之比为
您最近一年使用:0次
解题方法
5 . 将0.6 mol Cl2通入过量的NaOH溶液中,产物中可能有NaCl、NaClO、NaClO3,且产物的成分与温度高低有关。
(1)n(NaCl)+n(NaClO)+n(NaClO3)=______ mol。
(2)改变温度,产物中NaClO3的最大理论产量为_____ mol。
(3)若某温度下,反应后c(Cl-):c(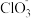 )=8:1,则溶液中c(ClO-):c(
)=8:1,则溶液中c(ClO-):c(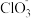 ))=
))=___ 。
(1)n(NaCl)+n(NaClO)+n(NaClO3)=
(2)改变温度,产物中NaClO3的最大理论产量为
(3)若某温度下,反应后c(Cl-):c(
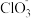 )=8:1,则溶液中c(ClO-):c(
)=8:1,则溶液中c(ClO-):c(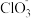 ))=
))=
您最近一年使用:0次
2020·浙江宁波·一模
解题方法
6 . 某兴趣小组探究H2和Cl2反应后的气体与氢氧化钠溶液反应。在标准状况下,H2和Cl2的混合气体共2.24 L,光照充分反应后,用NaOH溶液充分吸收。
(1)消耗NaOH物质的量的最大值为___________ mol。
(2)请在下图中画出NaCl的物质的量随H2的体积分数的变化图象_______ 。(横坐标表示原混合气体中H2的体积分数,纵坐标表示充分反应后NaCl的物质的量。)

(1)消耗NaOH物质的量的最大值为
(2)请在下图中画出NaCl的物质的量随H2的体积分数的变化图象

您最近一年使用:0次
7 . 试回答下列问题
(1)等物质的量的SO2和SO3所含的原子个数之比是__________ ,质量比是__________ 。
(2)0.4 mol NH3中所含氢原子数与__________ 克水中所含氢原子数相等。
(3)如图是“康师傅”牌饮用矿泉水的标签的部分内容。
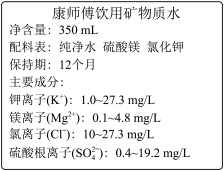
请认真阅读标签内容,计算:
①镁离子的物质的量浓度的最大值是_________ 。
②一瓶合格的这种矿泉水中硫酸根离子的物质的量不能超过___________ mol
(4)在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的 完全沉淀;若加入足量NaOH 并加热可得到c mol NH3,则原溶液中Al3+的物质的量浓度为
完全沉淀;若加入足量NaOH 并加热可得到c mol NH3,则原溶液中Al3+的物质的量浓度为_____________ 。
(5)摩尔是以___________ kg 12C中所含的原子数目为标准,来衡量其它粒子集体中所含粒子数目的多少。如果定义3.01×1023个12C原子的物质的量为1mol,那么此时标准状况下,气体摩尔体积的数值约为___________ L/mol。
(6)氯气尾气处理的化学反应方程式为:_______________________________ 。
(1)等物质的量的SO2和SO3所含的原子个数之比是
(2)0.4 mol NH3中所含氢原子数与
(3)如图是“康师傅”牌饮用矿泉水的标签的部分内容。

请认真阅读标签内容,计算:
①镁离子的物质的量浓度的最大值是
②一瓶合格的这种矿泉水中硫酸根离子的物质的量不能超过
(4)在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的
 完全沉淀;若加入足量NaOH 并加热可得到c mol NH3,则原溶液中Al3+的物质的量浓度为
完全沉淀;若加入足量NaOH 并加热可得到c mol NH3,则原溶液中Al3+的物质的量浓度为(5)摩尔是以
(6)氯气尾气处理的化学反应方程式为:
您最近一年使用:0次
8 . 已知,一定条件下,Cl2和NaOH溶液反应后可得到NaCl、NaClO和NaClO3(Cl-和ClO-的比值和反应温度、浓度有关)。Cl2和NaOH溶液生成NaClO3的反应为:6NaOH+3Cl2=5NaCl+NaClO3+3H2O。若某温度下,将制备所得的一定体积的Cl2通入220mL3mol/L的NaOH溶液中,恰好完全反应(忽略Cl2与水反应及溶液体积的变化),测定反应后溶液中c(Cl-)=3c(ClO-),则通入的Cl2的物质的量为_________ mol,溶液中ClO-的物质的量为_________ mol。
您最近一年使用:0次
名校
解题方法
9 . 电解26.8%的食盐水1500g,若食盐的利用率为87.3%,求:
(1)在标准状况下可制得Cl2多少升?___ (不考虑氯气溶解)
(2)电解液中氢氧化钠的质量百分比浓度为多少?___
(3)取一定量的氢气和氯气混合,点燃充分反应,所得混合物用100mL15.67%的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。求溶液中NaCl的物质的量浓度___ ,以及所取氢气和氯气的混合气体相对于同温同压下空气的相对密度,假设反应前后溶液体积不变,结果保留两位小数。___
(1)在标准状况下可制得Cl2多少升?
(2)电解液中氢氧化钠的质量百分比浓度为多少?
(3)取一定量的氢气和氯气混合,点燃充分反应,所得混合物用100mL15.67%的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。求溶液中NaCl的物质的量浓度
您最近一年使用:0次
2020-10-04更新
|
378次组卷
|
2卷引用:上海市复旦大学附属中学2019-2020学年高一上学期期中考试化学试题
名校
10 . (1)在一密闭容器中盛有aL含Cl2和H2的混合气体,用电火花引燃后,恢复到原来状态,发现气体仍为aL。用足量的NaOH溶液吸收燃烧后的气体,结果无气体剩余。由以上条件,推知原混合气体中Cl2和H2物质的量之比一定是___ 。
A.Cl2:H2=1 B.Cl2:H2<1 C.Cl2:H2≥1 D.Cl2:H2≤1
(2)氢气在氯气中充分燃烧,若两者的体积比为1:2,所得混合物用200mL3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收。
①求原NaOH溶液的质量分数___ 。(结果用小数表示,保留3位小数)
②求所得溶液中Cl-与ClO-的物质的量之比___ 。
③求溶液中ClO-的物质的量___ 。
A.Cl2:H2=1 B.Cl2:H2<1 C.Cl2:H2≥1 D.Cl2:H2≤1
(2)氢气在氯气中充分燃烧,若两者的体积比为1:2,所得混合物用200mL3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收。
①求原NaOH溶液的质量分数
②求所得溶液中Cl-与ClO-的物质的量之比
③求溶液中ClO-的物质的量
您最近一年使用:0次
2020-03-04更新
|
221次组卷
|
2卷引用:上海复旦附中2015年高一上学期化学试题



