1 . 试回答下列问题
(1)等物质的量的SO2和SO3所含的原子个数之比是__________ ,质量比是__________ 。
(2)0.4 mol NH3中所含氢原子数与__________ 克水中所含氢原子数相等。
(3)如图是“康师傅”牌饮用矿泉水的标签的部分内容。
①镁离子的物质的量浓度的最大值是_________ 。
②一瓶合格的这种矿泉水中硫酸根离子的物质的量不能超过___________ mol
(4)在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的 完全沉淀;若加入足量NaOH 并加热可得到c mol NH3,则原溶液中Al3+的物质的量浓度为
完全沉淀;若加入足量NaOH 并加热可得到c mol NH3,则原溶液中Al3+的物质的量浓度为_____________ 。
(5)摩尔是以___________ kg 12C中所含的原子数目为标准,来衡量其它粒子集体中所含粒子数目的多少。如果定义3.01×1023个12C原子的物质的量为1mol,那么此时标准状况下,气体摩尔体积的数值约为___________ L/mol。
(6)氯气尾气处理的化学反应方程式为:_______________________________ 。
(1)等物质的量的SO2和SO3所含的原子个数之比是
(2)0.4 mol NH3中所含氢原子数与
(3)如图是“康师傅”牌饮用矿泉水的标签的部分内容。
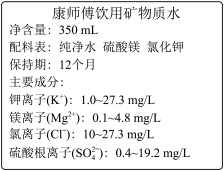
①镁离子的物质的量浓度的最大值是
②一瓶合格的这种矿泉水中硫酸根离子的物质的量不能超过
(4)在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的
 完全沉淀;若加入足量NaOH 并加热可得到c mol NH3,则原溶液中Al3+的物质的量浓度为
完全沉淀;若加入足量NaOH 并加热可得到c mol NH3,则原溶液中Al3+的物质的量浓度为(5)摩尔是以
(6)氯气尾气处理的化学反应方程式为:
您最近一年使用:0次
2 . 已知,一定条件下,Cl2和NaOH溶液反应后可得到NaCl、NaClO和NaClO3(Cl-和ClO-的比值和反应温度、浓度有关)。Cl2和NaOH溶液生成NaClO3的反应为:6NaOH+3Cl2=5NaCl+NaClO3+3H2O。若某温度下,将制备所得的一定体积的Cl2通入220mL3mol/L的NaOH溶液中,恰好完全反应(忽略Cl2与水反应及溶液体积的变化),测定反应后溶液中c(Cl-)=3c(ClO-),则通入的Cl2的物质的量为_________ mol,溶液中ClO-的物质的量为_________ mol。
您最近一年使用:0次
名校
解题方法
3 . 2020 年突如其来的“新冠肺炎”使人们认识到日常杀菌消毒的重要性。其中含氯消 毒剂在生产生活中有着广泛的用途。
I.NaClO 是“84”消毒液的有效成分,在此次抗击新冠病毒中发挥了重要作用,请回答下列问题。
(1)浸泡衣物时加入“84”消毒液在空气中放置一段时间漂白效果更好,原因用离子方程式表示为:_____ 。(已知酸性:H2 CO3 >HClO>HCO )
)
(2)若将“84”消毒液与洁厕灵(主要成分是盐酸)混合使用,则会产生黄绿色的有毒气体,其反应的离子方程式是_____ 。
II.ClO2是一种黄绿色或橙黄色的气体,极易溶于水,可用于水的消毒杀菌及烟气的脱硫 脱硝。回答下列问题:
(3)将过硫酸钠(Na2S2O8)溶液加入亚氯酸钠(NaClO2)中可制备 ClO2,该反应中氧化剂和还原剂的物质的量之比为_____ 。
(4)为研究 ClO2脱硝的适宜条件,在 1L200 mg•L-1 ClO2溶液中加 NaOH 溶液调节 pH,通入 NO 气体并测定 NO 的去除率,脱硝后 N 元素以 NO 形式存在,其关系如下图所示:
形式存在,其关系如下图所示:_____ (保留一位有效数字);要使 NO 的去除率更高,应控制的条件是_______ 。
②NaClO2吸收 NO 的效率高于 C1O2,请写出碱性条件下 NaClO2脱除 NO 反应的离子方程式:_____ 。
I.NaClO 是“84”消毒液的有效成分,在此次抗击新冠病毒中发挥了重要作用,请回答下列问题。
(1)浸泡衣物时加入“84”消毒液在空气中放置一段时间漂白效果更好,原因用离子方程式表示为:
 )
) (2)若将“84”消毒液与洁厕灵(主要成分是盐酸)混合使用,则会产生黄绿色的有毒气体,其反应的离子方程式是
II.ClO2是一种黄绿色或橙黄色的气体,极易溶于水,可用于水的消毒杀菌及烟气的脱硫 脱硝。回答下列问题:
(3)将过硫酸钠(Na2S2O8)溶液加入亚氯酸钠(NaClO2)中可制备 ClO2,该反应中氧化剂和还原剂的物质的量之比为
(4)为研究 ClO2脱硝的适宜条件,在 1L200 mg•L-1 ClO2溶液中加 NaOH 溶液调节 pH,通入 NO 气体并测定 NO 的去除率,脱硝后 N 元素以 NO
 形式存在,其关系如下图所示:
形式存在,其关系如下图所示:
②NaClO2吸收 NO 的效率高于 C1O2,请写出碱性条件下 NaClO2脱除 NO 反应的离子方程式:
您最近一年使用:0次
名校
解题方法
4 . 电解26.8%的食盐水1500g,若食盐的利用率为87.3%,求:
(1)在标准状况下可制得Cl2多少升?___ (不考虑氯气溶解)
(2)电解液中氢氧化钠的质量百分比浓度为多少?___
(3)取一定量的氢气和氯气混合,点燃充分反应,所得混合物用100mL15.67%的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。求溶液中NaCl的物质的量浓度___ ,以及所取氢气和氯气的混合气体相对于同温同压下空气的相对密度,假设反应前后溶液体积不变,结果保留两位小数。___
(1)在标准状况下可制得Cl2多少升?
(2)电解液中氢氧化钠的质量百分比浓度为多少?
(3)取一定量的氢气和氯气混合,点燃充分反应,所得混合物用100mL15.67%的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。求溶液中NaCl的物质的量浓度
您最近一年使用:0次
2020-10-04更新
|
391次组卷
|
2卷引用:上海市复旦大学附属中学2019-2020学年高一上学期期中考试化学试题
名校
解题方法
5 . 氯气(液氯)、84消毒液、漂白粉等都是含氯消毒剂。
(1)实验室中用MnO2或KMnO4与浓盐酸反应制取氯气。若用二者制备等质量的氯气消耗HCl的物质的量之比为__________ 。
(2)由于氯气不易保存,生活中常用的含氯消毒剂为漂白粉和84消毒液。
①用氯气制漂白粉的化学方程式为_______ ;该反应中氧化剂与还原剂的物质的量之比为________ 。
②含氯消毒剂的消毒能力可以用氧化性来衡量。商业上常用“有效氯”来说明消毒剂的消毒能力。“有效氯”的基本含义是指一定质量的这种消毒剂与多少质量的氯气的氧化能力相当,其数值可以用此时氯气的质量对消毒剂质量的百分比来表示。若100g某84消毒液产品中含有7.45g次氯酸钠,该产品的有效氯含量为__________ (要求写出简要计算过程)。
(1)实验室中用MnO2或KMnO4与浓盐酸反应制取氯气。若用二者制备等质量的氯气消耗HCl的物质的量之比为
(2)由于氯气不易保存,生活中常用的含氯消毒剂为漂白粉和84消毒液。
①用氯气制漂白粉的化学方程式为
②含氯消毒剂的消毒能力可以用氧化性来衡量。商业上常用“有效氯”来说明消毒剂的消毒能力。“有效氯”的基本含义是指一定质量的这种消毒剂与多少质量的氯气的氧化能力相当,其数值可以用此时氯气的质量对消毒剂质量的百分比来表示。若100g某84消毒液产品中含有7.45g次氯酸钠,该产品的有效氯含量为
您最近一年使用:0次
14-15高三上·上海宝山·期末
解题方法
6 . 一般情况下,较强的氧化剂如:MnO2、KMnO4、KClO3、Ca(ClO)2等氧化浓盐酸时,有如下反应规律:氧化剂+浓盐酸→金属氯化物+水+氯气。实验室通常用该原理制取少量Cl2。
(1)将214.5gCa(ClO)2放入500mL12.0mol/L的浓盐酸中,生成的Cl2在标准状况下的体积为39.2L。若反应前后溶液的体积保持不变,计算反应后溶液中HCl的物质的量浓度。_______
(2)漂白粉是 Ca(ClO)2、CaCl2 、Ca(OH)2 、H2O 和 CaO 的混合物。漂白粉放出的氯气具有漂白作用,叫有效氯。通常用有效氯表示漂白粉的纯度。漂白粉中的有效氯含量常用滴定碘法进行测定,即在一定量的漂白粉中加入过量的KI ,加H2SO4酸化,有效氯与I-作用析出等量的I2,析出的I2以淀粉指示剂立即用Na2S2O3标准溶液滴定。若测定漂白粉中有效氯时用盐酸酸化,则盐酸的浓度应小于_______ mol/L,否则测定的有效氯将_______ (选填“偏高”、“偏低”或“不变”)。
(1)将214.5gCa(ClO)2放入500mL12.0mol/L的浓盐酸中,生成的Cl2在标准状况下的体积为39.2L。若反应前后溶液的体积保持不变,计算反应后溶液中HCl的物质的量浓度。
(2)漂白粉是 Ca(ClO)2、CaCl2 、Ca(OH)2 、H2O 和 CaO 的混合物。漂白粉放出的氯气具有漂白作用,叫有效氯。通常用有效氯表示漂白粉的纯度。漂白粉中的有效氯含量常用滴定碘法进行测定,即在一定量的漂白粉中加入过量的KI ,加H2SO4酸化,有效氯与I-作用析出等量的I2,析出的I2以淀粉指示剂立即用Na2S2O3标准溶液滴定。若测定漂白粉中有效氯时用盐酸酸化,则盐酸的浓度应小于
您最近一年使用:0次
名校
7 . (1)在一密闭容器中盛有aL含Cl2和H2的混合气体,用电火花引燃后,恢复到原来状态,发现气体仍为aL。用足量的NaOH溶液吸收燃烧后的气体,结果无气体剩余。由以上条件,推知原混合气体中Cl2和H2物质的量之比一定是___ 。
A.Cl2:H2=1 B.Cl2:H2<1 C.Cl2:H2≥1 D.Cl2:H2≤1
(2)氢气在氯气中充分燃烧,若两者的体积比为1:2,所得混合物用200mL3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收。
①求原NaOH溶液的质量分数___ 。(结果用小数表示,保留3位小数)
②求所得溶液中Cl-与ClO-的物质的量之比___ 。
③求溶液中ClO-的物质的量___ 。
A.Cl2:H2=1 B.Cl2:H2<1 C.Cl2:H2≥1 D.Cl2:H2≤1
(2)氢气在氯气中充分燃烧,若两者的体积比为1:2,所得混合物用200mL3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收。
①求原NaOH溶液的质量分数
②求所得溶液中Cl-与ClO-的物质的量之比
③求溶液中ClO-的物质的量
您最近一年使用:0次
2020-03-04更新
|
222次组卷
|
2卷引用:上海复旦附中2015年高一上学期化学试题
2019高一·浙江·专题练习
8 . 一定量 在
在 中燃烧,所得混合物被100mL含NaOH12.0g的溶液恰好完全吸收,测得溶液中含 NaClO的物质的量为0.0500mol
中燃烧,所得混合物被100mL含NaOH12.0g的溶液恰好完全吸收,测得溶液中含 NaClO的物质的量为0.0500mol
(1)原NaOH溶液物质的量浓度为________ 。
(2)所得溶液中 的物质的量为
的物质的量为________ 。
(3)所用氯气和参加反应的氢气的物质的量之比为________ 。
 在
在 中燃烧,所得混合物被100mL含NaOH12.0g的溶液恰好完全吸收,测得溶液中含 NaClO的物质的量为0.0500mol
中燃烧,所得混合物被100mL含NaOH12.0g的溶液恰好完全吸收,测得溶液中含 NaClO的物质的量为0.0500mol(1)原NaOH溶液物质的量浓度为
(2)所得溶液中
 的物质的量为
的物质的量为(3)所用氯气和参加反应的氢气的物质的量之比为
您最近一年使用:0次
2019高一·浙江·专题练习
解题方法
9 . 一定量的氢气在氯气中燃烧,所得混合物用200mL1.50mol·L-1的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.06mol。(反应前后溶液体积变化忽略不计)
(1)所得溶液中Cl-的物质的量浓度为___ mol/L。
(2)所用氯气和参加反应的氢气的物质的量之比n(Cl2)∶n(H2)=__ 。
(1)所得溶液中Cl-的物质的量浓度为
(2)所用氯气和参加反应的氢气的物质的量之比n(Cl2)∶n(H2)=
您最近一年使用:0次
解题方法
10 . (1)工业上用112 L(标准状况)氯气与足量石灰乳反应,制得的漂白粉中有效成分Ca(ClO)2的最大含量为___________ mol。
(2)向一定量石灰乳中缓慢通入氯气,随着反应的进行,温度升高,开始产生Ca(ClO3)2。体系中ClO-和ClO3-的物质的量(n)与反应时间(t)的关系曲线如图1所示(不考虑氯气和水的反应)。
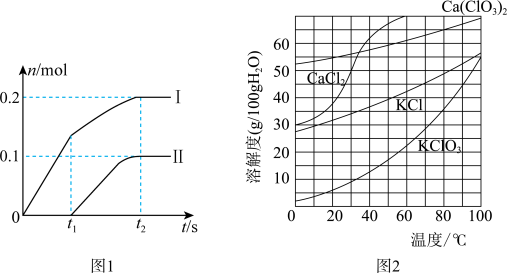
①t2时刻后,溶液中ClO-和ClO3-的物质的量之比为_____________ 。
②该反应过程中消耗Ca(OH)2的质量为_____________ 。
(3)向Ca(ClO3)2浓溶液中加入稍过量的KCl固体可转化为KClO3,如图2,从该溶液中分离出KClO3固体的实验方法是________________ (不要求填具体操作步骤)。
(2)向一定量石灰乳中缓慢通入氯气,随着反应的进行,温度升高,开始产生Ca(ClO3)2。体系中ClO-和ClO3-的物质的量(n)与反应时间(t)的关系曲线如图1所示(不考虑氯气和水的反应)。

①t2时刻后,溶液中ClO-和ClO3-的物质的量之比为
②该反应过程中消耗Ca(OH)2的质量为
(3)向Ca(ClO3)2浓溶液中加入稍过量的KCl固体可转化为KClO3,如图2,从该溶液中分离出KClO3固体的实验方法是
您最近一年使用:0次



