名校
解题方法
1 . 实验室用石墨电极电解加有酚酞的饱和NaCl溶液,装置如图1所示。氯碱工业用图2所示装置制备NaOH等工业原料。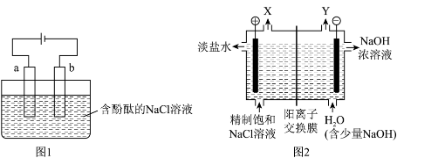
(1)a为电解池的
(2)该电解池中发生的总反应的化学方程式为
(3)下列与电解饱和食盐水有关的说法,正确的是
A.通电使NaCl发生电离
B.在溶液中,阴离子向电极a移动
C.a电极附近溶液变红
Ⅱ.利用实验室装置制备NaOH,不仅有安全隐患,而且存在Cl2与NaOH的副反应,氯碱工业采用改进后的装置,如上图2所示。
(4)气体X和气体Y被阳离子交换膜分隔开,避免混合爆炸。气体X是
(5)阳离子交换膜避免了Cl2与NaOH发生反应,写出Cl2 与NaOH常温下反应的离子方程式
(6)某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3混合溶液,经测定ClO-、
 的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原与被氧化的氯元素的物质的量之比为_____。
的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原与被氧化的氯元素的物质的量之比为_____。| A.21:5 | B.4:1 | C.3:1 | D.11:3 |
您最近半年使用:0次
2 . Cl2、SO2、CO2均是中学化学常见的气体,减少Cl2、SO2的排放可以防止污染空气,减少CO2的排放,有利于保护环境,实现碳中和。回答下列问题:
(1)化工厂可用浓氨水来检验Cl2是否泄漏,当有少量Cl2泄漏时,可以观察到的现象是________ 。
(2)用热烧碱溶液吸收Cl2反应后的混合溶液,若含NaCl、NaClO和NaClO3物质的量比值为n∶1∶2,则n=________ 。
(3)常温下,可用NaOH溶液作CO2的捕捉剂。若经测定某次捕捉所得溶液中,Na和C两种元素物质的量比值为3:1,则所得溶液中溶质成分为________ (填化学式)。
(4)①除品红外,鉴别SO2、CO2两种气体还可以采用________ (填试剂名称),SO2、Cl2均有漂白性,若将两者1∶1通入品红溶液中,不能使品红褪色,理由是________ (写离子方程式),除去SO2中的HCl可采用________ (填试剂名称)。
②用硫酸酸化的K2Cr2O7溶液处理SO2气体,会析出铬钾矾[KCr(SO4)2·12H2O]晶体。写出该反应的化学方程式:________ 。
(1)化工厂可用浓氨水来检验Cl2是否泄漏,当有少量Cl2泄漏时,可以观察到的现象是
(2)用热烧碱溶液吸收Cl2反应后的混合溶液,若含NaCl、NaClO和NaClO3物质的量比值为n∶1∶2,则n=
(3)常温下,可用NaOH溶液作CO2的捕捉剂。若经测定某次捕捉所得溶液中,Na和C两种元素物质的量比值为3:1,则所得溶液中溶质成分为
(4)①除品红外,鉴别SO2、CO2两种气体还可以采用
②用硫酸酸化的K2Cr2O7溶液处理SO2气体,会析出铬钾矾[KCr(SO4)2·12H2O]晶体。写出该反应的化学方程式:
您最近半年使用:0次
3 . 实验室常用二氧化锰和浓盐酸共热的方法制取氯气。根据要求回答下列问题。
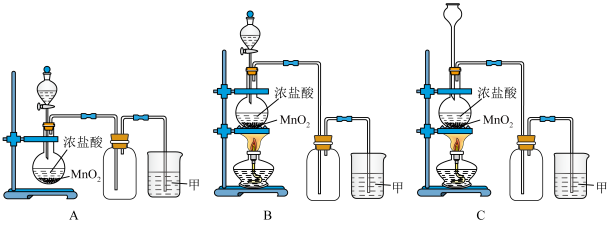
(1)A、B、C三套装置中,应选用的装置是___________ (选填“A”、“B”、“C”)。
(2)写出制取氯气的化学方程式___________ 。
(3)为了防止氯气污染环境,图中溶液甲中发生的化学反应方程式___________ 。
(4)由于氯气贮存运输不方便,工业上常将氯气转化为漂白粉,在空气中漂白粉长期存放会变质而失效的原理是___________ (用化学方程式说明)
(5)实验室也可用 固体和浓盐酸反应制取氯气,反应方程式:
固体和浓盐酸反应制取氯气,反应方程式: 。请用双线桥标出电子转移的方向和数目:
。请用双线桥标出电子转移的方向和数目:___________ 。若反应中有5mol电子转移,被氧化HCl的的物质的量为___________ 。

(1)A、B、C三套装置中,应选用的装置是
(2)写出制取氯气的化学方程式
(3)为了防止氯气污染环境,图中溶液甲中发生的化学反应方程式
(4)由于氯气贮存运输不方便,工业上常将氯气转化为漂白粉,在空气中漂白粉长期存放会变质而失效的原理是
(5)实验室也可用
 固体和浓盐酸反应制取氯气,反应方程式:
固体和浓盐酸反应制取氯气,反应方程式: 。请用双线桥标出电子转移的方向和数目:
。请用双线桥标出电子转移的方向和数目:
您最近半年使用:0次
4 . 下表是生活生产中常见的物质:
(1)分别写出③、⑥的电离方程式__________ ;__________ 。
(2)③与⑥反应的离子方程式:__________ 。
(3)检验⑤的溶液中含有 的方法是:
的方法是:__________ ,有关的离子方程式为__________ 。
(4)常温下,将 通入②中,可以得到一种漂白液,该漂白液的有效成分为
通入②中,可以得到一种漂白液,该漂白液的有效成分为__________ (填名称),检验中②阳离子的方法是__________ (填名称)。
编号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
名称 | Na |
|
| 酒精 |
|
|
(2)③与⑥反应的离子方程式:
(3)检验⑤的溶液中含有
 的方法是:
的方法是:(4)常温下,将
 通入②中,可以得到一种漂白液,该漂白液的有效成分为
通入②中,可以得到一种漂白液,该漂白液的有效成分为
您最近半年使用:0次
5 . 某工厂在山坡坑道的仓库里贮有氯气钢瓶。某天,有一只贮有氯气的钢瓶损坏,造成氯气泄漏,在场工人采取以下措施,请选择。
(1)①处理该钢瓶的方法正确的是_______ 。
A.钢瓶推到坡下的小河里 B.把钢瓶丢到深坑里,用石灰填埋 C.把钢瓶扔到农田中
②若在场工人没有防毒面具,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是_______ 。
A.NaOH B.NaCl C.Na2CO3
(2)为了探究HClO的漂白性,某同学设计了如图的实验:

①将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是_______ ;氯水可作为漂白剂,起主要作用的是氯水中含有的_______ (用化学式表示)。
②为防止氯气尾气污染空气,可用NaOH溶液吸收多余的氯气,原理是_______ (化学方程式);根据这一原理,工业上常用廉价的石灰乳吸收制得漂白粉,漂白粉的有效成分是_______ (填化学式)。
(1)①处理该钢瓶的方法正确的是
A.钢瓶推到坡下的小河里 B.把钢瓶丢到深坑里,用石灰填埋 C.把钢瓶扔到农田中
②若在场工人没有防毒面具,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是
A.NaOH B.NaCl C.Na2CO3
(2)为了探究HClO的漂白性,某同学设计了如图的实验:

①将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是
②为防止氯气尾气污染空气,可用NaOH溶液吸收多余的氯气,原理是
您最近半年使用:0次
名校
6 . 按要求回答下列问题。
(1)写出重晶石主要成分的化学式_______ 。
(2)写出用氢氧化钠溶液吸收尾气氯气的化学方程式_______ 。
(3)向氯化铁溶液中滴加硫氰化钾溶液,现象是_______ 。
(1)写出重晶石主要成分的化学式
(2)写出用氢氧化钠溶液吸收尾气氯气的化学方程式
(3)向氯化铁溶液中滴加硫氰化钾溶液,现象是
您最近半年使用:0次
名校
7 . 物质类别和核心元素的价态是学习元素及其化合物性质的两个重要认识视角。如图为氯元素的“价-类”二维图。
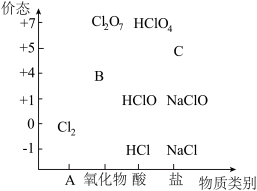
请回答下列问题:
(1)二维图中B可以代替 成为新时代自来水消毒剂,则B是
成为新时代自来水消毒剂,则B是___________ (填化学式,下同);C是一种钠盐,则C是___________ 。
(2)某同学利用①FeO、② 、③NaOH探究盐酸的性质,进行了如下预测:从物质类别上看,盐酸属于酸,可能与
、③NaOH探究盐酸的性质,进行了如下预测:从物质类别上看,盐酸属于酸,可能与________ (填序号)发生反应;从化合价角度看,盐酸中 具有
具有_________ 性,可能与(填序号)___________ 发生反应。
(3)若将84消毒液与双氧水混用给游泳池消毒,反应产生的 会促进藻类快速生长,使池水变绿,写出反应的化学方程式并用单线桥法表示该反应电子转移的方向和数目:
会促进藻类快速生长,使池水变绿,写出反应的化学方程式并用单线桥法表示该反应电子转移的方向和数目:___________ 。
(4)一定温度下, 与NaOH溶液反应生成NaCl、NaClO和
与NaOH溶液反应生成NaCl、NaClO和 的混合物,若NaClO与
的混合物,若NaClO与 的系数之比为3∶1,则反应的离子方程式为
的系数之比为3∶1,则反应的离子方程式为___________ 。

请回答下列问题:
(1)二维图中B可以代替
 成为新时代自来水消毒剂,则B是
成为新时代自来水消毒剂,则B是(2)某同学利用①FeO、②
 、③NaOH探究盐酸的性质,进行了如下预测:从物质类别上看,盐酸属于酸,可能与
、③NaOH探究盐酸的性质,进行了如下预测:从物质类别上看,盐酸属于酸,可能与 具有
具有(3)若将84消毒液与双氧水混用给游泳池消毒,反应产生的
 会促进藻类快速生长,使池水变绿,写出反应的化学方程式并用单线桥法表示该反应电子转移的方向和数目:
会促进藻类快速生长,使池水变绿,写出反应的化学方程式并用单线桥法表示该反应电子转移的方向和数目:(4)一定温度下,
 与NaOH溶液反应生成NaCl、NaClO和
与NaOH溶液反应生成NaCl、NaClO和 的混合物,若NaClO与
的混合物,若NaClO与 的系数之比为3∶1,则反应的离子方程式为
的系数之比为3∶1,则反应的离子方程式为
您最近半年使用:0次
8 . 某家用防疫用品“84消毒液”的包装说明如下,请回答下列问题:
(1)“84”消毒液可由 与
与 溶液反应制得,
溶液反应制得, 与
与 溶液反应的化学方程式为
溶液反应的化学方程式为_______ 。
(2)欲将“84消毒液”原液稀释配制成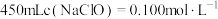 的溶液。
的溶液。
①配制过程中,需要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、_______ 、_______ 。
②配制时,需要取用_______  “84消毒液”原液。
“84消毒液”原液。
③下列操作会使溶液中 浓度偏低的是
浓度偏低的是_______ 。
A.转移溶液后,未洗涤烧杯和玻璃棒
B.定容操作时,俯视刻度线
C.量取“84消毒液”原液时,仰视读数
D.定容摇匀后,液面低于刻度线,再加水至刻度线
(3)利用如图装置探究84消毒液与洁厕灵(主要成分为盐酸)的反应,当注射器中的洁厕灵注入试管中装置内产生黄绿色气体,原因为_______ (写离子方程式),可观察到pH试纸的现象是_______ 。
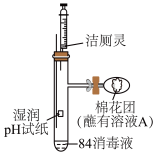
| 【产品名称】84消毒液 【有效成分】  【规格】  【物质的量浓度】 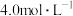 注:(1)按一定比例稀释后使用 (2)不得与酸性产品(如洁厕灵)同时使用。 |
(1)“84”消毒液可由
 与
与 溶液反应制得,
溶液反应制得, 与
与 溶液反应的化学方程式为
溶液反应的化学方程式为(2)欲将“84消毒液”原液稀释配制成
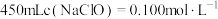 的溶液。
的溶液。①配制过程中,需要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、
②配制时,需要取用
 “84消毒液”原液。
“84消毒液”原液。③下列操作会使溶液中
 浓度偏低的是
浓度偏低的是A.转移溶液后,未洗涤烧杯和玻璃棒
B.定容操作时,俯视刻度线
C.量取“84消毒液”原液时,仰视读数
D.定容摇匀后,液面低于刻度线,再加水至刻度线
(3)利用如图装置探究84消毒液与洁厕灵(主要成分为盐酸)的反应,当注射器中的洁厕灵注入试管中装置内产生黄绿色气体,原因为

您最近半年使用:0次
9 . 氯气及其化合物在工农业生产和人类生活中都有着重要的应用。
(1)NaClO中Cl的化合价为______ ,有较强的______ (填氧化、还原)性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式______ 。
(2)黄绿色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,此反应的离子方程式为______ ;
②ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为______ ;
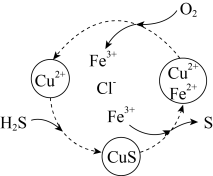
(3)将H2S和空气的混合气体通入FcCl3、FeCl2,CuCl2的混合溶液中反应可以回收S,其物质转化如下图所示。在图示的转化过程中,化合价保持不变的元素有______ (写元素符号),Fe2+和Cu2+反应过程中起______ 作用,该图示的总反应的化学方程式为______ 。
(1)NaClO中Cl的化合价为
(2)黄绿色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,此反应的离子方程式为
②ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为
(3)将H2S和空气的混合气体通入FcCl3、FeCl2,CuCl2的混合溶液中反应可以回收S,其物质转化如下图所示。在图示的转化过程中,化合价保持不变的元素有

您最近半年使用:0次
名校
10 . Ca(ClO)2、NaClO、FeCl3、Al2O3、Fe2O3、Mn2O7等都是重要的化合物。回答下列问题:
(1)属于酸性氧化物的是______ (填化学式),其相应的钾盐具有_____ (填“强氧化性”或“强还原性”),FeSO4溶液能使该钾盐的酸性溶液褪色,其原因为________ (用离子方程式解释)。
(2)属于“84"消毒液成分的是______ (填化学式),其在空气中易变质,产物之一为碳酸氢钠,写出发生该反应的离子方程式:_______ 。
(3)用覆铜板制作印刷电路板的原理是_______ (用离子方程式表示),检验“腐蚀液”中有无Fe3+的试剂为______ (填化学式)。
(4)将氯气通入冷的_____ (填物质名称)中可制得以Ca(ClO)2为有效成分的漂白粉,该过程中转移2mol电子时,消耗氧化剂与还原剂的质量之比为________ 。
(1)属于酸性氧化物的是
(2)属于“84"消毒液成分的是
(3)用覆铜板制作印刷电路板的原理是
(4)将氯气通入冷的
您最近半年使用:0次






