1 . 某校化学小组同学将氯气通入NaOH溶液中,制得一种消毒液,运用下列实验,检测该消毒液的性质:
①将少量消毒液滴入含有淀粉的KI溶液中,溶液中出现蓝色;
②用pH试纸检测消毒液,试纸边缘为蓝紫色(pH=13),中间部分为白色;
③向消毒液中加入少量稀硫酸,溶液变为黄绿色,产生使湿润的淀粉KI试纸变蓝的气体。请回答以下问题:
(1)用离子方程式表示制备该消毒液的原理___________ 。
(2)该消毒液中大量存在的阴离子有OH-、___________ 、___________ 。
(3)实验①表现出该消毒液具有___________ 性。
(4)实验②用pH试纸检测消毒液的操作是___________ 。
(5)实验③中涉及反应的离子方程式为___________ 。
①将少量消毒液滴入含有淀粉的KI溶液中,溶液中出现蓝色;
②用pH试纸检测消毒液,试纸边缘为蓝紫色(pH=13),中间部分为白色;
③向消毒液中加入少量稀硫酸,溶液变为黄绿色,产生使湿润的淀粉KI试纸变蓝的气体。请回答以下问题:
(1)用离子方程式表示制备该消毒液的原理
(2)该消毒液中大量存在的阴离子有OH-、
(3)实验①表现出该消毒液具有
(4)实验②用pH试纸检测消毒液的操作是
(5)实验③中涉及反应的离子方程式为
您最近一年使用:0次
22-23高二上·全国·课时练习
2 . 电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2_____ (填“>”“=”或“<”)2L,原因是_____ 。装置改进后,可用于制备NaOH溶液,若测定NaOH溶液的浓度,常用的方法为_____ 。


您最近一年使用:0次
解题方法
3 . 写出下列反应的化学方程式,标出电子转移的方向和数目,并指出氯气在反应中表现出什么性质。
(1)氢气在氯气中燃烧_______ 。
(2)氯气与氢氧化钠反应_______ 。
(3)铁在氯气中燃烧_______ 。
(1)氢气在氯气中燃烧
(2)氯气与氢氧化钠反应
(3)铁在氯气中燃烧
您最近一年使用:0次
20-21高一上·广东东莞·期中
名校
解题方法
4 . 氯水中含有多种成分,因而具有多种性质,根据新制氯水分别与如图四种物质发生的反应填空(a、b、c、d、e中重合部分代表物质间反应,且氯水足量)。
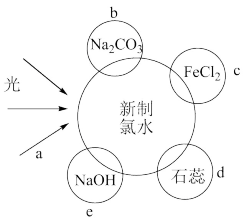
(1)氯水中含有的粒子有H2O、Cl2、___________ 、H+、Cl-、___________ 、OH-七种。
(2)久置的氯水变为___________ ,原因是___________ (用化学反应方程式表示);实验室保存饱和氯水的方法是___________ 。
(3)b过程中的离子方程式是___________ 。
(4)e过程中所发生的主要反应的化学方程式为___________ 。
(5)能证明氯水具有漂白性的是___________ (填“a”、“b”、“c”或“d”)。

(1)氯水中含有的粒子有H2O、Cl2、
(2)久置的氯水变为
(3)b过程中的离子方程式是
(4)e过程中所发生的主要反应的化学方程式为
(5)能证明氯水具有漂白性的是
您最近一年使用:0次
20-21高一上·北京丰台·期末
5 . 工业尾气中的氯气有多种处理方法。
(1)处理尾气中少量氯气的方法如图所示。
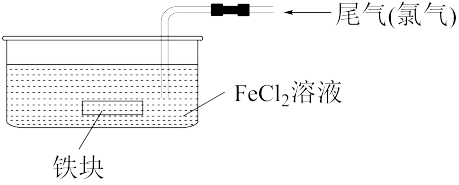
①处理过程中,发生反应的离子方程式为_______ 。
②为维持处理过程的持续进行,需要定期加入的物质是_______ 。
(2)大量氯气可用NaOH溶液处理,标准状况下,处理11.2L Cl2转移电子的物质的量为_______ mol。
(1)处理尾气中少量氯气的方法如图所示。

①处理过程中,发生反应的离子方程式为
②为维持处理过程的持续进行,需要定期加入的物质是
(2)大量氯气可用NaOH溶液处理,标准状况下,处理11.2L Cl2转移电子的物质的量为
您最近一年使用:0次
解题方法
6 . 将一定量的 通入体积为40mL的氢氧化钾溶液中,两者恰好完全反应,测得反应后溶液中有三种含氯元素的离子,其中
通入体积为40mL的氢氧化钾溶液中,两者恰好完全反应,测得反应后溶液中有三种含氯元素的离子,其中 的物质的量为0.06mol,
的物质的量为0.06mol, 的物质的量为0.03mol,请按要求回答下列问题。
的物质的量为0.03mol,请按要求回答下列问题。
(1)该反应的化学方程式为________________________________________________ 。
(2)该反应中,氧化剂与还原剂的物质的量之比为____________ 。
(3)上述反应中,通入 的物质的量为
的物质的量为____________ mol,氢氧化钾溶液的物质的量浓度为__________
mol/L。
 通入体积为40mL的氢氧化钾溶液中,两者恰好完全反应,测得反应后溶液中有三种含氯元素的离子,其中
通入体积为40mL的氢氧化钾溶液中,两者恰好完全反应,测得反应后溶液中有三种含氯元素的离子,其中 的物质的量为0.06mol,
的物质的量为0.06mol, 的物质的量为0.03mol,请按要求回答下列问题。
的物质的量为0.03mol,请按要求回答下列问题。(1)该反应的化学方程式为
(2)该反应中,氧化剂与还原剂的物质的量之比为
(3)上述反应中,通入
 的物质的量为
的物质的量为mol/L。
您最近一年使用:0次
20-21高一上·北京海淀·期中
名校
7 . Cl2是一种重整的化工原料,在生产、生活和工业上均有很多用途。
(1)可与氢气化合制得盐酸。化学方程式为________________ 。
(2)可与NaOH溶液反应制得漂白液(84消毒液),离子方程式为_______________ 。
(3)可用于工业上制得高锰酸钾(KMnO4),KMnO4中Mn的化合价为_______________ 。其工业制备的部分工艺如下:
Ⅰ.将软锰矿(主要成分为MnO2)粉碎后,与KOH固体混合,通入氯气充分焙烧,生成暗绿色熔融态物质。
Ⅱ.冷却,将固体研细,用稀KOH溶液慢取,过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入CO2,溶液变为紫红色,同时生成黑色固体。
Ⅳ.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得KMnO4固体。
资料: K2MnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液源中易发生歧化反应(Mn的化合价既升高又降低)。
①Ⅰ中,粉碎软锰矿的目的是_____________ 。
②Ⅰ中,生成K2MnO4的化学方程式是____________ 。
③Ⅱ中,浸取时用稀KOH溶液的原因是_____________ 。
④Ⅲ中,CO2和K2MnO4在溶液中反应的离子方程式是:MnO +CO2 +H2O→MnO
+CO2 +H2O→MnO +MnO2 +HCO
+MnO2 +HCO (未配平),氧化产物和还原产物的物质的量之比为
(未配平),氧化产物和还原产物的物质的量之比为____________ 。
(1)可与氢气化合制得盐酸。化学方程式为
(2)可与NaOH溶液反应制得漂白液(84消毒液),离子方程式为
(3)可用于工业上制得高锰酸钾(KMnO4),KMnO4中Mn的化合价为
Ⅰ.将软锰矿(主要成分为MnO2)粉碎后,与KOH固体混合,通入氯气充分焙烧,生成暗绿色熔融态物质。
Ⅱ.冷却,将固体研细,用稀KOH溶液慢取,过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入CO2,溶液变为紫红色,同时生成黑色固体。
Ⅳ.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得KMnO4固体。
资料: K2MnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液源中易发生歧化反应(Mn的化合价既升高又降低)。
①Ⅰ中,粉碎软锰矿的目的是
②Ⅰ中,生成K2MnO4的化学方程式是
③Ⅱ中,浸取时用稀KOH溶液的原因是
④Ⅲ中,CO2和K2MnO4在溶液中反应的离子方程式是:MnO
 +CO2 +H2O→MnO
+CO2 +H2O→MnO +MnO2 +HCO
+MnO2 +HCO (未配平),氧化产物和还原产物的物质的量之比为
(未配平),氧化产物和还原产物的物质的量之比为
您最近一年使用:0次
解题方法
8 . Ⅰ.NaClO是“84”消毒液的有效成分。请回答下列问题:
(1)NaClO中Cl元素的化合价是________ 。
(2)浸泡衣物时加入“84”消毒液,在空气中放置一段时间后漂白效果更好,结合离子方程式解释原因:_______________ 。(已知酸性: )
)
(3)若将“84”消毒液与洁厕灵(主要成分是HCl)混合使用,会产生黄绿色的有毒气体,其反应的离子方程式是____________________ 。
Ⅱ. 是一种有毒气体,如果泄漏会造成严重的危害。
是一种有毒气体,如果泄漏会造成严重的危害。
(1)已知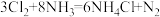 ,化工厂可用浓氨水来检验
,化工厂可用浓氨水来检验 是否泄漏。该反应中被氧化和未被氧化的
是否泄漏。该反应中被氧化和未被氧化的 分子的个数比为
分子的个数比为______________ 。
(2)喷射石灰乳等碱性物质可以减轻少量 泄漏造成的危害。
泄漏造成的危害。 和石灰乳反应的化学方程式是
和石灰乳反应的化学方程式是__________________ 。
(3)实验室常用烧碱溶液吸收 。若将
。若将 通入热的烧碱溶液中,可以得到NaCl、NaClO和
通入热的烧碱溶液中,可以得到NaCl、NaClO和 的混合液。当混合液中
的混合液。当混合液中 和
和 的个数比为15∶2时,混合液中
的个数比为15∶2时,混合液中 和
和 的个数比为
的个数比为_______________ 。
(1)NaClO中Cl元素的化合价是
(2)浸泡衣物时加入“84”消毒液,在空气中放置一段时间后漂白效果更好,结合离子方程式解释原因:
 )
)(3)若将“84”消毒液与洁厕灵(主要成分是HCl)混合使用,会产生黄绿色的有毒气体,其反应的离子方程式是
Ⅱ.
 是一种有毒气体,如果泄漏会造成严重的危害。
是一种有毒气体,如果泄漏会造成严重的危害。(1)已知
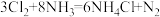 ,化工厂可用浓氨水来检验
,化工厂可用浓氨水来检验 是否泄漏。该反应中被氧化和未被氧化的
是否泄漏。该反应中被氧化和未被氧化的 分子的个数比为
分子的个数比为(2)喷射石灰乳等碱性物质可以减轻少量
 泄漏造成的危害。
泄漏造成的危害。 和石灰乳反应的化学方程式是
和石灰乳反应的化学方程式是(3)实验室常用烧碱溶液吸收
 。若将
。若将 通入热的烧碱溶液中,可以得到NaCl、NaClO和
通入热的烧碱溶液中,可以得到NaCl、NaClO和 的混合液。当混合液中
的混合液。当混合液中 和
和 的个数比为15∶2时,混合液中
的个数比为15∶2时,混合液中 和
和 的个数比为
的个数比为
您最近一年使用:0次
2020-10-02更新
|
984次组卷
|
6卷引用:人教版(2019)高一必修第一册 第二章 海水中的重要元素 第二节 氯及其化合物 作业帮
人教版(2019)高一必修第一册 第二章 海水中的重要元素 第二节 氯及其化合物 作业帮高一必修第一册(苏教2019)专题3 第一单元 氯气及氯的化合物4(已下线)【浙江新东方】34吉林省吉林市永吉县第四中学2022-2023学年高一上学期期中考试化学试题(已下线)题型43 次氯酸、氯的含氧酸盐的性质和应用课时1 氯气的性质
名校
解题方法
9 . 利用如图所示的“价-类”二维图,可以从不同角度认识含氯元素的物质的性质及其转化关系,图中甲~辛均为含氯元素的物质。回答下列问题:
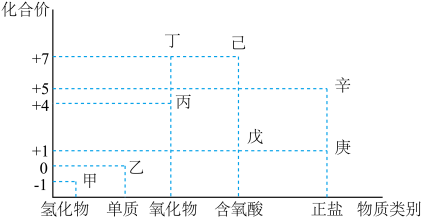
(1)丙的化学式为_____________ ;丁的化学式为_____________ 。
(2)甲、乙、丁、戊中,属于电解质的是__________________________ (填化学式);根据氯元素的化合价判断,乙____________________ (填标号)。
a.只有氧化性 b.既有氧化性又有还原性
c.只有还原性 d.既能作氧化剂又能作还原剂
(3)庚是漂白粉的有效成分,用乙制取漂白粉的化学方程式为____________________________ 。
(4)辛在 催化下受热分解可制备一种常见的气体,这种气体的化学式是
催化下受热分解可制备一种常见的气体,这种气体的化学式是______________ 。

(1)丙的化学式为
(2)甲、乙、丁、戊中,属于电解质的是
a.只有氧化性 b.既有氧化性又有还原性
c.只有还原性 d.既能作氧化剂又能作还原剂
(3)庚是漂白粉的有效成分,用乙制取漂白粉的化学方程式为
(4)辛在
 催化下受热分解可制备一种常见的气体,这种气体的化学式是
催化下受热分解可制备一种常见的气体,这种气体的化学式是
您最近一年使用:0次
2020-10-02更新
|
507次组卷
|
2卷引用:人教版(2019)高一必修第一册 第二章 海水中的重要元素 第二节 氯及其化合物 作业帮
解题方法
10 . 消毒液在我们H常生活中必不可少,请结合相关知识回答下列问题。
(1)生产消毒液是将氯气通入 溶液中,发生反应的化学方程式为
溶液中,发生反应的化学方程式为________________________ 。
(2)取少量消毒液滴加 溶液,现象是出现白色沉淀,说明消毒液中有
溶液,现象是出现白色沉淀,说明消毒液中有________ 离子。
(3)消毒液稀释后喷洒在空气中,可以生成有漂白性的物质,请写出此过程的化学方程式:__________________________ ;该物质有漂白性是因为它有强氧化性,但是它也很不稳定,请写出它分解的化学方程式:_____________________ 。
(1)生产消毒液是将氯气通入
 溶液中,发生反应的化学方程式为
溶液中,发生反应的化学方程式为(2)取少量消毒液滴加
 溶液,现象是出现白色沉淀,说明消毒液中有
溶液,现象是出现白色沉淀,说明消毒液中有(3)消毒液稀释后喷洒在空气中,可以生成有漂白性的物质,请写出此过程的化学方程式:
您最近一年使用:0次



