名校
1 . 钠、氯及其化合物有如图转化关系,淡黄色物质M可在潜水艇中作为氧气的来源,常被用作供氧剂,常用N来杀菌消毒。请按要求填空:
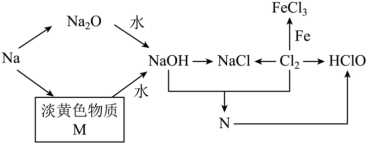
(1)淡黄色物质M是__________ ,物质N是__________ (填化学式)。
(2)写出M与水反应的化学方程式为__________ ,氧化剂为__________ ,还原剂为__________ 。
(3)请描述一小块金属钠投入 溶液中的现象:
溶液中的现象:__________ 。
(4) 与
与 反应的化学反应方程式为
反应的化学反应方程式为__________ 。
(5)除去下列括号中少量杂质,写出相关化学方程式或离子方程式:
①除去 固体混有
固体混有 的化学方程式:
的化学方程式:__________ 。
②除去 溶液中混有
溶液中混有 的离子方程式:
的离子方程式:__________ 。

(1)淡黄色物质M是
(2)写出M与水反应的化学方程式为
(3)请描述一小块金属钠投入
 溶液中的现象:
溶液中的现象:(4)
 与
与 反应的化学反应方程式为
反应的化学反应方程式为(5)除去下列括号中少量杂质,写出相关化学方程式或离子方程式:
①除去
 固体混有
固体混有 的化学方程式:
的化学方程式:②除去
 溶液中混有
溶液中混有 的离子方程式:
的离子方程式:
您最近一年使用:0次
名校
解题方法
2 . 某学习小组的同学用MnO2和浓盐酸反应来制备纯净的氯气并验证其有无漂白性,设计装置如图:

(1)A装置中反应的化学方程式:____________________________ ;D装置中现象:___________________ ;该套装置存在的缺陷:_________________________________ 。
(2)取少量E装置中溶液与洁厕灵(含盐酸)混合产生有毒气体,原因是_______________________ (用离子方程式表示)。
(3)若将Cl2通入热的烧碱溶液中,可以发生如下两个反应:
Cl2+2NaOH=NaCl+NaClO+H2O和3Cl2+6NaOH=5NaCl+NaClO3+3H2O。
从氧化还原角度分析Cl2表现了_______________ 。当混合液中Cl-和ClO 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为__________________ 。
(4)近年来,随着化学工业的快速发展,氯气的需求迅速增加。下图是制备氯气的原理示意图,其反应物是___________ ,CuO的作用是_____________ ,写出总反应的化学方程式,并用单线桥法标出该反应的电子转移情况______________________________ 。
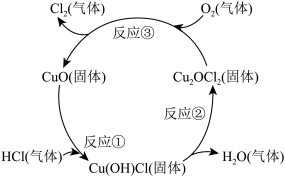

(1)A装置中反应的化学方程式:
(2)取少量E装置中溶液与洁厕灵(含盐酸)混合产生有毒气体,原因是
(3)若将Cl2通入热的烧碱溶液中,可以发生如下两个反应:
Cl2+2NaOH=NaCl+NaClO+H2O和3Cl2+6NaOH=5NaCl+NaClO3+3H2O。
从氧化还原角度分析Cl2表现了
 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为(4)近年来,随着化学工业的快速发展,氯气的需求迅速增加。下图是制备氯气的原理示意图,其反应物是

您最近一年使用:0次
2022-12-14更新
|
395次组卷
|
3卷引用:湖南省衡阳县第五中学2022-2023学年高一上学期期末考试化学试题
解题方法
3 . 氯气(液氯)、漂白粉、“84”消毒液等都是含氯消毒剂。已知:在酸性条件下,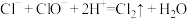 。
。
(1)工业上用电解饱和食盐水的方法制取氯气,实验室中可以用二氧化锰或高锰酸钾与浓盐酸反应制取氯气。
①写出二氧化锰与浓盐酸反应制取氯气的离子方程式:___________ ,该反应中氧化剂为,每生成7.1g气体反应中转移的电子的物质的量为___________ mol。
② 与浓盐酸的反应为
与浓盐酸的反应为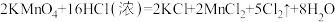 ,用
,用 和
和 分别与浓盐酸制备等量的氯气,消耗的
分别与浓盐酸制备等量的氯气,消耗的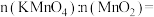
___________ 。
(2)由于氯气不便于保存,生活中常用的含氯消毒剂是漂白粉或“84”消毒液。
①常温下,将氯气通入NaOH溶液中,可以制得“84”消毒液,写出发生反应的离子方程式:___________ ,该消毒液的有效成分是___________ (填化学式)。生活中“84”消毒液和洁厕灵(主要成分是稀盐酸)不能混合使用,原因是___________ 。
②将氯气通入石灰乳(主要成分是氢氧化钙)中可以制得漂白粉,漂白粉的主要成分为___________ (填化学式)。漂白粉长时间暴露在空气中会变质,请结合化学方程式解释其原因:___________ 。
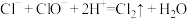 。
。(1)工业上用电解饱和食盐水的方法制取氯气,实验室中可以用二氧化锰或高锰酸钾与浓盐酸反应制取氯气。
①写出二氧化锰与浓盐酸反应制取氯气的离子方程式:
②
 与浓盐酸的反应为
与浓盐酸的反应为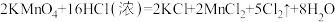 ,用
,用 和
和 分别与浓盐酸制备等量的氯气,消耗的
分别与浓盐酸制备等量的氯气,消耗的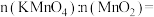
(2)由于氯气不便于保存,生活中常用的含氯消毒剂是漂白粉或“84”消毒液。
①常温下,将氯气通入NaOH溶液中,可以制得“84”消毒液,写出发生反应的离子方程式:
②将氯气通入石灰乳(主要成分是氢氧化钙)中可以制得漂白粉,漂白粉的主要成分为
您最近一年使用:0次
名校
4 . NaCN超标的电镀废水可用两段氧化法处理:
a.NaCN与NaClO反应,生成NaOCN和NaCl
b.NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×10-10)有剧毒;HCN、HOCN中N元素的化合价相同。
完成下列填空:
(1)第一次氧化时,溶液的pH应调节为___________ (选填“酸性”、“碱性”或“中性”);原因是___________ 。
(2)写出第二次氧化时发生反应的离子方程式。___________
(3)(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成___________ 、___________ 和H2O。
a.NaCN与NaClO反应,生成NaOCN和NaCl
b.NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×10-10)有剧毒;HCN、HOCN中N元素的化合价相同。
完成下列填空:
(1)第一次氧化时,溶液的pH应调节为
(2)写出第二次氧化时发生反应的离子方程式。
(3)(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成
您最近一年使用:0次
2021-11-09更新
|
49次组卷
|
2卷引用:湖南省邵阳市邵东县第三中学2021--2022届高三上学期期中考试化学试题
名校
5 . 常温下将Cl2缓慢通入水中至饱和,然后改向其中滴加浓NaOH溶液至恰好完全反应。上述整个实验过程中溶液的pH变化曲线如图所示(不考虑次氯酸的分解以及溶液体积的变化)。
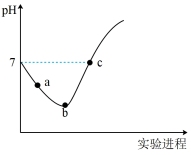
①请对图中pH的整个变化趋势作出解释(用离子方程式表示)________ 。
②写出b点对应溶液中的电荷守恒式___________ 。并且比较c(HClO) :a点___________ b点;c(Cl–):b点___________ c点(填>、<或=)
③Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为___________ 。
④ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1mol ClO2消耗NaClO2的量为______ mol; 产生“气泡”的化学方程式为____ 。
⑤“84消毒液“的有效成分为NaClO,不可与酸性清洁剂混用的原因是___________ (用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000kg该溶液需消耗氯气的质量为 ___________ kg(保留整数)。

①请对图中pH的整个变化趋势作出解释(用离子方程式表示)
②写出b点对应溶液中的电荷守恒式
③Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为
④ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1mol ClO2消耗NaClO2的量为
⑤“84消毒液“的有效成分为NaClO,不可与酸性清洁剂混用的原因是
您最近一年使用:0次
2021-01-03更新
|
182次组卷
|
3卷引用:湖南省攸县长鸿实验中学2022-2023学年高三第四次月考化学试题
解题方法
6 . “84消毒液”是日常生活中常用的消毒液,在抗击新冠肺炎中广泛应用。
(1)“84消毒液”的有效成分为________ ;
(2)“84消毒液”与适量硫酸混合使用可增强消毒能力,某消毒组成员欲用盐酸代替硫酸,是否可行_________ (填“是"或“否”),原因是_____________ ;
(3)Cl2是最早用于饮用水消毒的物质,ClO2是一种广谱消毒剂,等质量的Cl2和ClO2消毒效率高的是________ (填化学式);工业上ClO2常用NaClO3和Na2SO3溶液混合酸化反应制得,反应中NaClO3和Na2SO3的物质的量之比为__________ 。
(1)“84消毒液”的有效成分为
(2)“84消毒液”与适量硫酸混合使用可增强消毒能力,某消毒组成员欲用盐酸代替硫酸,是否可行
(3)Cl2是最早用于饮用水消毒的物质,ClO2是一种广谱消毒剂,等质量的Cl2和ClO2消毒效率高的是
您最近一年使用:0次
名校
7 . Ⅰ.NaClO是“84”消毒液的有效成分。请回答下列问题。
(1)NaClO中Cl元素的化合价是__ 。
(2)浸泡衣物时加入“84”消毒液在空气中放置一段时间漂白效果更好,结合离子方程式解释原因:__ 。
(已知酸性:H2CO3>HClO>HCO3-)。
(3)若将“84”消毒液与洁厕灵(主要成分是盐酸)混合使用,则会产生黄绿色的有毒气体,其反应的离子方程式是:__ 。
Ⅱ.Cl2是一种有毒气体,如果泄漏会造成严重的危害。
(4)已知:3Cl2+8NH3=6NH4Cl+N2,化工厂可用浓氨水来检验Cl2是否泄漏。该反应中氧化剂和还原剂的物质的量比为__ 。
(5)喷射石灰乳等碱性物质可以减轻少量Cl2泄漏造成的危害。Cl2和石灰乳反应的化学方程式是__ 。
(6)实验室常用烧碱溶液吸收Cl2。若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合液。当NaCl和NaClO3的物质的量之比为15:2时,混合液中NaClO和NaClO3的物质的量之比为___ 。
(1)NaClO中Cl元素的化合价是
(2)浸泡衣物时加入“84”消毒液在空气中放置一段时间漂白效果更好,结合离子方程式解释原因:
(已知酸性:H2CO3>HClO>HCO3-)。
(3)若将“84”消毒液与洁厕灵(主要成分是盐酸)混合使用,则会产生黄绿色的有毒气体,其反应的离子方程式是:
Ⅱ.Cl2是一种有毒气体,如果泄漏会造成严重的危害。
(4)已知:3Cl2+8NH3=6NH4Cl+N2,化工厂可用浓氨水来检验Cl2是否泄漏。该反应中氧化剂和还原剂的物质的量比为
(5)喷射石灰乳等碱性物质可以减轻少量Cl2泄漏造成的危害。Cl2和石灰乳反应的化学方程式是
(6)实验室常用烧碱溶液吸收Cl2。若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合液。当NaCl和NaClO3的物质的量之比为15:2时,混合液中NaClO和NaClO3的物质的量之比为
您最近一年使用:0次
名校
解题方法
8 . 化学与人类生活密切相关。请按要求,回答下列问题:
(1)宇航员常用过氧化钠作供氧剂,写出对应反应的化学方程__ 、__ 。
(2)新制氯水在阳光照射下容易分解产生无色气体,该反应的化学方程式是__ 。
工业上将氯气通入冷的消石灰制成漂白粉,写出该反应的化学方程式并用双线桥法表示电子转移的方向和数目的__ 。
(3)KAl(SO4)2·12H2O因其溶于水生成__ (化学式)胶体可以吸附杂质,从而达到净水的目的。
(4)K2FeO4是一种重要的净水剂,可用下列方法制得:2Fe(OH)3+3Cl2+10KOH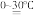 2K2FeO4+6KCl+8H2O。在该反应中,还原剂是
2K2FeO4+6KCl+8H2O。在该反应中,还原剂是__ ,当反应中有1molK2FeO4生成时,消耗的Cl2在标准状况下的体积为__ L,转移电子的数目为__ 。
(1)宇航员常用过氧化钠作供氧剂,写出对应反应的化学方程
(2)新制氯水在阳光照射下容易分解产生无色气体,该反应的化学方程式是
工业上将氯气通入冷的消石灰制成漂白粉,写出该反应的化学方程式并用双线桥法表示电子转移的方向和数目的
(3)KAl(SO4)2·12H2O因其溶于水生成
(4)K2FeO4是一种重要的净水剂,可用下列方法制得:2Fe(OH)3+3Cl2+10KOH
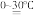 2K2FeO4+6KCl+8H2O。在该反应中,还原剂是
2K2FeO4+6KCl+8H2O。在该反应中,还原剂是
您最近一年使用:0次
2020-02-21更新
|
193次组卷
|
2卷引用:湖南师大附中2019-2020学年高一上期期末考试化学试题
9 . (1)实验室制氯气的尾气处理用_____ 溶液吸收,其化学反应方程式为_____ 。
(2)向AlCl3溶液中逐滴加入NaOH溶液,现象是先产生白色沉淀,其反应的离子方程式为_____ ,后白色沉淀又溶解消失,其反应的离子方程式为_____ 。
(3)在含有0.2mol的硫酸和0.2mol的硝酸的混合溶液200mL中,加入19.2g铜粉,产生的气体成分为_____ (填NO或H2),你所选气体在标准状况下的体积为_____ L
(2)向AlCl3溶液中逐滴加入NaOH溶液,现象是先产生白色沉淀,其反应的离子方程式为
(3)在含有0.2mol的硫酸和0.2mol的硝酸的混合溶液200mL中,加入19.2g铜粉,产生的气体成分为
您最近一年使用:0次



