1 . 现有下列物质(括号内为对应物质的主要成分):a.熔融NaOH;b.医用酒精;c.蔗糖晶体;d.加碘盐(NaCl和KIO3);e.“84”消毒液(NaClO);f.小苏打(NaHCO3);g.洁厕灵(HCl),回答下列问题:
(1)上述状态下的物质中,属于电解质且能导电的是_______ (填字母,下同);d和f均为厨房中的常用物质,可用于区分两者的物质是________ 。
(2)生活中若将“84”消毒液和洁厕灵混合易产生黄绿色有毒气体,写出该反应的离子方程式:________ 。
(3)碘酸钾(KIO3)可作为食盐中的补碘剂。一种制备KIO3的方法是将I2与KOH溶液共热,生成KIO3、H2O和另—种化合物,写出该反应的化学方程式:___________ ;该反应中被氧化的Ⅰ原子与被还原的Ⅰ原子的个数之比为___________ 。
(4)二氧化氯泡腾片(有效成分为NaClO2和NaHSO4)也是一种用途广泛的消毒用品,将1片(规格为1g/片)二氧化氯泡腾片溶于1L水中,得到ClO2溶液(假设ClO2全部溶于水且反应后溶液体积仍为1L)。补全生成ClO2的化学方程式:_____ ,__NaClO2+__NaHSO4=___ClO2+___NaCl+__Na2SO4+____H2O;若每片泡腾片中NaClO2的质量分数≥17%为合格品,上述所得ClO2溶液的物质的量浓度为0.002mol/L,则所用泡腾片____ (填“属于”或“不属于”)合格品。
(1)上述状态下的物质中,属于电解质且能导电的是
(2)生活中若将“84”消毒液和洁厕灵混合易产生黄绿色有毒气体,写出该反应的离子方程式:
(3)碘酸钾(KIO3)可作为食盐中的补碘剂。一种制备KIO3的方法是将I2与KOH溶液共热,生成KIO3、H2O和另—种化合物,写出该反应的化学方程式:
(4)二氧化氯泡腾片(有效成分为NaClO2和NaHSO4)也是一种用途广泛的消毒用品,将1片(规格为1g/片)二氧化氯泡腾片溶于1L水中,得到ClO2溶液(假设ClO2全部溶于水且反应后溶液体积仍为1L)。补全生成ClO2的化学方程式:
您最近一年使用:0次
名校
2 . “84”消毒液是生活中常见的一种消毒剂,常用于环境的消毒,其主要成分是NaClO。
(1)“84”消毒液使用时除了要按一定比例稀释,对消毒时间也有要求,一般在10~20分钟左右、用化学方程式解释原因:___________ 。
(2)次氯酸钠可以用于去除废水中的铵态氮,配平下列离子方程式:___________ 。
 。
。
(3)“84”消毒液的制取和漂粉精的制取原理相同,请写出该反应的离子方程式:___________ 。
(4)消毒学专家指出,将“84”消毒液与洁厕灵(主要成分:浓盐酸)一起合并使用,可能会对使用者的呼吸道造成伤害。请用离子方程式分析可能的原因:___________ 。
(5)已知某市售84消毒液瓶体部分标签如图所示,该84消毒液通常稀释100倍(体积之比)后使用。请回答下列问题:
①该“84”消毒液中NaClO的物质的量浓度约为___________ mol/L。(保留1位小数)
②“84”消毒液与稀硫酸混合使用可增强其消毒能力,某消毒小组人员用18.4mol/L的浓硫酸配制480mL2.3mol/L的稀硫酸用于增强84消毒液的消毒能力,则配置时需用浓硫酸的体积为___________ mL。
③在配制稀硫酸过程中不需要用到的仪器有___________ 。
A.玻璃棒 B.托盘天平 C.烧杯 D.量筒 E.容量瓶 F.漏斗
④配制该稀硫酸过程中,下列情况会使所配制的溶液的浓度大于2.3mol/L的有___________ 。
A.未经冷却趁热将溶液注入容量瓶中并进行定容
B.摇匀后发现液面低于刻度线,再加水至刻度线
C.容量瓶中原有少量蒸馏水
D.定容时俯视容量瓶刻度线
(1)“84”消毒液使用时除了要按一定比例稀释,对消毒时间也有要求,一般在10~20分钟左右、用化学方程式解释原因:
(2)次氯酸钠可以用于去除废水中的铵态氮,配平下列离子方程式:
 。
。(3)“84”消毒液的制取和漂粉精的制取原理相同,请写出该反应的离子方程式:
(4)消毒学专家指出,将“84”消毒液与洁厕灵(主要成分:浓盐酸)一起合并使用,可能会对使用者的呼吸道造成伤害。请用离子方程式分析可能的原因:
(5)已知某市售84消毒液瓶体部分标签如图所示,该84消毒液通常稀释100倍(体积之比)后使用。请回答下列问题:
| 84消毒液 [有效成分]NaClO [规格]1000mL [质量分数]25% [密度] 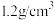 |
②“84”消毒液与稀硫酸混合使用可增强其消毒能力,某消毒小组人员用18.4mol/L的浓硫酸配制480mL2.3mol/L的稀硫酸用于增强84消毒液的消毒能力,则配置时需用浓硫酸的体积为
③在配制稀硫酸过程中不需要用到的仪器有
A.玻璃棒 B.托盘天平 C.烧杯 D.量筒 E.容量瓶 F.漏斗
④配制该稀硫酸过程中,下列情况会使所配制的溶液的浓度大于2.3mol/L的有
A.未经冷却趁热将溶液注入容量瓶中并进行定容
B.摇匀后发现液面低于刻度线,再加水至刻度线
C.容量瓶中原有少量蒸馏水
D.定容时俯视容量瓶刻度线
您最近一年使用:0次
2023-11-29更新
|
235次组卷
|
2卷引用:黑龙江省实验中学2023-2024学年高一上学期第二次阶段测试化学试题
名校
解题方法
3 . 回答下列问题:
(1)NaClO中Cl的化合价为_______ ,NaClO具有较强的_______ (填“氧化”或“还原”)性,是常用的消毒剂和漂白剂的有效成分。
(2)9.03×1023个CO2的物质的量是_______ ,在标准状况下的体积为_______ 。
(3)质量比为11:7:16的CO2、CO、O2,其物质的量之比为_______ ,所含氧原子数之比为_______ 。
(4)某盐混合溶液中含有离子:Na+、Mg2+、Cl-、SO ,测得Na+、Mg2+、Cl-的物质的量浓度依次为:0.2mol·L-1、0.25mol·L-1、0.4mol·L-1,则c(SO
,测得Na+、Mg2+、Cl-的物质的量浓度依次为:0.2mol·L-1、0.25mol·L-1、0.4mol·L-1,则c(SO )=
)=_______ 。
(5)漂白液、漂白粉和漂粉精既可作棉、麻、纸张的漂白剂,又可用作环境消毒剂。工业生产漂白粉的化学方程式为_______ 。
(6)FeCl2溶液通入氯气的反应,用离子方程式表示_______ 。
(7)将烧至红热的铁丝伸到盛有氯气的集气瓶中,可观察到铁丝剧烈燃烧,产生棕黄色的烟,反应的化学方程式为_______ ,该反应中被还原的物质是_______ (填化学式)。
(1)NaClO中Cl的化合价为
(2)9.03×1023个CO2的物质的量是
(3)质量比为11:7:16的CO2、CO、O2,其物质的量之比为
(4)某盐混合溶液中含有离子:Na+、Mg2+、Cl-、SO
 ,测得Na+、Mg2+、Cl-的物质的量浓度依次为:0.2mol·L-1、0.25mol·L-1、0.4mol·L-1,则c(SO
,测得Na+、Mg2+、Cl-的物质的量浓度依次为:0.2mol·L-1、0.25mol·L-1、0.4mol·L-1,则c(SO )=
)=(5)漂白液、漂白粉和漂粉精既可作棉、麻、纸张的漂白剂,又可用作环境消毒剂。工业生产漂白粉的化学方程式为
(6)FeCl2溶液通入氯气的反应,用离子方程式表示
(7)将烧至红热的铁丝伸到盛有氯气的集气瓶中,可观察到铁丝剧烈燃烧,产生棕黄色的烟,反应的化学方程式为
您最近一年使用:0次
2023-10-05更新
|
258次组卷
|
2卷引用:黑龙江省牡丹江市第一高级中学2022-2023学年高一上学期11月期中考试化学试题
4 . 根据题目信息,按要求完成下列填空:
(1)过氧化钠粉末与水反应的化学方程式:_____ 。
(2)实验室制取氨气(两种固体加热)的化学方程式:_____ 。
(3)二氧化硫通入溴水,可使溴水褪色,写出反应的化学方程式:_____ 。
(4)铜与浓硫酸加热条件下反应的化学方程式:_____ 。
(5)实验室制取氯气,多余的氯气可用氢氧化钠溶液吸收,写出反应的离子方程式:_____ 。
(6)三氟化氮(NF3)是一种无色无味的气体,27.0mLNF3和水充分反应,生成18.0mLNO(同温、同压下),写出反应的化学方程式:_____ 。
(1)过氧化钠粉末与水反应的化学方程式:
(2)实验室制取氨气(两种固体加热)的化学方程式:
(3)二氧化硫通入溴水,可使溴水褪色,写出反应的化学方程式:
(4)铜与浓硫酸加热条件下反应的化学方程式:
(5)实验室制取氯气,多余的氯气可用氢氧化钠溶液吸收,写出反应的离子方程式:
(6)三氟化氮(NF3)是一种无色无味的气体,27.0mLNF3和水充分反应,生成18.0mLNO(同温、同压下),写出反应的化学方程式:
您最近一年使用:0次
名校
解题方法
5 . 钠、氯及其化合物有如图转化关系,淡黄色物质M可在潜水艇中作为氧气的来源,常被用作供氧剂,N常用来杀菌消毒。请按要求填空:
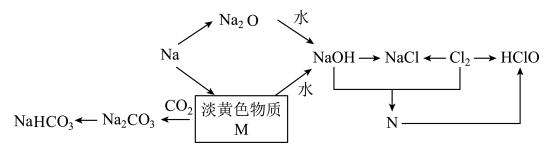
(1)淡黄色物质M是_______ (填化学式),写出M与水反应的离子方程式_______ 。
(2)用加热法可除去 固体中的少量
固体中的少量 ,原理是
,原理是_______ (用化学方程式表示)。
(3)写出图中制备物质N的离子方程式_______ 。
(4)游泳池常用N来抑制藻类生长,工作人员某次错用 消毒,因两种物质相互反应产生了
消毒,因两种物质相互反应产生了 和
和 ,使游泳池的藻类疯长。该反应中氧化剂与还原剂的物质的量之比为
,使游泳池的藻类疯长。该反应中氧化剂与还原剂的物质的量之比为_______ 。

(1)淡黄色物质M是
(2)用加热法可除去
 固体中的少量
固体中的少量 ,原理是
,原理是(3)写出图中制备物质N的离子方程式
(4)游泳池常用N来抑制藻类生长,工作人员某次错用
 消毒,因两种物质相互反应产生了
消毒,因两种物质相互反应产生了 和
和 ,使游泳池的藻类疯长。该反应中氧化剂与还原剂的物质的量之比为
,使游泳池的藻类疯长。该反应中氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
2023-02-21更新
|
159次组卷
|
2卷引用:黑龙江省牡丹江市第二高级中学2023-2024学年高一上学期12月月考化学试题
6 . 含氯化合物在日常生活中有多种用途,根据要求完成下列问题:
(1)漂白粉的有效成分是___________ ,家庭中使用漂白粉加水配置消毒液,与空气发生反应的化学方程式为___________ 。
(2)84消毒液的有效成分中NaClO中Cl的化合价为___________ ,请写出氯气与NaOH反应的化学方程式:___________ 。向NaOH溶液中通入11.2L(标准状况)氯气恰好完全反应生成三种含氯盐:0.7molNaCl、0.2molNaClO和X。则X是___________ 。
a.0.1molNaClO4 b.0.1molNaClO3 c.0.2molNaClO2 d.0.1molNaClO2
(3)日常生活中84消毒液若与洁厕灵(较浓的盐酸)混用,发生反应:NaClO+2HCl=NaCl+Cl2+H2O,该反应的氧化剂为___________ ,被氧化的物质为___________ 。若反应中电子转移为2mol,生成的氯气为___________ mol。
(1)漂白粉的有效成分是
(2)84消毒液的有效成分中NaClO中Cl的化合价为
a.0.1molNaClO4 b.0.1molNaClO3 c.0.2molNaClO2 d.0.1molNaClO2
(3)日常生活中84消毒液若与洁厕灵(较浓的盐酸)混用,发生反应:NaClO+2HCl=NaCl+Cl2+H2O,该反应的氧化剂为
您最近一年使用:0次
名校
7 .  和浓盐酸在一定温度下反应,会生成橙黄色的易爆物二氧化氯
和浓盐酸在一定温度下反应,会生成橙黄色的易爆物二氧化氯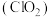 气体,该反应的化学方程式为
气体,该反应的化学方程式为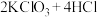 (浓)
(浓) 。
。
(1)该反应的氧化剂是___________ 还原产物是___________ (化学式)。氧化性
___________  (填< > =)。
(填< > =)。
(2)用双线桥在方程式中标出电子转移的情况:___________
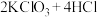 (浓)
(浓) 。
。
(3)以上反应中盐酸具有的性质是___________(填序号)。
(4)当发生二氧化氯泄漏和爆炸事故,人们逃离爆炸现场时,可用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的物质是___________(填序号)。
 和浓盐酸在一定温度下反应,会生成橙黄色的易爆物二氧化氯
和浓盐酸在一定温度下反应,会生成橙黄色的易爆物二氧化氯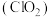 气体,该反应的化学方程式为
气体,该反应的化学方程式为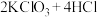 (浓)
(浓) 。
。(1)该反应的氧化剂是

 (填< > =)。
(填< > =)。(2)用双线桥在方程式中标出电子转移的情况:
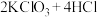 (浓)
(浓) 。
。(3)以上反应中盐酸具有的性质是___________(填序号)。
| A.只有还原性 | B.只有氧化性 |
| C.还原性和酸性 | D.氧化性和还原性,还有酸性 |
| A.NaOH | B.NaCl | C.KCl | D. |
您最近一年使用:0次
2021-10-22更新
|
415次组卷
|
2卷引用:黑龙江省哈尔滨市第六中学2021-2022学年高一上学期10月月考化学试题
名校
解题方法
8 . (1)向Fe(OH)3胶体中逐滴加入氢碘酸。
现象:____________________________________________________________
离子方程式:________________________________________________
(2)将Cl2通入NaOH溶液,充分反应后测得溶液中ClO-与ClO 个数比为3:1,则被氧化与被还原的氯元素质量比为
个数比为3:1,则被氧化与被还原的氯元素质量比为_________ ;离子方程式为_________________________________ 。
(3)H2与Cl2混合点燃,充分反应后,将气体通入含有40gNaOH的溶液中恰好完全反应,则混合气体中Cl2质量为________ 。
(4)向FeBr2溶液中通入一定量的Cl2,充分反应后,测得游离态的溴元素和化合态的溴元素质量比为1:1,写出反应的离子方程式________________________________________________ 。
现象:
离子方程式:
(2)将Cl2通入NaOH溶液,充分反应后测得溶液中ClO-与ClO
 个数比为3:1,则被氧化与被还原的氯元素质量比为
个数比为3:1,则被氧化与被还原的氯元素质量比为(3)H2与Cl2混合点燃,充分反应后,将气体通入含有40gNaOH的溶液中恰好完全反应,则混合气体中Cl2质量为
(4)向FeBr2溶液中通入一定量的Cl2,充分反应后,测得游离态的溴元素和化合态的溴元素质量比为1:1,写出反应的离子方程式
您最近一年使用:0次
2020-11-16更新
|
118次组卷
|
2卷引用:黑龙江省大庆外国语学校2021-2022学年高一下学期开学考试化学试题
9 . 按要求写出化学方程式或离子方程式
(1)碳酸氢钠溶液与氢氧化钠溶液反应的离子方程式_________ 。
(2)氢氧化钙溶液与过量碳酸氢钠溶液反应的离子方程式_______ 。
(3)钠与硫酸铜溶液反应的化学方程式____________ 。
(4)制漂白粉的原理的化学方程式____________ 。
(1)碳酸氢钠溶液与氢氧化钠溶液反应的离子方程式
(2)氢氧化钙溶液与过量碳酸氢钠溶液反应的离子方程式
(3)钠与硫酸铜溶液反应的化学方程式
(4)制漂白粉的原理的化学方程式
您最近一年使用:0次
名校
10 . (1)常温下,将___ 通入到NaOH溶液中,可获得___ 为有效成分的漂白液(填化学式);
(2)NaHCO3俗名是___ ,常温时,NaHCO3的溶解度___ Na2CO3(填“大于”或“小于”);
(3)配制FeSO4溶液时需加入硫酸抑制水解,还需加入___ 防止Fe2+被氧化成Fe3+;
(4)加热铝箔时,熔化的铝未滴落,是因为氧化铝的熔点___ 铝的熔点(填“高于”或“低于”)。
(2)NaHCO3俗名是
(3)配制FeSO4溶液时需加入硫酸抑制水解,还需加入
(4)加热铝箔时,熔化的铝未滴落,是因为氧化铝的熔点
您最近一年使用:0次
2020-01-14更新
|
314次组卷
|
2卷引用:黑龙江省哈尔滨市第三中学校2019-2020学年高一上学期期末考试化学试题



