名校
1 . Ca(ClO)2、NaClO、FeCl3、Al2O3、Fe2O3、Mn2O7等都是重要的化合物。回答下列问题:
(1)属于酸性氧化物的是______ (填化学式),其相应的钾盐具有_____ (填“强氧化性”或“强还原性”),FeSO4溶液能使该钾盐的酸性溶液褪色,其原因为________ (用离子方程式解释)。
(2)属于“84"消毒液成分的是______ (填化学式),其在空气中易变质,产物之一为碳酸氢钠,写出发生该反应的离子方程式:_______ 。
(3)用覆铜板制作印刷电路板的原理是_______ (用离子方程式表示),检验“腐蚀液”中有无Fe3+的试剂为______ (填化学式)。
(4)将氯气通入冷的_____ (填物质名称)中可制得以Ca(ClO)2为有效成分的漂白粉,该过程中转移2mol电子时,消耗氧化剂与还原剂的质量之比为________ 。
(1)属于酸性氧化物的是
(2)属于“84"消毒液成分的是
(3)用覆铜板制作印刷电路板的原理是
(4)将氯气通入冷的
您最近一年使用:0次
名校
解题方法
2 . 按要求回答下列问题:
(1)对含有K2CO3的样品进行焰色试验,需要准备的仪器和试剂有:铂丝、酒精灯、___________ 和___________ 。
(2)高铁酸钠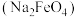 是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理为:
是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理为: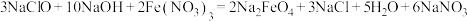 。回答下列问题:
。回答下列问题:
①用氯气制备 的反应原理为
的反应原理为___________ (化学方程式)
②制备高铁酸钠的反应中 体现了
体现了___________ (填“还原性”、“氧化性”或“氧化性和还原性”)
(3)加热13.7g碳酸钠和碳酸氢钠的固体混合物,使碳酸氢钠完全分解,混合物质量减少了3.1g,所得固体与足量盐酸充分反应(假设CO2完全逸出)。计算:
①混合物中Na2CO3和NaHCO3的物质的量之比为___________ 。
②加入足量盐酸充分反应后产生的CO2在标准状况下的体积为___________ L。
(1)对含有K2CO3的样品进行焰色试验,需要准备的仪器和试剂有:铂丝、酒精灯、
(2)高铁酸钠
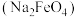 是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理为:
是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理为: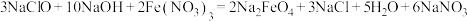 。回答下列问题:
。回答下列问题:①用氯气制备
 的反应原理为
的反应原理为②制备高铁酸钠的反应中
 体现了
体现了(3)加热13.7g碳酸钠和碳酸氢钠的固体混合物,使碳酸氢钠完全分解,混合物质量减少了3.1g,所得固体与足量盐酸充分反应(假设CO2完全逸出)。计算:
①混合物中Na2CO3和NaHCO3的物质的量之比为
②加入足量盐酸充分反应后产生的CO2在标准状况下的体积为
您最近一年使用:0次
名校
3 . 氯气是一种重要的化工原料,在生产生活中具有广泛的应用。
(1)实验室常用二氧化锰和浓盐酸共热的方法制取氯气。根据要求回答下列问题。
①写出实验室制取氯气的化学方程式_______ 。若产生标准状况下4.48 LCl2,则反应过程中被氧化的HCl的物质的量是_______ mol。
②为了防止氯气污染环境,需将剩余氯气通入_______ ,发生的化学反应方程式_______ 。
③实验室还可用高锰酸钾快速地制取氯气,反应的化学方程式如下: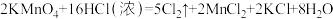 。在此反应中浓盐酸中显示出来的性质是
。在此反应中浓盐酸中显示出来的性质是_______ (填写字母)
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)电解饱和食盐水生产氢气、氯气、氢氧化钠,氯气与石灰乳反应可制取漂白粉。干燥的漂白粉不能发挥漂白效果,请写出漂白粉能发挥漂白效果的化学反应方程式_______ 。
(1)实验室常用二氧化锰和浓盐酸共热的方法制取氯气。根据要求回答下列问题。
①写出实验室制取氯气的化学方程式
②为了防止氯气污染环境,需将剩余氯气通入
③实验室还可用高锰酸钾快速地制取氯气,反应的化学方程式如下:
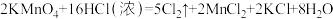 。在此反应中浓盐酸中显示出来的性质是
。在此反应中浓盐酸中显示出来的性质是A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)电解饱和食盐水生产氢气、氯气、氢氧化钠,氯气与石灰乳反应可制取漂白粉。干燥的漂白粉不能发挥漂白效果,请写出漂白粉能发挥漂白效果的化学反应方程式
您最近一年使用:0次
名校
4 . “84消毒液”是一种以NaClO为有效成分的高效消毒剂,在新冠肺炎防治中被广泛用于宾馆、旅游、医院、家庭等的卫生消毒。
Ⅰ.如表为“84”消毒液说明书,请回答下列问题。
(1)常温下用烧碱溶液吸收Cl2制备“84”消毒液。写出该反应的离子方程式___ ,若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合液。当混合液中Cl-和ClO 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为___ ,从氧化还原角度分析Cl2表现了___ 性。
(2)家庭用“84”消毒液用法强调,做家庭物品消毒时,要做适当的稀释,喷洒后也不要急于用清水擦拭,要浸泡,这样效果会更好,原因是___ (用离子方程式表达)。(已知:酸性:H2CO3>HClO>HCO ),家庭消毒马桶时,不可在用洁厕灵(主要成分是盐酸)清洗马桶后,立刻使用“84”消毒液消毒,否则会产生黄绿色的有毒气体,其反应的离子方程式是
),家庭消毒马桶时,不可在用洁厕灵(主要成分是盐酸)清洗马桶后,立刻使用“84”消毒液消毒,否则会产生黄绿色的有毒气体,其反应的离子方程式是___ 。
Ⅱ.某“84消毒液”瓶体部分标签如图1所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
(3)此“84消毒液”的物质的量浓度约为___ mol·L-1。(计算结果保留一位小数)
(4)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL该消毒液。
①如图2所示的仪器中配制溶液需要使用的是___ 。(填仪器序号),还缺少的玻璃仪器是___ 。
②请计算该同学配制此溶液需用托盘天平称量NaClO固体的质量为___ g。
(5)若实验遇下列情况,导致所配溶液的物质的量浓度偏高的是___ (填字号)。
Ⅰ.如表为“84”消毒液说明书,请回答下列问题。
 说明书 | 药品名称 | 84消毒液 |
| 主要成分 | NaClO,有效氯含量50.00g/L~60.00g/L | |
| 注意事项 | 不可与其他洗涤剂或消毒液混合使用 | |
| 用法用量 | 稀释后浸泡或洗刷白色衣物,浴缸等1:200水溶液餐饮具,瓜果等1:100水溶液 |
(1)常温下用烧碱溶液吸收Cl2制备“84”消毒液。写出该反应的离子方程式
 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为(2)家庭用“84”消毒液用法强调,做家庭物品消毒时,要做适当的稀释,喷洒后也不要急于用清水擦拭,要浸泡,这样效果会更好,原因是
 ),家庭消毒马桶时,不可在用洁厕灵(主要成分是盐酸)清洗马桶后,立刻使用“84”消毒液消毒,否则会产生黄绿色的有毒气体,其反应的离子方程式是
),家庭消毒马桶时,不可在用洁厕灵(主要成分是盐酸)清洗马桶后,立刻使用“84”消毒液消毒,否则会产生黄绿色的有毒气体,其反应的离子方程式是Ⅱ.某“84消毒液”瓶体部分标签如图1所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(3)此“84消毒液”的物质的量浓度约为
(4)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL该消毒液。
①如图2所示的仪器中配制溶液需要使用的是
②请计算该同学配制此溶液需用托盘天平称量NaClO固体的质量为
(5)若实验遇下列情况,导致所配溶液的物质的量浓度偏高的是
| A.定容时俯视制度线 | B.转移前,容量瓶内有蒸馏水 |
| C.未冷至室温就转移定容 | D.定容时水多用胶头滴管吸出 |
您最近一年使用:0次
名校
解题方法
5 . 写出下列反应的离子方程式。
(1)硫酸溶液与金属锌的反应___ ;
(2)CuSO4溶液中加入Ba(OH)2溶液___ ;
(3)盐酸溶液与氧化钙的反应___ ;
(4)钠与水的反应___ ;
(5)氯气与NaOH溶液的反应___ ;
(6)CO2通入澄清石灰水使石灰水变浑浊___ 。
(1)硫酸溶液与金属锌的反应
(2)CuSO4溶液中加入Ba(OH)2溶液
(3)盐酸溶液与氧化钙的反应
(4)钠与水的反应
(5)氯气与NaOH溶液的反应
(6)CO2通入澄清石灰水使石灰水变浑浊
您最近一年使用:0次
2021-09-14更新
|
290次组卷
|
2卷引用:江西省南昌市豫章中学20212-2022学年高一下学期第一次月考化学试题
名校
6 . “84消毒液”是日常生活中常用的消毒液,有效成分是NaClO。在抗击新冠肺炎中广泛应用。
(1)用“84”消毒液漂白衣物时,在空气中放置一段时间漂白效果更好,结合离子方程式解释原因_ ;(已知酸性:H2CO3>HClO>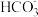 )
)
(2)“84消毒液”与适量醋酸混合使用可增强消毒能力,某消毒组成员欲用盐酸代替醋酸,是否可行__ (填“是”或“否”),原因是________ ;
(3)Cl2是最早用于饮用水消毒的物质,ClO2是一种广谱消毒剂,Cl2和ClO2消毒效率(消毒效率是指单位质量的氧化剂转移电子数,转移电子数越多,消毒效率越高)高的是___ (填化学式),工业上ClO2常用NaClO3和Na2SO3溶液混合酸化反应制得,请写出此过程的离子方程式_____ ;
(4)实验室常用烧碱溶液吸收Cl2,若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合液。当NaCl和NaClO3的物质的量之比为15:2时,混合液中NaClO和NaClO3的物质的量之比为_ ;
(5)已知:3Cl2+8NH3=6NH4Cl+N2,化工厂可用浓氨水来检验Cl2是否泄漏,该反应中被氧化和未被氧化的NH3的物质的量之比为______ 。
(1)用“84”消毒液漂白衣物时,在空气中放置一段时间漂白效果更好,结合离子方程式解释原因
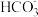 )
)(2)“84消毒液”与适量醋酸混合使用可增强消毒能力,某消毒组成员欲用盐酸代替醋酸,是否可行
(3)Cl2是最早用于饮用水消毒的物质,ClO2是一种广谱消毒剂,Cl2和ClO2消毒效率(消毒效率是指单位质量的氧化剂转移电子数,转移电子数越多,消毒效率越高)高的是
(4)实验室常用烧碱溶液吸收Cl2,若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合液。当NaCl和NaClO3的物质的量之比为15:2时,混合液中NaClO和NaClO3的物质的量之比为
(5)已知:3Cl2+8NH3=6NH4Cl+N2,化工厂可用浓氨水来检验Cl2是否泄漏,该反应中被氧化和未被氧化的NH3的物质的量之比为
您最近一年使用:0次
名校
解题方法
7 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。
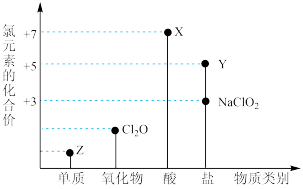
回答下列问题:
(1)X的电离方程式为_________ 。
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=_________ 。
(3) NaClO有较强的氧化性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式_____________ 。
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的___________ 倍(还原产物都为Cl-,消毒效率以单位物质的量得到的电子数表示)。
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为_____________ 。
(6)自来水中的 对人类健康产生危害。为了降低自来水中
对人类健康产生危害。为了降低自来水中 的浓度,某研究人员提出在碱性条件下用Al粉还原
的浓度,某研究人员提出在碱性条件下用Al粉还原 ,产物是N2。发生的反应可表示如下,请完成方程式的配平:
,产物是N2。发生的反应可表示如下,请完成方程式的配平:___ Al+ ____  +
+ _____ =___ 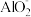 +
+ _____ N2↑ + _______ H2O

回答下列问题:
(1)X的电离方程式为
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=
(3) NaClO有较强的氧化性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为
(6)自来水中的
 对人类健康产生危害。为了降低自来水中
对人类健康产生危害。为了降低自来水中 的浓度,某研究人员提出在碱性条件下用Al粉还原
的浓度,某研究人员提出在碱性条件下用Al粉还原 ,产物是N2。发生的反应可表示如下,请完成方程式的配平:
,产物是N2。发生的反应可表示如下,请完成方程式的配平: +
+ 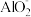 +
+
您最近一年使用:0次
2020-06-15更新
|
101次组卷
|
2卷引用:江西省南昌市八一中学2019-2020学年高一下学期期中考试化学试题
名校
解题方法
8 . 实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)在该反应中,如有1molCl2生成,被氧化的HCl的物质的量是__ ,转移电子的数目是___ 。
(2)在反应3Cl2+6KOH(浓)=5KCl+KClO3+3H2O中,氧化产物与还原产物的物质的量之比为___ ,3molCl2参加该反应时,反应中转移___ mol电子。
(3)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,反应的化学方程式是___ 。
(4)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)___ 。
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O(1)在该反应中,如有1molCl2生成,被氧化的HCl的物质的量是
(2)在反应3Cl2+6KOH(浓)=5KCl+KClO3+3H2O中,氧化产物与还原产物的物质的量之比为
(3)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,反应的化学方程式是
(4)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)
您最近一年使用:0次
名校
9 . 氯酸钾是一种强氧化剂,在不同条件下KClO3将KI氧化为I2或KIO3。某实验小组在实验室中对KClO3和KI的反应进行了探究。回答下列问题:
实验一 制取氯酸钾

(1)A中反应的化学方程式为_______ 。实验开始时,首先进行的实验步骤是________ 。
(2)A和B装置之间缺少除去氯气中氯化氢的装置,是否会对实验结果产生不利影响,其理由是__ (填“是”或“否”,若选择“是”请说明理由,若选择“否”则不需说明理由)
实验二 氯酸钾与碘化钾反应的研究
(3)该小组研究条件对反应产物的影响,系列a实验的记录表如下(实验在室温下进行):
①系列a实验的实验目的是__ .②设计1号试管实验的作用是__ .
③若2号试管实验现象是溶液变为黄色,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为______ .
实验一 制取氯酸钾

(1)A中反应的化学方程式为
(2)A和B装置之间缺少除去氯气中氯化氢的装置,是否会对实验结果产生不利影响,其理由是
实验二 氯酸钾与碘化钾反应的研究
(3)该小组研究条件对反应产物的影响,系列a实验的记录表如下(实验在室温下进行):
| 试管编号 | 1 | 2 | 3 | 4 |
| 0.20mol•L﹣1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
| KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0mol•L﹣1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
| 蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
| 实验现象 |
①系列a实验的实验目的是
③若2号试管实验现象是溶液变为黄色,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为
您最近一年使用:0次
名校
10 . 已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入足量的氯气,二者恰好完全反应。生成Cl-、ClO-、ClO3-三种含氯元素的离子,其中ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
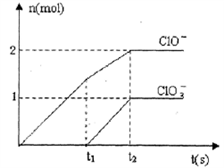
(1)t1时,开始有ClO3-生成的原因是___________________________ 。
(2)t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为___________________________ 。
(3)该石灰乳中含有Ca(OH)2的物质的量是_________ mol。

(1)t1时,开始有ClO3-生成的原因是
(2)t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为
(3)该石灰乳中含有Ca(OH)2的物质的量是
您最近一年使用:0次



