名校
1 . 生产生活中常用84消毒液杀菌消毒。化学课外小组用Cl2和NaOH溶液制取84消毒液。请回答下列问题:
(1)制取84消毒液需要 的NaOH溶液80mL,配制NaOH溶液时称量NaOH固体的质量为
的NaOH溶液80mL,配制NaOH溶液时称量NaOH固体的质量为_____ ,配制过程中使用的玻璃仪器有烧杯、玻璃棒、胶头滴管、_____ ;定容时俯视刻度线将导致所配溶液浓度_____ (填“偏高”、“偏低”或“不影响”)。
(2)制取84消毒液的离子方程式为_____ 。
(3)该消毒液也用于漂白,为增强漂白性向消毒液中滴加几滴稀盐酸,写出反应的化学方程式_____ 。
(4)已知酸性:H2CO3>HClO> ,向84消毒液中通入少量CO2的离子方程式为:
,向84消毒液中通入少量CO2的离子方程式为:_____ 。
(5)NaClO除了用于消毒外,在化工生产上常用作重要的氧化剂。比如,用NaClO和FeCl3溶液在NaOH的作用下制备一种新型水处理剂Na2FeO4,写出该反应的离子方程式:_____ 。
(1)制取84消毒液需要
 的NaOH溶液80mL,配制NaOH溶液时称量NaOH固体的质量为
的NaOH溶液80mL,配制NaOH溶液时称量NaOH固体的质量为(2)制取84消毒液的离子方程式为
(3)该消毒液也用于漂白,为增强漂白性向消毒液中滴加几滴稀盐酸,写出反应的化学方程式
(4)已知酸性:H2CO3>HClO>
 ,向84消毒液中通入少量CO2的离子方程式为:
,向84消毒液中通入少量CO2的离子方程式为:(5)NaClO除了用于消毒外,在化工生产上常用作重要的氧化剂。比如,用NaClO和FeCl3溶液在NaOH的作用下制备一种新型水处理剂Na2FeO4,写出该反应的离子方程式:
您最近一年使用:0次
名校
2 . 根据题目信息,完成有关方程式的书写。
(1)制备氢氧化铁胶体的离子方程式为_______ 。
(2) 与石灰乳反应的化学方程式:
与石灰乳反应的化学方程式:_______ 。
(3)用单线桥分析 与水反应中电子转移的方向和数目:
与水反应中电子转移的方向和数目:_______ 。
(4)将 固体(黄色,微溶)加入
固体(黄色,微溶)加入 和
和 的混合溶液里,加热,溶液显紫色(
的混合溶液里,加热,溶液显紫色( 无色)。写出该反应的离子方程式:
无色)。写出该反应的离子方程式:_______ 。
(1)制备氢氧化铁胶体的离子方程式为
(2)
 与石灰乳反应的化学方程式:
与石灰乳反应的化学方程式:(3)用单线桥分析
 与水反应中电子转移的方向和数目:
与水反应中电子转移的方向和数目:(4)将
 固体(黄色,微溶)加入
固体(黄色,微溶)加入 和
和 的混合溶液里,加热,溶液显紫色(
的混合溶液里,加热,溶液显紫色( 无色)。写出该反应的离子方程式:
无色)。写出该反应的离子方程式:
您最近一年使用:0次
解题方法
3 . 生产生活中常用的干燥剂、净水剂有:
①固体氢氧化钠,②变色硅胶(主要成分是二氧化硅,添加少量的无水CoCl2作指示剂),③P2O5(五氧化二磷),④氯化钙,⑤浓硫酸,⑥碱石灰(主要成分是氢氧化钠、氧化钙),⑦明矾,⑧Fe(OH)3胶体。
(1)上述物质中,属于电解质的是_______ 。
(2)下列气体中,能用碱石灰干燥的是_______ 。
a.CO2 b.HCl c.H2 d.Cl2
(3)固体氢氧化钠不能干燥CO2,原因为_______ (用化学方程式表示)。
(4)往胶粒带有正电荷的Fe(OH)3胶体中加入电解质能使胶体凝聚。使一定量的胶体在一定时间内开始凝聚所需电解质的浓度(mmol·L-1),称作“聚沉值”,电解质的“聚沉值”越小,则表示其凝聚能力_______ (填“越强”或“越弱”),实验证明,凝聚能力主要取决于与胶粒带相反电荷的离子所带的电荷数,电荷数越大,凝聚能力越强,则向Fe(OH)3胶体中加入下列电解质时,其“聚沉值”最小的为_______ 。
a.NaCl b.MgCl2 c.K2SO4 d.Na3PO4
①固体氢氧化钠,②变色硅胶(主要成分是二氧化硅,添加少量的无水CoCl2作指示剂),③P2O5(五氧化二磷),④氯化钙,⑤浓硫酸,⑥碱石灰(主要成分是氢氧化钠、氧化钙),⑦明矾,⑧Fe(OH)3胶体。
(1)上述物质中,属于电解质的是
(2)下列气体中,能用碱石灰干燥的是
a.CO2 b.HCl c.H2 d.Cl2
(3)固体氢氧化钠不能干燥CO2,原因为
(4)往胶粒带有正电荷的Fe(OH)3胶体中加入电解质能使胶体凝聚。使一定量的胶体在一定时间内开始凝聚所需电解质的浓度(mmol·L-1),称作“聚沉值”,电解质的“聚沉值”越小,则表示其凝聚能力
a.NaCl b.MgCl2 c.K2SO4 d.Na3PO4
您最近一年使用:0次
名校
4 . 完成下列问题
(1)为防止氯气尾气污染空气,根据氯水显酸性的性质,可用某溶液吸收多余的氯气,原理是(用化学方程式表示)___________ ;
(2)长期露置于空气中的漂白粉,加稀盐酸后产生的气体是___________(用字母代号填)
(3)石英砂不能与碱性物质共同存放,以NaOH为例,用化学方程式表示其原因:___________ 。
(1)为防止氯气尾气污染空气,根据氯水显酸性的性质,可用某溶液吸收多余的氯气,原理是(用化学方程式表示)
(2)长期露置于空气中的漂白粉,加稀盐酸后产生的气体是___________(用字母代号填)
| A.O2 | B.Cl2 | C.CO2 | D.HClO |
您最近一年使用:0次
2022-04-05更新
|
46次组卷
|
2卷引用:安徽工业大学附属中学2020-2021学年高二上学期文理分科考试化学试题
5 . 按要求写出化学方程式。
(1)Na和H2O反应:_______
(2)Na2O2和CO2反应:_______
(3)Na2O2和H2O反应:_______
(4)Fe在Cl2中燃烧:_______
(5)Fe和H2O(g)的反应:_______
(6)Fe和FeCl3(aq)的反应:_______
(7)Cl2和NaOH(aq)的反应:_______
(1)Na和H2O反应:
(2)Na2O2和CO2反应:
(3)Na2O2和H2O反应:
(4)Fe在Cl2中燃烧:
(5)Fe和H2O(g)的反应:
(6)Fe和FeCl3(aq)的反应:
(7)Cl2和NaOH(aq)的反应:
您最近一年使用:0次
6 . 将 通入NaOH溶液制备84消毒液(有效成分为
通入NaOH溶液制备84消毒液(有效成分为 ),利用氯及其化合物的“价类”二维图表示其中涉及的各物质之间的转化关系 。回答下列问题:
),利用氯及其化合物的“价类”二维图表示其中涉及的各物质之间的转化关系 。回答下列问题:
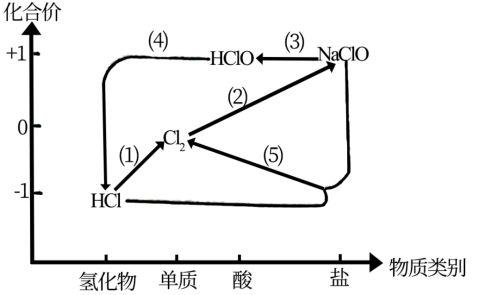
(1)实验室用二氧化锰和浓盐酸反成制备氯气的化学方程式为_______ 。
(2)制备84消毒液的离子方程式为_______ 。
(3)84消毒液中加入少量醋酸( )可增强效果,该反应的化学方程式为
)可增强效果,该反应的化学方程式为_______ 。
(4)次氯酸不稳定,光照条件下易分解。该反应的化学方程式为_______ 。
(5)84消毒液不能与洁厕剂(含盐酸)一起混合使用的原因为_______ (用离子反应方程式表示)。
 通入NaOH溶液制备84消毒液(有效成分为
通入NaOH溶液制备84消毒液(有效成分为 ),利用氯及其化合物的“价类”二维图表示其中涉及的各物质之间的转化关系 。回答下列问题:
),利用氯及其化合物的“价类”二维图表示其中涉及的各物质之间的转化关系 。回答下列问题:
(1)实验室用二氧化锰和浓盐酸反成制备氯气的化学方程式为
(2)制备84消毒液的离子方程式为
(3)84消毒液中加入少量醋酸(
 )可增强效果,该反应的化学方程式为
)可增强效果,该反应的化学方程式为(4)次氯酸不稳定,光照条件下易分解。该反应的化学方程式为
(5)84消毒液不能与洁厕剂(含盐酸)一起混合使用的原因为
您最近一年使用:0次
2021-01-24更新
|
309次组卷
|
3卷引用:安徽省滁州市凤阳县凤阳中学2020-2021学年高一(上学期)第二次月考化学试卷
名校
解题方法
7 . 化学实验的微型化可有效减少污染,实现化学实验的绿色化。某同学按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0. 1 mol/L的KBr、KI(含淀粉)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好。[已知:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O]
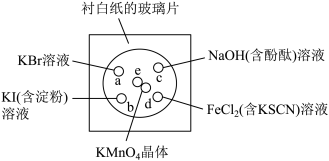
(1)e处发生反应的离子方程式为___________ ,该反应中氧化剂和还原剂的物质的量之比为___________
(2)b处的实验现象为___________ ,d处的实验现象为___________ 。
(3)c处反应的化学方程式为___________ ,标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为___________ mol。
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?___________ (填“能”或“不能”),若能,其氧化性由强到弱的顺序是___________ 。

(1)e处发生反应的离子方程式为
(2)b处的实验现象为
(3)c处反应的化学方程式为
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?
您最近一年使用:0次
名校
解题方法
8 . (1)向Fe(OH)3胶体中逐滴加入氢碘酸。
现象:____________________________________________________________
离子方程式:________________________________________________
(2)将Cl2通入NaOH溶液,充分反应后测得溶液中ClO-与ClO 个数比为3:1,则被氧化与被还原的氯元素质量比为
个数比为3:1,则被氧化与被还原的氯元素质量比为_________ ;离子方程式为_________________________________ 。
(3)H2与Cl2混合点燃,充分反应后,将气体通入含有40gNaOH的溶液中恰好完全反应,则混合气体中Cl2质量为________ 。
(4)向FeBr2溶液中通入一定量的Cl2,充分反应后,测得游离态的溴元素和化合态的溴元素质量比为1:1,写出反应的离子方程式________________________________________________ 。
现象:
离子方程式:
(2)将Cl2通入NaOH溶液,充分反应后测得溶液中ClO-与ClO
 个数比为3:1,则被氧化与被还原的氯元素质量比为
个数比为3:1,则被氧化与被还原的氯元素质量比为(3)H2与Cl2混合点燃,充分反应后,将气体通入含有40gNaOH的溶液中恰好完全反应,则混合气体中Cl2质量为
(4)向FeBr2溶液中通入一定量的Cl2,充分反应后,测得游离态的溴元素和化合态的溴元素质量比为1:1,写出反应的离子方程式
您最近一年使用:0次
2020-11-16更新
|
118次组卷
|
2卷引用:安徽省黄山市屯溪第一中学2020-2021学年高一上学期期中考试化学试题
名校
9 . 2020年突如其来的“新冠肺炎”使人们认识到日常杀菌消毒的重要性。其中含氯消毒剂在生产生活中有着广泛的用途。
(1)工业上将氯气溶于一定浓度的氢氧化钠溶液可制得“84消毒液”,用电子式表示“84消毒液”的有效成分是__________ 。
(2)二氧化氯(ClO2)是一种黄绿色易溶于水的气体,也可用于自来水的杀菌消毒。工业上常用NaClO3和Na2SO3溶液混合并加入稀H2SO4酸化后反应制得,反应中NaClO3和Na2SO3的物质的量之比为______________ 。
(1)工业上将氯气溶于一定浓度的氢氧化钠溶液可制得“84消毒液”,用电子式表示“84消毒液”的有效成分是
(2)二氧化氯(ClO2)是一种黄绿色易溶于水的气体,也可用于自来水的杀菌消毒。工业上常用NaClO3和Na2SO3溶液混合并加入稀H2SO4酸化后反应制得,反应中NaClO3和Na2SO3的物质的量之比为
您最近一年使用:0次
名校
10 . (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是 ______________ 。
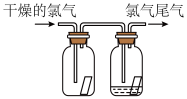
(2)为防止氯气尾气污染空气,可用________ 溶液吸收多余的氯气,原理是(用化学方程式表示)____________________ 。
(3)工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是_______ (填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是_______ (用字母代号填)。
A.O2 B.Cl2 C.CO2 D.HClO

(2)为防止氯气尾气污染空气,可用
(3)工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是
A.O2 B.Cl2 C.CO2 D.HClO
您最近一年使用:0次
2019-02-26更新
|
247次组卷
|
5卷引用:2015-2016学年安徽省阜阳市太和八中高一上学期期末文化学试卷
2015-2016学年安徽省阜阳市太和八中高一上学期期末文化学试卷吉林省长春外国语学校2017-2018学年高一上学期期末考试(理)化学试题宁夏回族自治区青铜峡市高级中学2018-2019学年高一上学期期末考试化学试题福建省永安市第三中学2019-2020学年高一10月月考化学试题(已下线)第02讲 氯气-【暑假自学课】2022年新高一化学暑假精品课(鲁科版2019必修第一册)



