1 . 如图是实验室制备氯气并进行相关性质检验的装置,实验装置如图:
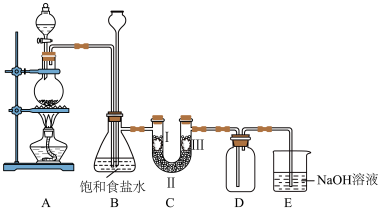
回答下列问题:
(1)①装置A中是用 和浓盐酸反应制备
和浓盐酸反应制备 ,其化学方程式为
,其化学方程式为________ 。
②B中加入饱和食盐水的目的________ 。
(2)装置B有安全瓶作用,监测实验进行时C中是否发生堵塞,请写出C发生堵塞时B中的现象________ 。
(3)设置装置C的实验目的是验证氯气是否具有漂白性,为此C中的Ⅰ、Ⅱ、Ⅲ依次应放入________ (从下表a、b、c、d中选择)。
(4)装置E的作用是________ ,发生的离子方程式是________ 。
(5)某同学设计实验探究“84”消毒液(主要成分NaClO)的漂白性。
Ⅰ.在2mL“84”消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.在2mL“84”消毒液中加入2mL醋酸后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.在不同温度时,测得“84”消毒液ORP值随时间的变化曲线如图所示。
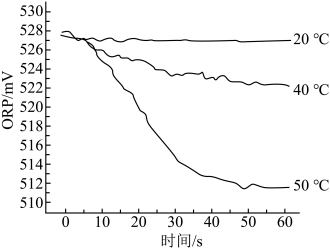
已知:ORP表示水溶液中物质的氧化性或还原性强弱,ORP值越大,氧化性越强。
①实验Ⅰ、Ⅱ现象不同的原因是________ 。
②实验Ⅲ中,随时间的变化ORP值不同的原因可能是________ 。

回答下列问题:
(1)①装置A中是用
 和浓盐酸反应制备
和浓盐酸反应制备 ,其化学方程式为
,其化学方程式为②B中加入饱和食盐水的目的
(2)装置B有安全瓶作用,监测实验进行时C中是否发生堵塞,请写出C发生堵塞时B中的现象
(3)设置装置C的实验目的是验证氯气是否具有漂白性,为此C中的Ⅰ、Ⅱ、Ⅲ依次应放入
选项 | a | b | c | d |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 无水氯化钙 | 碱石灰 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)装置E的作用是
(5)某同学设计实验探究“84”消毒液(主要成分NaClO)的漂白性。
Ⅰ.在2mL“84”消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.在2mL“84”消毒液中加入2mL醋酸后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.在不同温度时,测得“84”消毒液ORP值随时间的变化曲线如图所示。

已知:ORP表示水溶液中物质的氧化性或还原性强弱,ORP值越大,氧化性越强。
①实验Ⅰ、Ⅱ现象不同的原因是
②实验Ⅲ中,随时间的变化ORP值不同的原因可能是
您最近一年使用:0次
2024-02-10更新
|
127次组卷
|
3卷引用:2024届河南省南阳市唐河县第一高级中学高一上学期1月期末化学试题
解题方法
2 . 某同学利用如图装置制备并收集干燥纯净的 ,并探究
,并探究 与碱的反应。回答下列问题:
与碱的反应。回答下列问题:

(1)仪器a的名称为_______ ,装置A中发生反应的化学方程式为_______ 。
(2)装置B的作用是______________ 。
(3)装置D用来收集干燥的氯气,进气口为_______ (填“m”或“n”)。
(4)若将 通入冷的
通入冷的_______ (填试剂)中,即制得漂白粉。
(5)探究 的性质。取出装置D,按图1装置用压强传感器测定集气瓶内的压强,压强随实验步骤变化的曲线如图2所示。
的性质。取出装置D,按图1装置用压强传感器测定集气瓶内的压强,压强随实验步骤变化的曲线如图2所示。
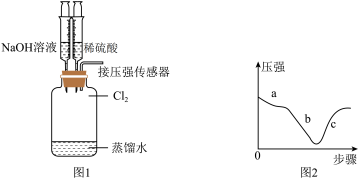
实验步骤如下:
ⅰ.向装置D中加入适量的蒸馏水,振荡;
ⅱ.用注射器向装置D中注入 溶液;
溶液;
ⅱ.用注射器向装置D中注入稀硫酸。
①步骤ⅰ压强减小的原因是______________ 。
②步骤ⅱ中 与
与 溶液反应的离子方程式为
溶液反应的离子方程式为______________ 。
③步骤ⅲ,装置D中的现象为______________ 。
 ,并探究
,并探究 与碱的反应。回答下列问题:
与碱的反应。回答下列问题:
(1)仪器a的名称为
(2)装置B的作用是
(3)装置D用来收集干燥的氯气,进气口为
(4)若将
 通入冷的
通入冷的(5)探究
 的性质。取出装置D,按图1装置用压强传感器测定集气瓶内的压强,压强随实验步骤变化的曲线如图2所示。
的性质。取出装置D,按图1装置用压强传感器测定集气瓶内的压强,压强随实验步骤变化的曲线如图2所示。
实验步骤如下:
ⅰ.向装置D中加入适量的蒸馏水,振荡;
ⅱ.用注射器向装置D中注入
 溶液;
溶液;ⅱ.用注射器向装置D中注入稀硫酸。
①步骤ⅰ压强减小的原因是
②步骤ⅱ中
 与
与 溶液反应的离子方程式为
溶液反应的离子方程式为③步骤ⅲ,装置D中的现象为
您最近一年使用:0次
3 . 实验室用 和浓盐酸反应生成
和浓盐酸反应生成 后,按照净化、收集、性质检验及尾气处理的顺序进行实验。下列装置(“→”表示气流方向)不能达到实验目的的是
后,按照净化、收集、性质检验及尾气处理的顺序进行实验。下列装置(“→”表示气流方向)不能达到实验目的的是
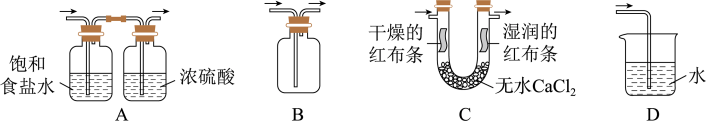
 和浓盐酸反应生成
和浓盐酸反应生成 后,按照净化、收集、性质检验及尾气处理的顺序进行实验。下列装置(“→”表示气流方向)不能达到实验目的的是
后,按照净化、收集、性质检验及尾气处理的顺序进行实验。下列装置(“→”表示气流方向)不能达到实验目的的是
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-06-10更新
|
16632次组卷
|
59卷引用:河南省百师联考2023-2024学年高一上学期1月期末化学试题
河南省百师联考2023-2024学年高一上学期1月期末化学试题河南省郑州市中牟县第一高级中学2023-2024学年高一上学期1月月考化学试题河南省郑州市第十九高级中学2022-2023学年高二上学期开学文理分科考试化学试题河南省南阳市六校2023-2024学年高一上学期12月月考化学试题黑龙江省大庆市大庆中学2023-2024学年高一下学期开学化学试题2022年新高考广东化学高考真题(已下线)2022年广东卷高考真题变式题(1-10)(已下线)专题11 化学实验基础-2022年高考真题模拟题分项汇编(已下线)专题11 化学实验基础-三年(2020-2022)高考真题分项汇编(已下线)专题12 化学实验方案的设计与评价-三年(2020-2022)高考真题分项汇编(已下线)考点09 氯及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点51 物质的制备-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题讲座(四) 常见气体的实验室制备、净化和收集(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第12讲 富集在海水中的元素——卤素(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第05练 氯及其化合物-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第05练 氯及其化合物-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第10讲 氯气的实验室制法及Cl-的检验-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )(已下线)第10讲 氯及其化合物(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)2.2.3 氯气的实验室制法 氯离子的检验-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)(已下线)第27讲 化学实验基础知识和技能(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第27讲 物质的制备与性质实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)微专题43 常见物质的分离、提纯和鉴别-备战2023年高考化学考点微专题(全国版)安徽省蚌埠第二中学2022-2023学年高一上学期10月月考化学试题福建省莆田第二十五中学2022-2023学年高三上学期月考(一)化学试题(已下线)海水中的重要元素—钠和氯——课时4氯气的实验室制法及氯离子检验(已下线)易错点09 氯元素及其化合物-备战2023年高考化学考试易错题甘肃省张掖市高台县第一中学2022-2023学年高一上学期期中考试化学试题广东省深圳市福田区红岭中学2022-2023学年高三上学期第一次统一考试化学试题福建省福州日升中学2022-2023学年高一上学期期中测试化学试题江苏省南京师范大学附属中学2022-2023学年高一上学期12月月考化学试题(已下线)江苏省南通市如皋市2022-2023学年高二上学期教学质量调研(一)(选修)化学试题安徽省六安市裕安区新安中学2022-2023学年高三上学期第三次月考化学试题(已下线)专题11 化学实验基础(讲)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题23 化学实验基础性选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 专题17 典型实验装置及化学实验基本操作福建省龙岩市2022-2023学年高一上学期期末教学质量检测化学试题(已下线)题型41 氯气的性质、制备和应用湖南省永州市东安县第一中学2022-2023学年高一下学期开年摸底联考化学试题(已下线)素养卷07 微型物质制备方案设计-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)专题13 化学实验基础(已下线)专题13 化学实验基础(已下线)第08练 实验仪器的选用与基本操作 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)【知识图鉴】单元讲练测必修第一册第二单元02基础练广东省韶关市武江区北江实验中学2022-2023学年高一上学期第一次月考化学试题(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题11 化学实验(选择题)-2023年高考化学真题题源解密(新高考专用)(已下线)微专题 常见气体的实验室制备、净化和收集(已下线)专题05 化学实验基础-2023年高考化学真题题源解密(全国通用)陕西省汉中中学2024届高三上学期8月质量检测化学试题江苏省响水中学2023-2024学年高二上学期暑期测试化学试题(已下线)实验05 探究氯气的性质-【同步实验课】2023-2024学年高一化学教材实验大盘点(人教版2019必修第一册)(已下线)考点44 化学实验基础(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)湖南省常德市第一中学2024届高三上学期第三次月考化学试题(已下线)考点3 物质的制备与性质实验 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)北京市第一六一中学2022-2023学年高一上学期12月月考化学试题黑龙江省哈尔滨市第三十二中学校2023-2024学年高三上学期11月期中考试化学试题天津市滨海新区田家炳中学2023-2024学年高三上学期期中考试化学试题广东省珠海市广东实验中学金湾学校2023-2024学年高一上学期12月月考化学试题化学江苏省扬州市宝应区2023-2024学年曹甸高级中学高三上学期9月化学试卷
名校
4 . 某校化学实验兴趣小组为探究卤素单质性质进行了以下实验:
I.为验证卤族元素性质的递变规律,某同学设计了如图所示装置。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉-KI试纸、沾有NaOH溶液的棉花。

(1)A处反应的离子方程式:___________ ,B处的实验现象为___________ ,C处沾有NaOH溶液的棉花的作用为___________ ;
(2)该实验___________ 验证非金属性Cl>Br>I(填“能”或“不能”),理由是___________ ;
II.已知Cl2可以将Fe2+氧化成Fe3+,为探究Br2能否将Fe2+氧化成Fe3+,某同学甲做了以下实验:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后观察到溶液呈黄色。
(3)乙同学认为不能据此现象认为Br2氧化性比Fe3+强,理由是___________ ;
(4)丙同学选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了氧化性:Br2>Fe3+。请在表中写出丙同学可能选用的试剂及实验中观察到的现象(供选用的试剂:a.酚酞试液、b.CCl4、c.无水酒精、d.KSCN溶液)。
(5)向FeBr2溶液中通入少量Cl2,发生反应的离子方程式为___________ 。
I.为验证卤族元素性质的递变规律,某同学设计了如图所示装置。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉-KI试纸、沾有NaOH溶液的棉花。

(1)A处反应的离子方程式:
(2)该实验
II.已知Cl2可以将Fe2+氧化成Fe3+,为探究Br2能否将Fe2+氧化成Fe3+,某同学甲做了以下实验:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后观察到溶液呈黄色。
(3)乙同学认为不能据此现象认为Br2氧化性比Fe3+强,理由是
(4)丙同学选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了氧化性:Br2>Fe3+。请在表中写出丙同学可能选用的试剂及实验中观察到的现象(供选用的试剂:a.酚酞试液、b.CCl4、c.无水酒精、d.KSCN溶液)。
| 选用试剂(填序号) | 实验现象 | |
| 方案1 | ||
| 方案2 |
(5)向FeBr2溶液中通入少量Cl2,发生反应的离子方程式为
您最近一年使用:0次
5 . 氯元素具有多种化合价,形成的 等离子,在一定条件下能发生相互转化。
等离子,在一定条件下能发生相互转化。 和碱反应可生成多种含氧酸盐,且温度不同,反应产物也不同。实验室利用如图装置(部分装置省略)制备
和碱反应可生成多种含氧酸盐,且温度不同,反应产物也不同。实验室利用如图装置(部分装置省略)制备 和
和 。下列说法正确的是
。下列说法正确的是
 等离子,在一定条件下能发生相互转化。
等离子,在一定条件下能发生相互转化。 和碱反应可生成多种含氧酸盐,且温度不同,反应产物也不同。实验室利用如图装置(部分装置省略)制备
和碱反应可生成多种含氧酸盐,且温度不同,反应产物也不同。实验室利用如图装置(部分装置省略)制备 和
和 。下列说法正确的是
。下列说法正确的是
A.装置Ⅰ中可将 换成 换成 |
B.装置Ⅱ洗气瓶中用饱和 溶液除去 溶液除去 中的少量 中的少量 |
C.装置Ⅳ中反应的离子方程式为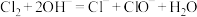 |
| D.装置V锥形瓶中用澄清石灰水吸收尾气 |
您最近一年使用:0次
2024-05-04更新
|
164次组卷
|
2卷引用:河南省郑州市宇华实验学校2023-2024学年高二下学期4月期中考试化学试题
名校
6 . 实验室可用如图装置制备无水FeCl3。已知FeCl3易升华,易吸收水分而潮解。请回答下列问题:_______ 。
(2)装置A盛放浓盐酸的仪器名称是_______ ,其上口与烧瓶用导管相连的作用是_______ 。
(3)A装置中发生反应的离子方程式为_______ 。当加入一定量的浓盐酸与足量MnO2反应,实际生成的Cl2体积小于理论值的原因是_______ 。
(4)装置B的作用是_______ ,G中发生反应的离子方程式为_______ 。
(5)F中所装试剂为_______ ,目的是_______ 。

(2)装置A盛放浓盐酸的仪器名称是
(3)A装置中发生反应的离子方程式为
(4)装置B的作用是
(5)F中所装试剂为
您最近一年使用:0次
2023-05-05更新
|
525次组卷
|
6卷引用:河南省平顶山市第二中学2023-2024学年高一上学期期末化学试题
名校
7 . 实验小组制备高铁酸钾 并探究其性质。
并探究其性质。
资料: 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
I.制备 (夹持装置略)
(夹持装置略)
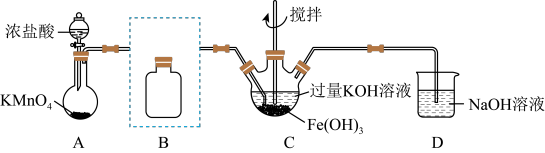
(1)A为氯气发生装置。 中反应的离子方程式是
中反应的离子方程式是_______
(2)B装置盛有饱和 溶液,
溶液, 中得到紫色固体和溶液。
中得到紫色固体和溶液。 中制备高铁酸钾的化学反应方程式为
中制备高铁酸钾的化学反应方程式为_______
II.探究 的性质
的性质
(3)取 中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液
中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液 ,经检验气体中含有
,经检验气体中含有 。
。
为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:
由方案Ⅰ可知 中含有
中含有 离子,但该离子的产生不能判断一定是
离子,但该离子的产生不能判断一定是 将
将 氧化,还可能由
氧化,还可能由_______ 产生,(用离子方程式表示)。
(4)根据 的制备实验得出:氧化性
的制备实验得出:氧化性
_______  (填“>”或“<”),而方案Ⅱ实验表明,
(填“>”或“<”),而方案Ⅱ实验表明, 和
和 的氧化性强弱关系相反,原因可能是
的氧化性强弱关系相反,原因可能是_______ 。
 并探究其性质。
并探究其性质。资料:
 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。I.制备
 (夹持装置略)
(夹持装置略)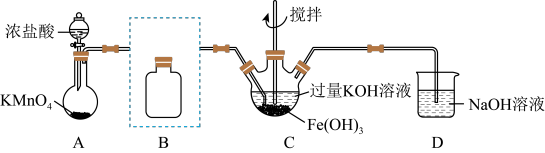
(1)A为氯气发生装置。
 中反应的离子方程式是
中反应的离子方程式是(2)B装置盛有饱和
 溶液,
溶液, 中得到紫色固体和溶液。
中得到紫色固体和溶液。 中制备高铁酸钾的化学反应方程式为
中制备高铁酸钾的化学反应方程式为II.探究
 的性质
的性质(3)取
 中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液
中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液 ,经检验气体中含有
,经检验气体中含有 。
。为证明是否
 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:| 方案Ⅰ | 取少量a,经过检验溶液中含有 。 。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将 溶出,得到紫色溶液b。取少量b,滴加盐酸,有 溶出,得到紫色溶液b。取少量b,滴加盐酸,有 产生。 产生。 |
 中含有
中含有 离子,但该离子的产生不能判断一定是
离子,但该离子的产生不能判断一定是 将
将 氧化,还可能由
氧化,还可能由(4)根据
 的制备实验得出:氧化性
的制备实验得出:氧化性
 (填“>”或“<”),而方案Ⅱ实验表明,
(填“>”或“<”),而方案Ⅱ实验表明, 和
和 的氧化性强弱关系相反,原因可能是
的氧化性强弱关系相反,原因可能是
您最近一年使用:0次
2023-01-22更新
|
584次组卷
|
3卷引用:河南省南阳市邓州市第一高级中学校2023-2024学年高一上学期期末考试化学试题



