名校
1 . 工业上利用反应: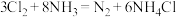 检查氯气管道是否漏气。下列说法不正确的是
检查氯气管道是否漏气。下列说法不正确的是
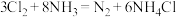 检查氯气管道是否漏气。下列说法不正确的是
检查氯气管道是否漏气。下列说法不正确的是| A.将浓氨水接近管道,若产生白烟说明管道漏气 |
B.N2的电子式为: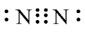 |
| C.NH4Cl中只含有离子键 |
| D.该反应中氧化剂和还原剂的物质的量之比为2∶3 |
您最近一年使用:0次
2 . 下列方程式正确的是
A.铁溶于稀硝酸,溶液变黄: |
B. 发生催化氧化反应: 发生催化氧化反应: |
C.铁和硫加热条件下反应: |
D.“气肥”要低温保存,因为碳酸氢铵受热分解: |
您最近一年使用:0次
3 . 硝酸是重要的化工原料。下图是以合成氨为基础的传统硝酸生产工艺流程(其中空气等基础原料已略去)。________ (填序号)。
a.合成氨是一种重要的人工固氨方法
b.该反应过程中氮元素被氧化
c.合成的氨气还可以用于化肥工业
d.该反应采用高温、高压等苛刻条件,与N2化学性质很稳定有关
(2)氨氧化装置中,产生的含氨物质主要为NO,反应的化学方程式为________ 。
(3)聚合、吸收装置中,含氮物质转化的主要反应包括①NO→NO2;②NO2→N2O4;③N2O4→HNO3,其中属于氧化还原反应的是________ (填序号)。
(4)吸收装置中。发生的反应为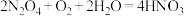 ,若用
,若用 的稀硝酸作为吸收液,反应后得到
的稀硝酸作为吸收液,反应后得到 的浓硝酸,则理论上吸收装置中需消耗的O2的物质的量为
的浓硝酸,则理论上吸收装置中需消耗的O2的物质的量为________ mol(写出计算式)。
(5)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的氮氧化物脱除技术,可用于上述硝酸生产工艺的废气处理,反应原理如下图所示:________ 。

a.合成氨是一种重要的人工固氨方法
b.该反应过程中氮元素被氧化
c.合成的氨气还可以用于化肥工业
d.该反应采用高温、高压等苛刻条件,与N2化学性质很稳定有关
(2)氨氧化装置中,产生的含氨物质主要为NO,反应的化学方程式为
(3)聚合、吸收装置中,含氮物质转化的主要反应包括①NO→NO2;②NO2→N2O4;③N2O4→HNO3,其中属于氧化还原反应的是
(4)吸收装置中。发生的反应为
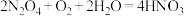 ,若用
,若用 的稀硝酸作为吸收液,反应后得到
的稀硝酸作为吸收液,反应后得到 的浓硝酸,则理论上吸收装置中需消耗的O2的物质的量为
的浓硝酸,则理论上吸收装置中需消耗的O2的物质的量为(5)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的氮氧化物脱除技术,可用于上述硝酸生产工艺的废气处理,反应原理如下图所示:

您最近一年使用:0次
名校
解题方法
4 . 某化学实验小组同学利用如图所示装置制备氨气,并探究氨气的性质(部分仪器已略去)。___________ 。
(2)干燥氨气可选用的试剂是___________ (填序号)。
①浓H2SO4 ②碱石灰 ③P2O5
(3)收集氨气时,氨气的进气口为___________ (填“a”或“b”)。
(4)证明烧瓶中氨气集满的方法是___________ 。
(5)为防止环境污染,下列装置中(盛放的液体均为水)可用于吸收多余氨气的是___________ (填序号)。___________ (填选项代号)。
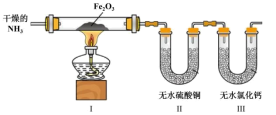
a.装置Ⅰ中红色Fe2O3粉末变为黑色粉末,经检验是一种铁的氧化物
b.装置Ⅱ中无水CuSO4粉末变为蓝色
c.装置Ⅲ无水CaCl2的质量增加
d.生成一种无色无味气体,该气体无污染
(7)小组同学继续对(6)装置I反应后黑色粉末的组成进行探究。
(8)结合(6)(7)实验,写出(6)中NH3还原Fe2O3的化学方程式___________ 。
(2)干燥氨气可选用的试剂是
①浓H2SO4 ②碱石灰 ③P2O5
(3)收集氨气时,氨气的进气口为
(4)证明烧瓶中氨气集满的方法是
(5)为防止环境污染,下列装置中(盛放的液体均为水)可用于吸收多余氨气的是
a.装置Ⅰ中红色Fe2O3粉末变为黑色粉末,经检验是一种铁的氧化物
b.装置Ⅱ中无水CuSO4粉末变为蓝色
c.装置Ⅲ无水CaCl2的质量增加
d.生成一种无色无味气体,该气体无污染
(7)小组同学继续对(6)装置I反应后黑色粉末的组成进行探究。
| 操作 | 现象 | 结论或离子方程式 |
| 步骤1:取少量黑色粉末于小烧杯中,加入过量盐酸 | 黑色粉末全部溶解,无气泡产生,溶液呈浅绿色 | 溶液中可能含有Fe2+ |
| 步骤2:取步骤1少量溶液于试管中,滴入2-3滴KSCN溶液,振荡 | 溶液颜色 | 溶液中不含有Fe3+ |
| 步骤3:向步骤2试管中滴入少量氯水 | 溶液变红色 | 涉及离子方程式有 Fe(SCN)3 Fe(SCN)3 |
您最近一年使用:0次
2024-05-27更新
|
205次组卷
|
2卷引用:北师大附属实验中学2023-2024学年度第二学期期中试卷
名校
解题方法
5 . 下列关于氨的性质的描述不正确 的是
| A.无色有刺激性气味的气体 | B.能使湿润的红色石蕊试纸变蓝 |
| C.极易溶于水,密度比空气小 | D.从化合价判断主要体现氧化性 |
您最近一年使用:0次
名校
解题方法
6 . 几种短周期元素的原子半径及主要化合价如表:
下列叙述正确的是
元素代号 | X | Y | Z | W |
原子半径/pm | 160 | 143 | 70 | 66 |
主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A.X、Y分别对应的简单离子半径前者小 |
| B.W的简单氢化物可与其最高价氧化物对应水化物反应生成盐 |
| C.X和 Y对应的最高价氧化物的水化物均能溶于氢氧化钠 |
| D.一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
您最近一年使用:0次
名校
7 . 氨气是重要的含氮元素物质。
I. 工业上氨气是重要的化工产品及制备硝酸的原料。
(1)工业合成氨的化学方程式___________ 。
(2)氨的催化氧化是工业制硝酸的基础,写出化学方程式___________ 。
II.实验室常利用如图所示装置及药品制取干燥的氨气。___________ 。
(4)C处是收集氨气的装置,请将集气瓶中导管补充完整_______ 。
(5)证明氨气已收集满的操作和现象是___________ 。
I. 工业上氨气是重要的化工产品及制备硝酸的原料。
(1)工业合成氨的化学方程式
(2)氨的催化氧化是工业制硝酸的基础,写出化学方程式
II.实验室常利用如图所示装置及药品制取干燥的氨气。
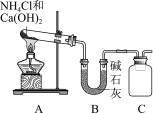
(4)C处是收集氨气的装置,请将集气瓶中导管补充完整
(5)证明氨气已收集满的操作和现象是
您最近一年使用:0次
名校
解题方法
8 . 自然界中氮元素有多种存在形式。
(1)工业合成氨反应的化学方程式是_________ 。
实验室制氨气的化学方程式是______ ,检验氨气是否收集满,可______ (操作方法及现象)该反应化学方程式为:______ 。
(2)NH3在一定条件下可被氧化。
已知:ⅰ.4NH3(g)+3O2(g)=2N2(g)+6H2O(g) 该条件下4mol NH3(g)完全反应,消耗3mol O2(g),生成2molN2(g)和6mol H2O(g),同时放出1269kJ热量。
ⅱ.

断开1 mol H-O 键与断开 1 mol H-N 键所需能量相差约______ kJ;
(3)水中的氨在微生物作用下可被氧化为亚硝酸,其化学方程式是____ 。
(4)NH3经一系列反应可以得到HNO3,转化关系如图。

①I中,NH3和O2在催化剂作用下反应,化学方程式是_____ 。
②II中,2NO(g)+O2(g) 2NO2(g)。一定温度下,在容积不变的密闭容器中,下列可说明该反应达到平衡状态的是
2NO2(g)。一定温度下,在容积不变的密闭容器中,下列可说明该反应达到平衡状态的是_____ 。
A.O2的浓度不再变化
B.容器内气体的颜色不发生变化
C.相同时间内,消耗1 mol NO同时生成1 mol NO2
③一定条件下,向含HNO3的废水中加入CH3OH,可将HNO3还原成N2。若该反应消耗32 g CH3OH,转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是_____ 。
(1)工业合成氨反应的化学方程式是
实验室制氨气的化学方程式是
(2)NH3在一定条件下可被氧化。
已知:ⅰ.4NH3(g)+3O2(g)=2N2(g)+6H2O(g) 该条件下4mol NH3(g)完全反应,消耗3mol O2(g),生成2molN2(g)和6mol H2O(g),同时放出1269kJ热量。
ⅱ.

断开1 mol H-O 键与断开 1 mol H-N 键所需能量相差约
(3)水中的氨在微生物作用下可被氧化为亚硝酸,其化学方程式是
(4)NH3经一系列反应可以得到HNO3,转化关系如图。

①I中,NH3和O2在催化剂作用下反应,化学方程式是
②II中,2NO(g)+O2(g)
 2NO2(g)。一定温度下,在容积不变的密闭容器中,下列可说明该反应达到平衡状态的是
2NO2(g)。一定温度下,在容积不变的密闭容器中,下列可说明该反应达到平衡状态的是A.O2的浓度不再变化
B.容器内气体的颜色不发生变化
C.相同时间内,消耗1 mol NO同时生成1 mol NO2
③一定条件下,向含HNO3的废水中加入CH3OH,可将HNO3还原成N2。若该反应消耗32 g CH3OH,转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是
您最近一年使用:0次
9 . 氮是大气中含量最多的一种元素,氮及其化合物在生产、生活中有着重要作用。请回答下列问题:
(1)下列变化属于“氮的固定”的是___________ (填字母)
a.植物从土壤中吸收氮肥
b.硝酸和氨气反应生成氮肥
c.将空气中的氮气转变为氮的化合物
(2)下图是工业生产硝酸的流程。

①1909年化学家哈伯在实验室首次合成了氨。氨的电子式是___________ 。实验室用NH4Cl和Ca(OH)2制取氨气的化学方程式为:___________ 。
②2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如下:

 、
、 、
、 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面。用文字描述图②→③表示的变化过程
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面。用文字描述图②→③表示的变化过程___________ 。
③写出氧化炉内反应的化学方程式___________ 。
④吸收塔中通入空气的目的是___________ 。
(1)下列变化属于“氮的固定”的是
a.植物从土壤中吸收氮肥
b.硝酸和氨气反应生成氮肥
c.将空气中的氮气转变为氮的化合物
(2)下图是工业生产硝酸的流程。

①1909年化学家哈伯在实验室首次合成了氨。氨的电子式是
②2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如下:

 、
、 、
、 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面。用文字描述图②→③表示的变化过程
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面。用文字描述图②→③表示的变化过程③写出氧化炉内反应的化学方程式
④吸收塔中通入空气的目的是
您最近一年使用:0次
10 . 科学的假设是实验探究的先导与价值所在。下列在假设引导下的探究肯定没有 意义的是
A.探究 与 与 反应可能生成 反应可能生成 |
B.探究Na与乙醇反应可能有 生成 生成 |
C.探究 与 与 反应可能有 反应可能有 生成 生成 |
D.探究Mg与 溶液反应产生的气体中可能含有 溶液反应产生的气体中可能含有 |
您最近一年使用:0次
2023-05-20更新
|
123次组卷
|
2卷引用:北京市第十五中学2022-2023学年高一下学期期中考试化学试题



