解题方法
1 . 下列有关物质性质与用途具有对应关系的是
| A.氨气易液化,可用作喷泉实验 |
| B.浓硝酸易分解,可用于钝化保护金属铁 |
| C.双氧水有氧化性,可与高锰酸钾反应制氧气 |
| D.氮气常温下性质稳定,可用作粮仓的保护气 |
您最近一年使用:0次
名校
2 . 含氮化合物在工农业有着重要的用途。
(1)氨气的发生装置可以选择上图中的A,反应的化学方程式为____________ 。
(2)预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:a→______ (按气流方向,用小写字母表示)。
(3)请写出氨气的检验方法:____________ 。
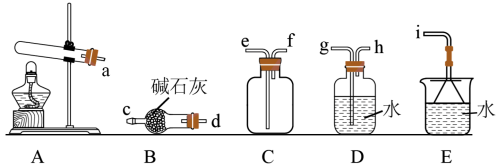
(4)甲、乙两同学分别设计了下图装备进行喷泉实验,____________ 。
②乙同学想用乙装备在两个烧瓶同时产生喷泉,引发双喷泉的操作是:______ —______ 。
Ⅱ. 经一系列反应可以得到
经一系列反应可以得到 。
。
(5)①中, 和
和 在催化剂作用下反应,其化学方程式是
在催化剂作用下反应,其化学方程式是____________ 。
(6)NO的检验方法是:____________ 。
Ⅲ.研究 、
、 、CO等大气污染气体的处理具有重要现实意义。
、CO等大气污染气体的处理具有重要现实意义。
(7)选择性催化还原技术(SCR)可使 与
与 直接反应,实现无害转化。当NO与
直接反应,实现无害转化。当NO与 的物质的量之比为2∶1时,写出发生反应的化学方程式:
的物质的量之比为2∶1时,写出发生反应的化学方程式:____________ 。
(8)大气污染物中的氮氧化物地可用NaOH吸收,先后发生如下反应:
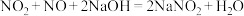 ;
; 。
。
若33.6 mL(标况下)氮氧化物(只含NO和 )与V mL0.1 mol/L NaOH溶液恰好完全反应,则
)与V mL0.1 mol/L NaOH溶液恰好完全反应,则
______ 。
(1)氨气的发生装置可以选择上图中的A,反应的化学方程式为
(2)预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:a→
(3)请写出氨气的检验方法:
(4)甲、乙两同学分别设计了下图装备进行喷泉实验,
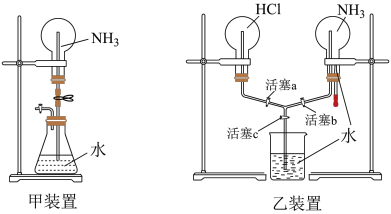
②乙同学想用乙装备在两个烧瓶同时产生喷泉,引发双喷泉的操作是:
Ⅱ.
 经一系列反应可以得到
经一系列反应可以得到 。
。
(5)①中,
 和
和 在催化剂作用下反应,其化学方程式是
在催化剂作用下反应,其化学方程式是(6)NO的检验方法是:
Ⅲ.研究
 、
、 、CO等大气污染气体的处理具有重要现实意义。
、CO等大气污染气体的处理具有重要现实意义。(7)选择性催化还原技术(SCR)可使
 与
与 直接反应,实现无害转化。当NO与
直接反应,实现无害转化。当NO与 的物质的量之比为2∶1时,写出发生反应的化学方程式:
的物质的量之比为2∶1时,写出发生反应的化学方程式:(8)大气污染物中的氮氧化物地可用NaOH吸收,先后发生如下反应:
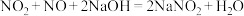 ;
; 。
。若33.6 mL(标况下)氮氧化物(只含NO和
 )与V mL0.1 mol/L NaOH溶液恰好完全反应,则
)与V mL0.1 mol/L NaOH溶液恰好完全反应,则
您最近一年使用:0次
解题方法
3 . 氮元素的单质和常见化合物在工、农业生产中用途广泛。
(1)在催化剂加热的条件下,氨气可以被二氧化氮氧化,生成氮气和水。书写该反应的化学方程式_______ 。
(2)_______ 实验证明氨气极易溶于水。通常用 _______ (填名称)干燥氨气。
(3)铵盐大多在农业上用作化肥,固体NH4Cl与固体Ca(OH)2加热反应可生成氨气,其化学方程式为_______ 。
(4)如图为合成氨以及氨氧化制硝酸的流程示意图。
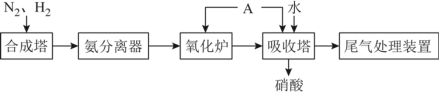
写出氧化炉中的化学反应方程式_______ 。通常采用_______ 方法在氨分离器中将氨气分离出来。向氧化炉和吸收塔中通入的A是 _______ 。
(1)在催化剂加热的条件下,氨气可以被二氧化氮氧化,生成氮气和水。书写该反应的化学方程式
(2)
(3)铵盐大多在农业上用作化肥,固体NH4Cl与固体Ca(OH)2加热反应可生成氨气,其化学方程式为
(4)如图为合成氨以及氨氧化制硝酸的流程示意图。

写出氧化炉中的化学反应方程式
您最近一年使用:0次
解题方法
4 . 实验室制取氨气并验证其化学性质和用途,下列装置对应的说法错误的是
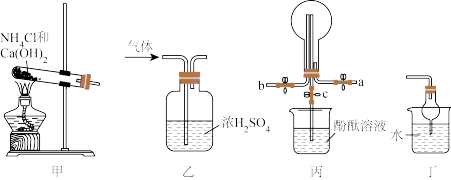

| A.可利用装置甲制备氨气 | B.可利用装置乙干燥氨气 |
| C.可利用装置丙收集氨气并进行喷泉实验 | D.可利用装置吸收氨气并防倒吸 |
您最近一年使用:0次
2022-07-15更新
|
149次组卷
|
3卷引用:山西省长治市2021-2022学年高一下学期期末联合考化学试题
5 . 氨气是重要的化工原料,在工农业生产中有重要用途。
(1)工业上合成氨的化学方程式是_______ 。
(2)氨气极易溶于水,这个性质可以利用如图装置进行喷泉实验。
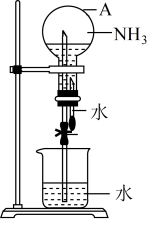
①仪器A的名称是_______ 。
②引发喷泉实验的操作是_______ 。
(3)某化学兴趣小组设计了如图所示的实验装置模拟工业生产制备少量硝酸。
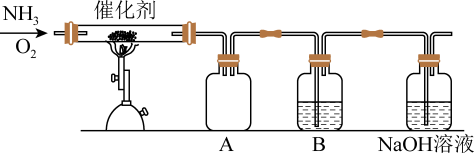
①实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700°C以上,由此可知该反应是_______ (填“吸热”或“放热”)发应。
②B中试剂为_______ 。
③控制氨气和氧气的比例是制备硝酸的关键。当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟,白烟的化学式是_______ 。
④欲使氨气尽可能完全转化为硝酸,理论上n(NH3):n(O2)的最佳比例为_______ 。
(1)工业上合成氨的化学方程式是
(2)氨气极易溶于水,这个性质可以利用如图装置进行喷泉实验。

①仪器A的名称是
②引发喷泉实验的操作是
(3)某化学兴趣小组设计了如图所示的实验装置模拟工业生产制备少量硝酸。

①实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700°C以上,由此可知该反应是
②B中试剂为
③控制氨气和氧气的比例是制备硝酸的关键。当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟,白烟的化学式是
④欲使氨气尽可能完全转化为硝酸,理论上n(NH3):n(O2)的最佳比例为
您最近一年使用:0次
2022-05-18更新
|
256次组卷
|
2卷引用:河北省张家口市张北县第一中学2021-2022学年高一下学期第二次阶段测试化学试j题
6 . 硅及其化合物用途非常广泛。常用作干燥剂的多孔硅酸是由硅酸盐(例如NaSiO3)的水溶液中加入相应的酸生成溶解度较小的硅酸分子,放置一段时间后,硅酸分子逐渐。聚合形成硅酸溶胶,进一步处理可得多孔硅胶。多孔硅胶对许多气体如乙醚蒸气筝有吸附作用,设计一实验证明硅胶的吸附性,请写出实验步骤、现象及解释_______ 。
您最近一年使用:0次
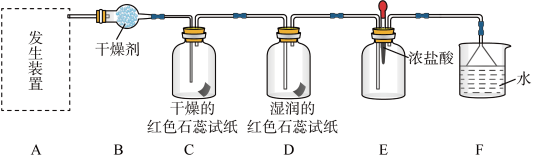
7 . 某化学兴趣小组为了制取并探究氨气性质,按下列装置 部分夹持装置已略去
部分夹持装置已略去 进行实验。(制取氨气的反应原理:
进行实验。(制取氨气的反应原理: )
)
【实验探究】
(1)A装置N元素的化合价是_______ 该反应是否是氧化还原反应:_______ 。
(2)用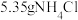 固体与足量
固体与足量 反应,最多可制得标准状况下氨气的体积为
反应,最多可制得标准状况下氨气的体积为__________ L。 的摩尔质量为
的摩尔质量为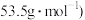
(3)气体通过C、D装置时,试纸颜色会发生变化的是D,原因是:___________________ .
(4)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入 滴浓盐酸,可观察到的现象是
滴浓盐酸,可观察到的现象是___________________ .
(5)如果氨气泄漏,你应采取的急救措施是:___________________ .
(6)检验氨气是否收集满的方法是__________________________________ 
【拓展应用】
(7)某同学用下图所示装置进行氨气的性质实验,根据烧瓶内产生红色喷泉的现象,说明氨气具有_______ 性质 填序号
填序号 。
。

 还原性
还原性  极易溶于水
极易溶于水  与水反应生成碱性物质
与水反应生成碱性物质
(8)氨气的用途很广。如可用氨气处理二氧化氮: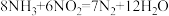 该反应中氨气体现
该反应中氨气体现_______  填“氧化性”或“还原性”
填“氧化性”或“还原性” 。
。
(9)请你列举出氨气的一种用途_________________________ 。
 部分夹持装置已略去
部分夹持装置已略去 进行实验。(制取氨气的反应原理:
进行实验。(制取氨气的反应原理: )
) 
【实验探究】
(1)A装置N元素的化合价是
(2)用
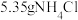 固体与足量
固体与足量 反应,最多可制得标准状况下氨气的体积为
反应,最多可制得标准状况下氨气的体积为 的摩尔质量为
的摩尔质量为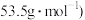
(3)气体通过C、D装置时,试纸颜色会发生变化的是D,原因是:
(4)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入
 滴浓盐酸,可观察到的现象是
滴浓盐酸,可观察到的现象是(5)如果氨气泄漏,你应采取的急救措施是:
(6)检验氨气是否收集满的方法是

【拓展应用】
(7)某同学用下图所示装置进行氨气的性质实验,根据烧瓶内产生红色喷泉的现象,说明氨气具有
 填序号
填序号 。
。
 还原性
还原性  极易溶于水
极易溶于水  与水反应生成碱性物质
与水反应生成碱性物质 (8)氨气的用途很广。如可用氨气处理二氧化氮:
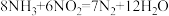 该反应中氨气体现
该反应中氨气体现 填“氧化性”或“还原性”
填“氧化性”或“还原性” 。
。(9)请你列举出氨气的一种用途
您最近一年使用:0次
名校
解题方法
8 . (1)硫酸在下列用途或反应中各表现的性质是(用字母填在横线上)
A.难挥发性 B.酸性 C.吸水性 D.脱水性 E.强氧化性 F.催化作用
①敞口放置浓硫酸时,质量增加_______ ,
②浓硫酸使润湿蓝色石蕊试纸先变红后又变黑___________ ,
③浓硫酸与铜反应_____________ ;
(2)氮氧化物也是造成酸雨的成分之一,治理汽车尾气中NO和CO的一种方法是:在汽车的排气管上装一个催化转换装置,使NO和CO反应,生成无毒气体,反应的化学方程式是_________________________________________ ;
(3)喷泉是一种常见的自然现象,其产生的原因是存在压强差;提供如图的装置,请说明引发喷泉的方法____________________________________ ;

(4)为了测定某铜银合金的成分,将17.2 g合金溶于40 mL 12.25 mol/L的浓硝酸中,待合金完全溶解后,收集到3.36 L(标准状况下)气体(气体为NO和NO2混合气体),并测得溶液中c(H+)=1mol/L,假设反应后溶液的体积仍为40 mL,则合金中铜的质量分数为_______________ ( 保留两位有效数字),收集到的混合气体中NO与NO2的体积之比为___________ 。
A.难挥发性 B.酸性 C.吸水性 D.脱水性 E.强氧化性 F.催化作用
①敞口放置浓硫酸时,质量增加
②浓硫酸使润湿蓝色石蕊试纸先变红后又变黑
③浓硫酸与铜反应
(2)氮氧化物也是造成酸雨的成分之一,治理汽车尾气中NO和CO的一种方法是:在汽车的排气管上装一个催化转换装置,使NO和CO反应,生成无毒气体,反应的化学方程式是
(3)喷泉是一种常见的自然现象,其产生的原因是存在压强差;提供如图的装置,请说明引发喷泉的方法

(4)为了测定某铜银合金的成分,将17.2 g合金溶于40 mL 12.25 mol/L的浓硝酸中,待合金完全溶解后,收集到3.36 L(标准状况下)气体(气体为NO和NO2混合气体),并测得溶液中c(H+)=1mol/L,假设反应后溶液的体积仍为40 mL,则合金中铜的质量分数为
您最近一年使用:0次



