名校
解题方法
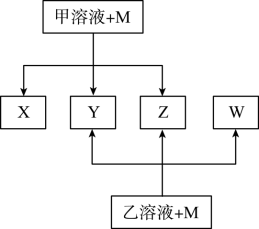
1 . 常温下,X是红棕色气体;Y能使澄清石灰水变浑浊但不能使品红溶液褪色。
②甲、乙是两种酸
③将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。
请完成下列空白:
(1)M的化学式为___________
(2)甲的浓溶液需盛放在棕色试剂瓶中,其原因是___________ (用化学方程式表示)。
(3)在X与H2O的反应中,被氧化的X与被还原的X的物质的量之比是___________ 。
(4)欲除去Y中混有的W,下列试剂可供选用的是___________。
(5)写出M与乙的浓溶液在加热条件下反应的化学方程式:___________ 。
(6)工业上运输甲、乙两种浓溶液可选用___________ (金属名称)制运输罐,所选用的金属能做运输罐的理由是___________ 。
②甲、乙是两种酸
③将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。
请完成下列空白:
(1)M的化学式为
(2)甲的浓溶液需盛放在棕色试剂瓶中,其原因是
(3)在X与H2O的反应中,被氧化的X与被还原的X的物质的量之比是
(4)欲除去Y中混有的W,下列试剂可供选用的是___________。
| A.品红溶液 | B.酸性高锰酸钾溶液 | C.氢氧化钠溶液 | D.饱和 溶液 溶液 |
(6)工业上运输甲、乙两种浓溶液可选用
您最近一年使用:0次
解题方法
2 . 图示分析是学习化学的一种重要方法,结合所给图示回答相关问题。
(1)下图是氮及其化合物的“价—类”二维图部分信息。

①X的化学式为________ 。
②图中关于 和
和 的相互转化,下列说法正确的是
的相互转化,下列说法正确的是________ (填标号)。
a.由 转化为
转化为 ,实现了氮的固定
,实现了氮的固定
b.工业上利用 与
与 反应制取
反应制取
c.不加入还原剂,也可实现 转化为
转化为
d.由硝酸转化成等物质的量的 时,消耗碳单质和铜单质的物质的量相同
时,消耗碳单质和铜单质的物质的量相同
(2) 、
、 是大气污染物的主要成分,
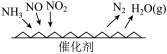
是大气污染物的主要成分, 催化还原氮氧化物是目前应用最广泛的烟气氮氧化物脱除技术,反应原理如图所示。若处理的污染物中
催化还原氮氧化物是目前应用最广泛的烟气氮氧化物脱除技术,反应原理如图所示。若处理的污染物中 与
与 的物质的量之比为1:1,则相应的化学方程式为
的物质的量之比为1:1,则相应的化学方程式为________ 。
(3)在微生物的作用下实现 转化,称为硝化过程。在碱性条件下,
转化,称为硝化过程。在碱性条件下, 被氧气氧化成
被氧气氧化成 的总反应的离子方程式为
的总反应的离子方程式为________ 。
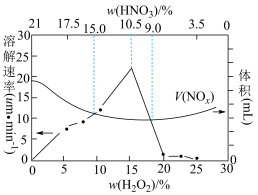
(4)硝酸可用作金属溶解剂。在不同浓度的 混合溶液中,金属溶解速率和生成
混合溶液中,金属溶解速率和生成 ,体积的变化如图。据图分析,混合溶液中
,体积的变化如图。据图分析,混合溶液中 的质量分数最佳为
的质量分数最佳为________ %,理由是________ 。
(1)下图是氮及其化合物的“价—类”二维图部分信息。

①X的化学式为
②图中关于
 和
和 的相互转化,下列说法正确的是
的相互转化,下列说法正确的是a.由
 转化为
转化为 ,实现了氮的固定
,实现了氮的固定b.工业上利用
 与
与 反应制取
反应制取
c.不加入还原剂,也可实现
 转化为
转化为
d.由硝酸转化成等物质的量的
 时,消耗碳单质和铜单质的物质的量相同
时,消耗碳单质和铜单质的物质的量相同(2)
 、
、 是大气污染物的主要成分,
是大气污染物的主要成分, 催化还原氮氧化物是目前应用最广泛的烟气氮氧化物脱除技术,反应原理如图所示。若处理的污染物中
催化还原氮氧化物是目前应用最广泛的烟气氮氧化物脱除技术,反应原理如图所示。若处理的污染物中 与
与 的物质的量之比为1:1,则相应的化学方程式为
的物质的量之比为1:1,则相应的化学方程式为
(3)在微生物的作用下实现
 转化,称为硝化过程。在碱性条件下,
转化,称为硝化过程。在碱性条件下, 被氧气氧化成
被氧气氧化成 的总反应的离子方程式为
的总反应的离子方程式为(4)硝酸可用作金属溶解剂。在不同浓度的
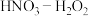 混合溶液中,金属溶解速率和生成
混合溶液中,金属溶解速率和生成 ,体积的变化如图。据图分析,混合溶液中
,体积的变化如图。据图分析,混合溶液中 的质量分数最佳为
的质量分数最佳为
您最近一年使用:0次
解题方法
3 . 请回答:
(1)①小苏打的化学式是___________ ;
②CO2的电子式是___________
(2)浓硝酸见光分解的化学方程式为___________ 。
(3)水浴加热银氨溶液与葡萄糖的混合液,可观察到的现象是___________ 。
(1)①小苏打的化学式是
②CO2的电子式是
(2)浓硝酸见光分解的化学方程式为
(3)水浴加热银氨溶液与葡萄糖的混合液,可观察到的现象是
您最近一年使用:0次
名校
4 . 下列实验能达到目的是
| 选项 | 实验目的 | 实验操作 |
| A | 验证炭与浓硝酸反应生成 | 向浓硝酸中插入红热的炭 |
| B | 判断反应后 是否沉淀完全 是否沉淀完全 | 将 溶液与 溶液与 溶液混合,反应后静置 溶液混合,反应后静置向上层清液中再滴入几滴  溶液 溶液 |
| C | 探究催化剂对 分解速率的影响 分解速率的影响 | 分别向2支试管中加入相同体积不同浓度的 溶液 溶液再向其中1支加入少量  |
| D | 探究 与 与 反应的限度 反应的限度 | 将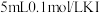 溶液与 溶液与 溶液混合 溶液混合充分反应后再滴入几滴  溶液 溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-07-12更新
|
182次组卷
|
2卷引用:山东省聊城市2022-2023学年高一下学期期末考试化学试题
解题方法
5 . 下列说法正确的是
| A.二氧化硫是导致酸雨、光化学烟雾的有害气体之一 |
| B.浓硝酸应保存在棕色试剂瓶中 |
| C.糖类、油脂、蛋白质都能发生水解 |
| D.石油的分馏、煤的气化和液化都属于化学变化 |
您最近一年使用:0次
6 . 下列反应的化学方程式书写正确的是
A.用石英砂制粗硅: |
B.氧化亚铁与硝酸反应: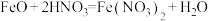 |
C.铜溶于热的浓硫酸: |
D.浓硝酸久置变黄: |
您最近一年使用:0次
名校
7 . 通过对实验现象的观察、分析推理得出结论是化学学习的方法之一。下列对实验现象的解释正确的是
| 选项 | 实验现象 | 解释 |
| A | 向KI淀粉溶液中通入Cl2,溶液变蓝 | Cl2能与淀粉发生显色反应 |
| B | 加热分别盛有氯化铵和碘的两支试管,试管底部固体均减少 | 二者均发生升华 |
| C | 浓硝酸在光照条件下变黄 | 浓硝酸不稳定,生成的有色产物能溶于硝酸 |
| D | Fe与稀HNO3、稀H2SO4反应均有气泡产生 | Fe与两种酸均发生置换反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-07-08更新
|
139次组卷
|
2卷引用:广东省汕尾市2022-2023学年高一下学期期末教学质量监测化学试题
名校
8 . 硝酸是重要的化工原料,工业生产硝酸的流程如图所示:
CH4 H2
H2 NH3
NH3 NO
NO NO2
NO2 HNO3
HNO3
已知:ⅰ.HNO3受热易分解为NO2、O2等物质;
ⅱ.原子利用率= 。
。
(1)步骤Ⅰ:制氢
反应器中初始反应的生成物有两种,且物质的量之比为1:4,甲烷与水蒸气在一定条件下发生上述反应的化学方程式是_______ 。
(2)步骤Ⅱ:合成氨
①NH3的电子式为_______ 。
②工业合成氨的化学方程式是_______ 。
③用如图所示装置实现电化学合成氨。产生NH3的电极反应式是_______ 。

(3)步骤Ⅲ:氨氧化制NO的反应中,每生成1.5 mol H2O时电子转移数为_______ mol。
(4)步骤Ⅲ和步骤Ⅳ均是放热反应,步骤Ⅴ在反应前需将NO2冷却。
①冷却NO2有利于提高HNO3产率,原因是_______ (写出一点即可)。
②步骤Ⅴ的化学方程式是_______ 。
CH4
 H2
H2 NH3
NH3 NO
NO NO2
NO2 HNO3
HNO3已知:ⅰ.HNO3受热易分解为NO2、O2等物质;
ⅱ.原子利用率=
 。
。(1)步骤Ⅰ:制氢
反应器中初始反应的生成物有两种,且物质的量之比为1:4,甲烷与水蒸气在一定条件下发生上述反应的化学方程式是
(2)步骤Ⅱ:合成氨
①NH3的电子式为
②工业合成氨的化学方程式是
③用如图所示装置实现电化学合成氨。产生NH3的电极反应式是

(3)步骤Ⅲ:氨氧化制NO的反应中,每生成1.5 mol H2O时电子转移数为
(4)步骤Ⅲ和步骤Ⅳ均是放热反应,步骤Ⅴ在反应前需将NO2冷却。
①冷却NO2有利于提高HNO3产率,原因是
②步骤Ⅴ的化学方程式是
您最近一年使用:0次
2023-05-13更新
|
234次组卷
|
2卷引用:江西省上犹中学2022-2023学年高一下学期6月期末考试化学试题
名校
9 . 氮是地球上含量丰富的元素。氮及其化合物在一定条件下的转化关系如图:
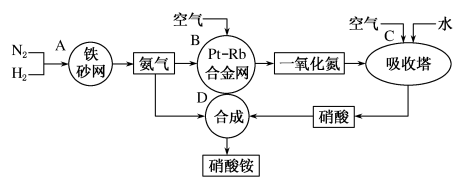
(1)容器B中的合金网采用网状结构的目的是_______ ,该处发生反应的化学方程式为_______ 。
(2)同温同压下,理论上容器B和容器C消耗的空气体积之比为_______ 。
(3)实验室中浓硝酸一般保存在棕色试剂瓶中,并放置于阴凉处,请解释原因:_______ 。
(4)常温下,Zn与稀硝酸反应生成硝酸铵的离子方程式为_______ ,该反应中稀硝酸表现出的性质是_______ 。
(5)工业制硝酸时尾气中含有的 (NO、
(NO、 )常用碱液吸收。
)常用碱液吸收。
①写出 与NaOH溶液反应生成两种氮的含氧酸盐的化学方程式:
与NaOH溶液反应生成两种氮的含氧酸盐的化学方程式:_______ 。
②将硝酸尾气中的NO,通入过量的NaOH溶液中充分反应后无气体剩余,则 中的x的取值范围是
中的x的取值范围是_______ (用含x的式子表示,已知: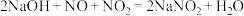 )。
)。

(1)容器B中的合金网采用网状结构的目的是
(2)同温同压下,理论上容器B和容器C消耗的空气体积之比为
(3)实验室中浓硝酸一般保存在棕色试剂瓶中,并放置于阴凉处,请解释原因:
(4)常温下,Zn与稀硝酸反应生成硝酸铵的离子方程式为
(5)工业制硝酸时尾气中含有的
 (NO、
(NO、 )常用碱液吸收。
)常用碱液吸收。①写出
 与NaOH溶液反应生成两种氮的含氧酸盐的化学方程式:
与NaOH溶液反应生成两种氮的含氧酸盐的化学方程式:②将硝酸尾气中的NO,通入过量的NaOH溶液中充分反应后无气体剩余,则
 中的x的取值范围是
中的x的取值范围是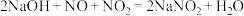 )。
)。
您最近一年使用:0次
2023-04-28更新
|
204次组卷
|
2卷引用:江西省赣州市大余中学2022-2023学年高一下学期6月期末考试化学试题



