1 . 实验室拟采用如下装置制备 并研究
并研究 的相关性质:
的相关性质: 易溶于乙醇,回答下列问题:
易溶于乙醇,回答下列问题:
(1)写出浓硫酸和亚硫酸钠反应制取 的化学方程式
的化学方程式________ 。
(2)干燥管中的 的作用是
的作用是________ ,装置Ⅱ中的干燥管作用是________ 。
(3)反应开始后,观察到装置Ⅰ中品红溶液(测得pH=3)迅速褪色,查询资料可知: 通入水中存在如下反应:
通入水中存在如下反应: ;
; ,通过分析上述现象,推测使品红水溶液褪色的微粒不可能为
,通过分析上述现象,推测使品红水溶液褪色的微粒不可能为 ,原因是
,原因是________ 。
(4)造成品红水溶液褪色的微粒可能是i, ;ii.
;ii. ;iii.
;iii. 。将上述装置Ⅰ中的品红水溶液换成品红乙醇溶液,重复实验,观察到溶液红色不褪色,证明
。将上述装置Ⅰ中的品红水溶液换成品红乙醇溶液,重复实验,观察到溶液红色不褪色,证明 不可能使品红水溶液褪色,其原因是
不可能使品红水溶液褪色,其原因是________ 。
(5)继续设计实验验证 、
、 对品红的漂白性:
对品红的漂白性:
设计实验c、d的目的是________ 。结合(4)、(5)的实验现象推测: 使品红水溶液褪色时起主要作用的微粒是
使品红水溶液褪色时起主要作用的微粒是________ 。
 并研究
并研究 的相关性质:
的相关性质:
 易溶于乙醇,回答下列问题:
易溶于乙醇,回答下列问题:(1)写出浓硫酸和亚硫酸钠反应制取
 的化学方程式
的化学方程式(2)干燥管中的
 的作用是
的作用是(3)反应开始后,观察到装置Ⅰ中品红溶液(测得pH=3)迅速褪色,查询资料可知:
 通入水中存在如下反应:
通入水中存在如下反应: ;
; ,通过分析上述现象,推测使品红水溶液褪色的微粒不可能为
,通过分析上述现象,推测使品红水溶液褪色的微粒不可能为 ,原因是
,原因是(4)造成品红水溶液褪色的微粒可能是i,
 ;ii.
;ii. ;iii.
;iii. 。将上述装置Ⅰ中的品红水溶液换成品红乙醇溶液,重复实验,观察到溶液红色不褪色,证明
。将上述装置Ⅰ中的品红水溶液换成品红乙醇溶液,重复实验,观察到溶液红色不褪色,证明 不可能使品红水溶液褪色,其原因是
不可能使品红水溶液褪色,其原因是(5)继续设计实验验证
 、
、 对品红的漂白性:
对品红的漂白性:
| 试管中的液体(浓度均相同) | 现象 |
a. 溶液(pH=10) 溶液(pH=10) | 溶液立即褪色 | |
b. 溶液(pH约为5) 溶液(pH约为5) | 溶液立即变浅,约10s后完全褪色 | |
| c.NaOH溶液(pH=10) | 红色溶液不褪色 | |
d.pH=3的 溶液 溶液 | 红色溶液不褪色 |
 使品红水溶液褪色时起主要作用的微粒是
使品红水溶液褪色时起主要作用的微粒是
您最近一年使用:0次
2 . 某学习小组在实验室制备SO2,并进行相关实验探究。请回答下列问题:
(1)实验室中利用Na2SO3固体和浓H2SO4制备SO2的化学方程式为_______ 。
(2)将一只充满SO2的试管倒扣到水槽中,观察到试管中液面上升且试管中剩余少量气体。上述实验现象不能证明SO2与水发生了反应,原因是_______ 。
(3)为了证明SO2与水发生了反应,小组同学利用图甲所示的装置制备SO2并测定了SO2通入到水中溶液的pH的变化。

实验结束后,向锥形瓶溶液中滴加石蕊试液,溶液显红色,请结合化学用语 表述该现象原因: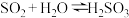 、
、_______ 。
(4)将气体换成CO2后按照图甲的装置重复实验,得到了SO2与CO2溶于水过程中pH随时间变化的曲线图(图乙),则曲线②为_______ (填化学式)溶于水的过程,其理由是_______ 。(已知常温下: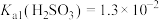 ,
,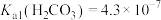 )
)

(5)某小组同学拟研究温度对SO2水溶液pH的影响,实验前该小组同学对实验结果进行了理论预测。
取出(3)中实验结束后的锥形瓶敞口进行加热,并利用数字传感器测定溶液pH随温度的变化(忽略水的电离对pH的影响)。实验结果表明:两种原因同时存在,其中原因ii起主导作用。
(6)基于上述实验,小组同学猜想温度变化时Na2SO3溶液的pH也会因Na2SO3发生氧化还原反应而发生改变,为验证猜想,小组同学进行了如下实验:
(1)实验室中利用Na2SO3固体和浓H2SO4制备SO2的化学方程式为
(2)将一只充满SO2的试管倒扣到水槽中,观察到试管中液面上升且试管中剩余少量气体。上述实验现象不能证明SO2与水发生了反应,原因是
(3)为了证明SO2与水发生了反应,小组同学利用图甲所示的装置制备SO2并测定了SO2通入到水中溶液的pH的变化。

实验结束后,向锥形瓶溶液中滴加石蕊试液,溶液显红色,请结合
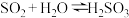 、
、(4)将气体换成CO2后按照图甲的装置重复实验,得到了SO2与CO2溶于水过程中pH随时间变化的曲线图(图乙),则曲线②为
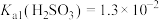 ,
,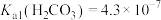 )
)
(5)某小组同学拟研究温度对SO2水溶液pH的影响,实验前该小组同学对实验结果进行了理论预测。
| 预测 | 原因依据 |
| 预测1:pH随温度升高而升高 | 原因i: |
| 预测2:pH随温度升高而降低 | 原因ii:H2SO3被空气中O2氧化成H2SO4,c(H+)增大 |
(6)基于上述实验,小组同学猜想温度变化时Na2SO3溶液的pH也会因Na2SO3发生氧化还原反应而发生改变,为验证猜想,小组同学进行了如下实验:
| 实验步骤 | 实验现象(结果) | 结论 |
| 1.用pH传感器测定0.1 mol/LNa2SO3溶液从25℃升温到40℃,再降温至25℃过程中的pH变化 | 终末时刻pH | 结合步骤1和2的实验结果,可推知猜想成立。 |
| 2.分别取始末时刻的溶液,加入 | 均产生白色沉淀,终末时刻产生的沉淀比起始多 |
您最近一年使用:0次
名校
解题方法
3 . 实验、类比、推理是化学学习的重要方法。某课外活动小组根据Mg与CO2的反应,用如图所示装置探究Mg与SO2的反应,并探究其产物成分。

(1)写出A中制备SO2的化学方程式:___________ 。
(2)装置B的作用之一是观察SO2的生成速率,为保证实验的严谨性其中的液体最好选择___________ (填序号)。
a.饱和 溶液 b.饱和
溶液 b.饱和 溶液 c.饱和
溶液 c.饱和 溶液 d.浓硫酸
溶液 d.浓硫酸
(3)补充完成D中的装置图并注明装置内选用的试剂。___________
(4)依据Mg与CO2的反应,三位同学对Mg与SO2反应的产物提出不同假设,并将装置C中玻璃管内固体产物加入如下图所示的装置a中大试管,进一步设计实验探究Mg与SO2反应的产物,若固体产物只有两种,依据充分反应后的现象,完成下列表格:

为进一步验证假设③中MgS的存在,可将b中试剂换成___________ 。(填试剂的化学式)

(1)写出A中制备SO2的化学方程式:
(2)装置B的作用之一是观察SO2的生成速率,为保证实验的严谨性其中的液体最好选择
a.饱和
 溶液 b.饱和
溶液 b.饱和 溶液 c.饱和
溶液 c.饱和 溶液 d.浓硫酸
溶液 d.浓硫酸(3)补充完成D中的装置图并注明装置内选用的试剂。
(4)依据Mg与CO2的反应,三位同学对Mg与SO2反应的产物提出不同假设,并将装置C中玻璃管内固体产物加入如下图所示的装置a中大试管,进一步设计实验探究Mg与SO2反应的产物,若固体产物只有两种,依据充分反应后的现象,完成下列表格:

| 假设 | a中现象 | b中现象 |
| ① | 固体不完全溶解,无气泡产生 | 溶液不褪色 |
| ② | 固体不完全溶解,且有气泡产生 | 溶液褪色 |
| ③MgO和MgS | 固体完全溶解,且有气泡产生 |
您最近一年使用:0次
2021-11-09更新
|
345次组卷
|
2卷引用:广东省惠州市第一中学2021-2022学年高二上学期第二次考试化学试题
名校
4 . 某研究性学习小组通过下列反应原理制备SO2并进行性质探究。反应原理为:Na2SO3(固)+H2SO4(浓)= Na2SO4 + SO2↑+ H2O

(1)根据上述原理制备并收集干燥SO2的实验装置连接顺序为________________ 。(填接头序号)
(2)D中盛装的试剂为_________________ 。
(3)甲同学用注射器吸取纯净的SO2并结合装置G进行SO2的性质实验,若X是Na2S溶液,其目的是检验SO2的_____________ ,可观察到的现象_________ 。

(4)实验1:乙同学将溶液X换为浓度均为0.1mol/L Fe(NO3)3和BaCl2的混合溶液(已经除去溶解氧),通入少量SO2后观察到烧杯产生白色沉淀,乙同学认为白色沉淀为BaSO4,为探究白色沉淀的成因,他继续进行如下实验验证:(已知:0.1mol/L Fe(NO3) 3的pH=2)

(1)根据上述原理制备并收集干燥SO2的实验装置连接顺序为
(2)D中盛装的试剂为
(3)甲同学用注射器吸取纯净的SO2并结合装置G进行SO2的性质实验,若X是Na2S溶液,其目的是检验SO2的

(4)实验1:乙同学将溶液X换为浓度均为0.1mol/L Fe(NO3)3和BaCl2的混合溶液(已经除去溶解氧),通入少量SO2后观察到烧杯产生白色沉淀,乙同学认为白色沉淀为BaSO4,为探究白色沉淀的成因,他继续进行如下实验验证:(已知:0.1mol/L Fe(NO3) 3的pH=2)
实验 | 操作 | 现象 | 结论和解释 |
2 | 将SO2通入0.1mol/L | 产生白色沉淀 | Fe3+能氧化H2SO3 |
3 | 将SO2通入 | 产生白色沉淀 | 酸性条件NO3-能将H2SO3氧化为SO42- |
您最近一年使用:0次
2018-01-06更新
|
514次组卷
|
2卷引用:广东省深圳市高级中学2017-2018学年高二上学期期中考试化学试题
解题方法
5 . 下列实验过程可以达到实验目的的是( )
| 选项 | 实验目的 | 实验过程 |
| A | 配制Fe(NO3)2溶液 | 将Fe(NO3)2·9H2O溶于较浓硝酸,然后加水稀释 |
| B | 探究SO2的漂白性 | 向盛有2mL黄色氯化铁溶液的试管中通入SO2,观察颜色变化 |
| C | 探究AgBr、AgI的溶度积大小 | 向2支盛有2mL不同浓度NaBr、NaI溶液的试管中分别滴入2滴相同浓度的AgNO3稀溶液,观察实验现象 |
| D | 探究催化剂对化学反应速率的影响 | 向2支试管中分别加入2mL0.01mol· L-1 KMnO4溶液,一支中加小粒MnSO4固体,然后2支试管中同时加入2mL0.1mol·L-1H2C2O4溶液,比较褪色时间快慢 |
A.A  | B.B  | C.C  | D.D |
您最近一年使用:0次
2020-01-21更新
|
562次组卷
|
3卷引用:广东省广州市广大附中、广外2020-2021学年高二上学期期中考试化学试题
名校
解题方法
6 . 下列实验装置不能达到相应实验目的的是
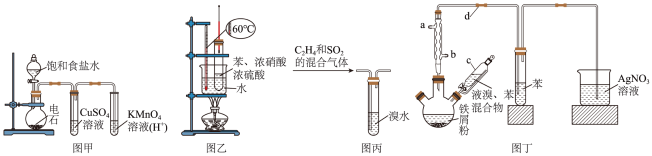
A.图甲证明乙炔可使酸性 溶液褪色 溶液褪色 |
| B.图乙用于实验室制硝基苯 |
C.图丙除去 中的 中的 |
D.图丁制备溴苯并验证有 产生 产生 |
您最近一年使用:0次
2023-05-19更新
|
178次组卷
|
2卷引用:广东省深圳市7校联考2023-2024学年高二下学期4月期中考试化学试题
7 . 按图装置进行实验。将稀硫酸全部加入Ⅰ中的试管,关闭活塞。下列说法正确的是
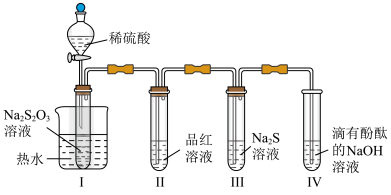
A.Ⅰ中试管内的反应,体现 的氧化性 的氧化性 | B.Ⅱ中品红溶液褪色,体现 的还原性 的还原性 |
| C.在Ⅰ和Ⅲ的试管中,都出现了浑浊现象 | D.撤掉水浴,重做实验,Ⅳ中红色更快褪去 |
您最近一年使用:0次
2023-07-04更新
|
9521次组卷
|
20卷引用:广东省阳江市2023-2024学年高二上学期10月月考化学试题
广东省阳江市2023-2024学年高二上学期10月月考化学试题2023年高考广东卷化学真题(已下线)2023年广东卷高考真题变式题(选择题6-10)(已下线)实验02 定性与定量研究影响化学反应速率的因素-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)广东省广州市培正中学等三校联考2023-2024学年高一下学期4月期中检测化学试题(已下线)第12讲 硫及其化合物吉林省长春市第五中学2022-2023学年高一下学期期末考试化学试题福建省厦门第一中学2023-2024学年高三暑期复习检测化学试题黑龙江省双鸭山市第一中学2023-2024学年高三上学期开学考试化学试题(已下线)考点15 硫及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)黑龙江省大庆市东风中学2023-2024学年高三上学期适应性考试化学试题(已下线)考点44 化学实验基础(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点3 物质的制备与性质实验 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)河南省洛阳市新安县第一高级中学2023-2024学年高一上学期致远班10月月考化学试题中国人民大学附属中学2023-2024学年高三下学期化学练习6四川省绵阳市南山中学2023-2024学年高一下学期期中考试 化学 湖南省长沙市一中2024届高三下学期高考适应性演练(三)化学试题湖南省长沙市第一中学2024届高三下学期三模化学试题2024年中国人民大学附属中学高三下学期高考化学模拟练习试卷(六)(已下线)湖南省永州市道县第一中学2023-2024学年高三下学期5月期中考试化学试题
名校
解题方法
8 . 某兴趣小组利用如图装置探究黑面包实验(蔗糖均为10 g),实验记录如下,下列说法错误的是
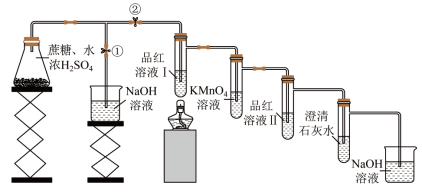

| 实验编号 | 实验条件 | 黑面包的高度/cm | 品红溶液Ⅰ | 品红溶液Ⅰ加热后 |  溶液 溶液 | 品红溶液Ⅱ | 澄清石灰水 | |
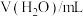 | V(浓 )/mL )/mL | |||||||
| 1 | 1 | 8 | 3.5 | 褪色 | 变红 | 颜色变浅 | 不变 | 变浑浊 |
| 2 | 1.5 | 4.7 | 褪色 | 变红 | 颜色变浅 | 不变 | 变浑浊 | |
| 3 | 2 | 3.8 | 褪色 | 变红 | 褪色 | 不变 | 变浑浊 | |
A.该装置可以防止过量的 污染空气 污染空气 |
B.品红溶液Ⅱ是为了检验 是否除尽 是否除尽 |
C.根据实验3的实验现象不能推出生成物中含有 |
D.根据实验3的现象分析,C与浓 反应产生的 反应产生的 气体较多 气体较多 |
您最近一年使用:0次
2023-04-19更新
|
122次组卷
|
2卷引用:广东省部分学校2022-2023学年高二下学期4月联考化学试题
9 .  的防治与利用对环境保护意义重大。
的防治与利用对环境保护意义重大。
(1)实验室用浓硫酸和 制取
制取 的化学方程式为
的化学方程式为___________ 。
(2)实验室制取干燥的 时,收集
时,收集 所需装置的接口连接顺序为
所需装置的接口连接顺序为___________ (按气流方向,填仪器接口的字母编号)。

(3)用下图装置探究 的氧化性或还原性。
的氧化性或还原性。

限选试剂:NaOH溶液、稀 、
、 溶液、
溶液、 溶液、淀粉-KI溶液、新制
溶液、淀粉-KI溶液、新制 溶液。步骤
溶液。步骤
(4)某小组利用下列装置测定空气中 的含量。
的含量。

已知该反应的化学方程式为:
若空气流速为 ,当观察到
,当观察到___________ 时,结束计时,测定耗时bmin。假定样品中的 可被溶液充分吸收,该空气样品中
可被溶液充分吸收,该空气样品中 的含量是
的含量是___________  。
。
 的防治与利用对环境保护意义重大。
的防治与利用对环境保护意义重大。(1)实验室用浓硫酸和
 制取
制取 的化学方程式为
的化学方程式为(2)实验室制取干燥的
 时,收集
时,收集 所需装置的接口连接顺序为
所需装置的接口连接顺序为
(3)用下图装置探究
 的氧化性或还原性。
的氧化性或还原性。
限选试剂:NaOH溶液、稀
 、
、 溶液、
溶液、 溶液、淀粉-KI溶液、新制
溶液、淀粉-KI溶液、新制 溶液。步骤
溶液。步骤| 步骤 | 现象 | 结论 |
用注射器将新制 溶液注入充满 溶液注入充满 的烧瓶中 的烧瓶中 | 产生乳白色浑浊 |  具有① 具有① |
用注射器将② 的烧瓶中 的烧瓶中 | ③ |  具有还原性 具有还原性反应的离子方程式为④ |
 的含量。
的含量。
已知该反应的化学方程式为:

若空气流速为
 ,当观察到
,当观察到 可被溶液充分吸收,该空气样品中
可被溶液充分吸收,该空气样品中 的含量是
的含量是 。
。
您最近一年使用:0次
名校
10 . 由下列实验现象一定能得出相应结论的是
| 装置 | A |  | B | 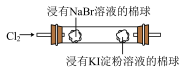 |
| 现象 | ①中无明显现象;②中产生浑浊 | 左边棉球变黄,右边棉球变蓝 | ||
| 结论 | 热稳定性:Na2CO3>NaHCO3 | 氧化性:Cl2>Br2>I2 | ||
| 装置 | C |  | D | 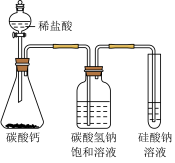 |
| 现象 | a中产生灰白色固体;b中溶液褪色 | 锥形瓶中产生大量气泡,试管出现浑浊 | ||
| 结论 | 在此条件下铜与浓硫酸发生氧化还原反应,但未生成硫酸铜 | 元素的非金属性Cl>C>Si |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-10-22更新
|
282次组卷
|
3卷引用:广东省惠州市第一中学、珠海一中2023-2024学年高二上学期10月惠珠联考化学试题




