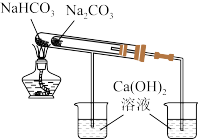
1 . 已知SO2易溶于水和乙醇,常用作漂白剂和还原剂。某实验小组用如下装置,制备SO2并探究其性质。回答下列问题:

I.SO2制取、净化
(1)盛装70%硫酸的仪器名称为_______ ,装置B中浓硫酸的作用是_______ 。
II.SO2漂白性探究
(2)实验中观察到:装置C中溶液红色没有褪去,装置D中溶液红色褪去,由此可得出的结论是_______ 。
(3)为了进一步探究使品红褪色的主要微粒,进行如下系列实验:
综合上述实验推知,SO2水溶液使品红褪色时起主要作用的微粒是_______ (填微粒符号)。
III.SO2还原性探究
E中观察到溶液先由黄色变成红棕色,放置较长时间后溶液变成浅绿色。甲、乙两位同学对此现象进行如下探究:
(4)甲同学猜想红棕色物质是Fe(OH)3胶体,验证是否生成Fe(OH)3胶体的实验方法为_______ ,经实验验证无Fe(OH)3胶体。于是甲同学通过查阅文献得知 (红棕色)。
(红棕色)。
(5)乙同学猜想久置后溶液变成浅绿色,是因为Fe3+与SO2发生氧化还原反应,其离子方程式为_______ ,经实验验证存在Fe2+。
(6)综合甲、乙两位同学的实验结论,应用化学反应速率和化学平衡移动原理解释E中溶液颜色变化的原因_______ 。

I.SO2制取、净化
(1)盛装70%硫酸的仪器名称为
II.SO2漂白性探究
(2)实验中观察到:装置C中溶液红色没有褪去,装置D中溶液红色褪去,由此可得出的结论是
(3)为了进一步探究使品红褪色的主要微粒,进行如下系列实验:
| 实验 | 试管中的溶液 | 实验操作 | 实验现象 |
| a | 2 mL0.1 mol/L SO2 | 滴入1滴0.1%品红溶液 | 溶液变红后逐渐变浅,约90 s后完全褪色 |
| b | 2 mL0.1 mol/L NaHSO3 | 溶液变红后立即变浅,约15s后完全褪色 | |
| c | 2 mL0.1 mol/L Na2SO3 | 溶液变红后立即褪色 |
III.SO2还原性探究
E中观察到溶液先由黄色变成红棕色,放置较长时间后溶液变成浅绿色。甲、乙两位同学对此现象进行如下探究:
(4)甲同学猜想红棕色物质是Fe(OH)3胶体,验证是否生成Fe(OH)3胶体的实验方法为
 (红棕色)。
(红棕色)。(5)乙同学猜想久置后溶液变成浅绿色,是因为Fe3+与SO2发生氧化还原反应,其离子方程式为
(6)综合甲、乙两位同学的实验结论,应用化学反应速率和化学平衡移动原理解释E中溶液颜色变化的原因
您最近一年使用:0次
2 . 实验是学习化学的重要途径。下列装置或操作能达到实验目的的是
A | B | C | D |
|
|
|
|
比较 和 和 的热稳定性 的热稳定性 | 验证浓硫酸的脱水性、强氧化性 的漂白性、还原性 的漂白性、还原性 | 制取并收集干燥纯净的 | 用氢氧化钠标准液测定盐酸的浓度 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-05-29更新
|
138次组卷
|
2卷引用:贵州省黔东南苗族侗族自治州)2021-2022学年高二下学期期末联考化学试题
3 . 如图是铜与浓硫酸反应并验证其产物性质的装置图。请回答下列问题。
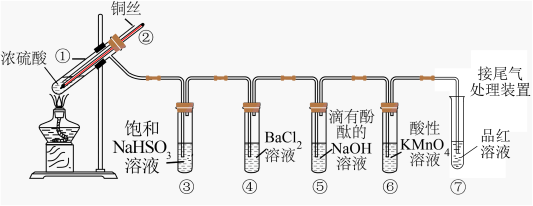
(1)试管①中发生反应的化学方程式为____ ;其中硫酸发生了____ (填“氧化”或“还原”)反应。
(2)一段时间后,④中溶液无明显现象,⑤⑥⑦溶液均褪色,试管⑤⑥⑦中的现象分别说明SO2的水溶液具有____ 、SO2具有____ 、漂白性。
(3)下列说法正确的是____ (填字母)。
a.上下移动铜丝可控制反应的发生与停止
b.反应结束后,从导管向装置中鼓入空气,使气体完全被吸收,防止污染
c.实验结束后,试管①中有白色固体出现,为确认白色固体为产物CuSO4,可立刻向试管①中加水,观察颜色
(4)充分反应后发现,铜丝与硫酸都有剩余,在此情况下,加入下列物质能使溶液中n(Cu2+)变大的是____ (填字母)。
a.HClb.Fe2O3c.KNO3
(5)反应停止后,待装置冷却,向试管④中加入氯水,产生白色沉淀,反应的离子方程式为____ 。
(6)为了测定尾气中SO2的含量,将尾气样品经过管道通入盛有400mL0.1mol·L-1酸性KMnO4溶液的密闭容器中。若管道中气体流量为aL·min-1,经过8min溶液恰好褪色,假定样品中SO2被充分吸收,该尾气样品中SO2的含量为____ g·L-1。(假设尾气中其他气体不与酸性KMnO4溶液反应)

(1)试管①中发生反应的化学方程式为
(2)一段时间后,④中溶液无明显现象,⑤⑥⑦溶液均褪色,试管⑤⑥⑦中的现象分别说明SO2的水溶液具有
(3)下列说法正确的是
a.上下移动铜丝可控制反应的发生与停止
b.反应结束后,从导管向装置中鼓入空气,使气体完全被吸收,防止污染
c.实验结束后,试管①中有白色固体出现,为确认白色固体为产物CuSO4,可立刻向试管①中加水,观察颜色
(4)充分反应后发现,铜丝与硫酸都有剩余,在此情况下,加入下列物质能使溶液中n(Cu2+)变大的是
a.HClb.Fe2O3c.KNO3
(5)反应停止后,待装置冷却,向试管④中加入氯水,产生白色沉淀,反应的离子方程式为
(6)为了测定尾气中SO2的含量,将尾气样品经过管道通入盛有400mL0.1mol·L-1酸性KMnO4溶液的密闭容器中。若管道中气体流量为aL·min-1,经过8min溶液恰好褪色,假定样品中SO2被充分吸收,该尾气样品中SO2的含量为
您最近一年使用:0次
2022-08-24更新
|
77次组卷
|
2卷引用:贵州省黔东南六校联盟2022-2023学年高二上学期期中联考化学试题
解题方法
4 . 某研究性学习小组为验证SO2的性质,设计的实验装置如图所示。

回答下列问题:
(1)装置A中发生反应的化学方程式为___ ;该装置中使用铜丝而不使用碎铜片的优点是___ 。
(2)甲同学认为可以省去装置B,其理由是___ 。若将装置B中的试剂换成品红溶液,则装置B中观察到的现象为___ ,体现了SO2的___ 性。
(3)装置D中的酸性高锰酸钾溶液参加反应的离子方程式为__ ,体现了SO2的____ 性,该装置还说明SO2有___ 。
(4)反应停止后,乙同学取装置C中的部分溶液,向其中滴加新制氯水,观察到有白色沉淀生成,相关反应的离子方程式为___ 。丙同学取装置C中的部分溶液,向其中通入一种无色气体,也观察到有白色沉淀生成,则该气体可能为__ (填化学式)。

回答下列问题:
(1)装置A中发生反应的化学方程式为
(2)甲同学认为可以省去装置B,其理由是
(3)装置D中的酸性高锰酸钾溶液参加反应的离子方程式为
(4)反应停止后,乙同学取装置C中的部分溶液,向其中滴加新制氯水,观察到有白色沉淀生成,相关反应的离子方程式为
您最近一年使用:0次
5 . 次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)在印染、医药以及原子能工业中应用广泛,已知次硫酸氢钠甲醛具有强还原性,且在120 ℃以上发生分解。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
步骤1:在烧瓶中(装置如图所示)加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH约为4,制得NaHSO3溶液。

步骤2:将装置A中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90 ℃下,反应约3 h,冷却至室温,抽滤。
步骤3:将滤液真空蒸发浓缩,冷却结晶,抽滤。
(1)仪器B的名称为__________ ,装置A中通入SO2的导管末端是多孔球泡,其作用是:__________________________________________ 。
(2)装置C的作用是________________ 。
(3)①步骤2中,应采用何种加热方式____________ ,优点是________________ ;
②冷凝管中回流的主要物质除H2O外还有__________ (填化学式)。
(4)步骤3中不在敞口容器中蒸发浓缩的原因是_____________________________ 。
(5)请写出步骤1中制取NaHSO3的化学方程式:_____________________________ 。
步骤1:在烧瓶中(装置如图所示)加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH约为4,制得NaHSO3溶液。

步骤2:将装置A中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90 ℃下,反应约3 h,冷却至室温,抽滤。
步骤3:将滤液真空蒸发浓缩,冷却结晶,抽滤。
(1)仪器B的名称为
(2)装置C的作用是
(3)①步骤2中,应采用何种加热方式
②冷凝管中回流的主要物质除H2O外还有
(4)步骤3中不在敞口容器中蒸发浓缩的原因是
(5)请写出步骤1中制取NaHSO3的化学方程式:
您最近一年使用:0次
名校
6 . Na2S2O3·5H2O在化学定量分析中常用作基准物质,实验室制备原理为:2Na2S+Na2CO3+4SO2 3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
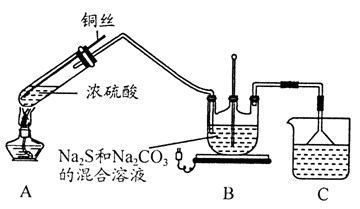
(1)A中发生的化学反应方程式为____________ 。
(2)C中所盛试剂可能是______ ;若要停止A中的化学反应,除取下酒精灯停止加热外,还可以采取的操作是_______ 。
(3)学生乙在加热A后,发现液面下的铜丝变黑。对黑色生成物该学生提出如下假设:
①可能是CuO ②可能是Cu2O ③可能是CuS
学生丙提出假设②一定不成立,依据是___________ ;该生用如下实验进一步验证黑色物质的组成:
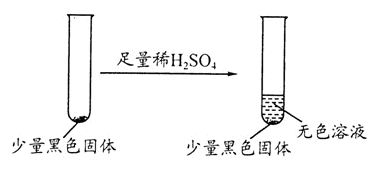
基于上述假设分析,黑色物质的组成为_____________ (填化学式)。
(4)实验室用Na2S2O3标液测量废水Ba2+的浓度,过程如下:
(已知:2 S2O32一+I2=S4O62—+2 I-)

①写出BaCrO4沉淀与过量HI、HCl溶液反应的离子方程式______________ ;
②以淀粉为指示剂,则到达滴定终点的现象是_______________ ;
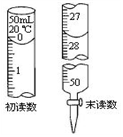
③若标液Na2S2O3的浓度0.0030mol·L-1,消耗该Na2S2O3溶液体积如图,则废水Ba2+的浓度为___ 。
 3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
(1)A中发生的化学反应方程式为
(2)C中所盛试剂可能是
(3)学生乙在加热A后,发现液面下的铜丝变黑。对黑色生成物该学生提出如下假设:
①可能是CuO ②可能是Cu2O ③可能是CuS
学生丙提出假设②一定不成立,依据是

基于上述假设分析,黑色物质的组成为
(4)实验室用Na2S2O3标液测量废水Ba2+的浓度,过程如下:
(已知:2 S2O32一+I2=S4O62—+2 I-)

①写出BaCrO4沉淀与过量HI、HCl溶液反应的离子方程式
②以淀粉为指示剂,则到达滴定终点的现象是
③若标液Na2S2O3的浓度0.0030mol·L-1,消耗该Na2S2O3溶液体积如图,则废水Ba2+的浓度为

您最近一年使用:0次
2016-12-09更新
|
1246次组卷
|
3卷引用:贵州省思南中学2016-2017学年高二下学期期末考试化学试题