名校
解题方法
1 . 如图1所示,某同学利用 和
和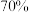 的
的 溶液制取
溶液制取 并探究其性质。
并探究其性质。
(1)装置B中发生反应的离子方程式为______________ 。
(2)装置C中的实验现象是______________ ,该实验现象说明 具有
具有_______ (填“氧化”或“还原”)性。
(3)装置 的目的是探究
的目的是探究 与品红作用的可逆性,请写出实验操作及现象:
与品红作用的可逆性,请写出实验操作及现象:______________ 。
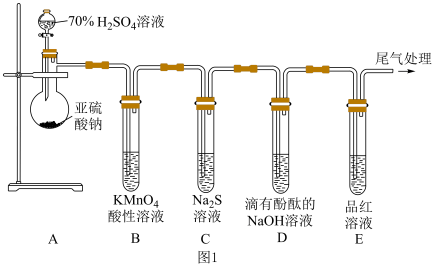
(4)探究 的酸性强于
的酸性强于 ,该同学用如图2所示装置达成实验目的。
,该同学用如图2所示装置达成实验目的。
①装置的连接顺序为_______ ,D中产生白色沉淀,则反应的离子方程式为_______ 。
纯净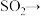 _______
_______ _______
_______ _______
_______ _______(填字母),
_______(填字母),
②可证明 的酸性强于
的酸性强于 的实验现象是
的实验现象是______________ 。
 和
和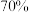 的
的 溶液制取
溶液制取 并探究其性质。
并探究其性质。
(1)装置B中发生反应的离子方程式为
(2)装置C中的实验现象是
 具有
具有(3)装置
 的目的是探究
的目的是探究 与品红作用的可逆性,请写出实验操作及现象:
与品红作用的可逆性,请写出实验操作及现象:(4)探究
 的酸性强于
的酸性强于 ,该同学用如图2所示装置达成实验目的。
,该同学用如图2所示装置达成实验目的。
①装置的连接顺序为
纯净
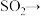 _______
_______ _______
_______ _______
_______ _______(填字母),
_______(填字母),②可证明
 的酸性强于
的酸性强于 的实验现象是
的实验现象是
您最近一年使用:0次
2024-01-13更新
|
373次组卷
|
3卷引用:河南省百师联考2023-2024学年高一上学期1月期末化学试题
名校
2 . 某化学小组为了证明二氧化硫和氯水的漂白性,设计了如图所示的实验装置:
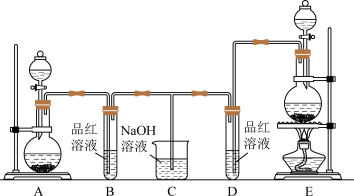
他们用亚硫酸钠和浓硫酸制备二氧化硫,用二氧化锰和浓盐酸制备氯气。
(1)用来制取氯气的装置是______ (填字母序号),反应中浓盐酸所表现出的化学性质是_____ 和_____ 。
(2)反应开始一段时间后,B、D试管中的品红溶液均褪色。停止通气后,再将B、D两个试管分别加热,_____ (填“B”或“D”')试管中无明显现象。
(3)装置C的主要作用是_____ 。
(4)该小组同学将两种气体混合后通入品红溶液中,发现漂白效果并不像预期的一样增强。查阅资料得知:两种气体混合,再与水反应可生成两种常见的酸,因而漂白作用减弱,该反应的化学方程式是_____ 。

他们用亚硫酸钠和浓硫酸制备二氧化硫,用二氧化锰和浓盐酸制备氯气。
(1)用来制取氯气的装置是
(2)反应开始一段时间后,B、D试管中的品红溶液均褪色。停止通气后,再将B、D两个试管分别加热,
(3)装置C的主要作用是
(4)该小组同学将两种气体混合后通入品红溶液中,发现漂白效果并不像预期的一样增强。查阅资料得知:两种气体混合,再与水反应可生成两种常见的酸,因而漂白作用减弱,该反应的化学方程式是
您最近一年使用:0次
2023-03-28更新
|
128次组卷
|
3卷引用:河南省洛阳市新安县第一高级中学2022-2023学年高一下学期阶段测试化学试题
3 . 用铜单质与浓硫酸反应制备 并验证
并验证 某些性质的装置如图所示:
某些性质的装置如图所示:

回答下列问题:
(1)a中用可抽拉的铜丝,最大的优点是_______ ,a中反应的化学方程式为_______ 。
(2)实验开始后,b、c中的现象分别是_______ 、_______ 。
(3)若d中试剂分别是 溶液、
溶液、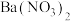 溶液或
溶液或 溶液时,其中没有沉淀生成的试剂是
溶液时,其中没有沉淀生成的试剂是_______ ,有 沉淀生成的试剂是
沉淀生成的试剂是_______ 。
(4)若去掉图中的棉团,可能的危害是_______ 。
(5)若实验结束时铜有剩余,为证明a中还存在稀硫酸,某同学取出少量溶液放入试管中,然后向试管中加入试剂X,根据实验现象可确定确实存在稀硫酸,则试剂X不可能是_______ (填序号)。
A. B.铁粉 C.
B.铁粉 C.
 并验证
并验证 某些性质的装置如图所示:
某些性质的装置如图所示:
回答下列问题:
(1)a中用可抽拉的铜丝,最大的优点是
(2)实验开始后,b、c中的现象分别是
(3)若d中试剂分别是
 溶液、
溶液、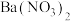 溶液或
溶液或 溶液时,其中没有沉淀生成的试剂是
溶液时,其中没有沉淀生成的试剂是 沉淀生成的试剂是
沉淀生成的试剂是(4)若去掉图中的棉团,可能的危害是
(5)若实验结束时铜有剩余,为证明a中还存在稀硫酸,某同学取出少量溶液放入试管中,然后向试管中加入试剂X,根据实验现象可确定确实存在稀硫酸,则试剂X不可能是
A.
 B.铁粉 C.
B.铁粉 C.
您最近一年使用:0次
名校
解题方法
4 . 摩尔盐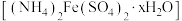 比一般的亚铁盐更稳定,是一种重要的定量分析化学试剂。回答下列问题:
比一般的亚铁盐更稳定,是一种重要的定量分析化学试剂。回答下列问题:
(1)制备摩尔盐采用的方法是先在封闭体系中利用铁和稀硫酸反应制备硫酸亚铁溶液,再用新制的硫酸亚铁溶液和硫酸按饱和溶液反应制得。配制硫酸按饱和溶液的蒸馏水,需经煮沸并迅速冷却后再使用,目的是___________ 。
(2)可以采用热重分析法测定摩尔盐样品中所含结晶水的个数,加热其晶体需要使用的实验仪器除了玻璃棒、三脚架、泥三角、酒精灯外,还需要的仪器有___________ 。取样品 加热至两次质量恒重为
加热至两次质量恒重为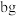 (假设减少的质量仅仅是晶体失水),则x的表达式为
(假设减少的质量仅仅是晶体失水),则x的表达式为___________ (用含a、b的代数式表示)。
(3)利用摩尔盐分解产生的 ,可制取氯化亚砜
,可制取氯化亚砜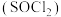 :
: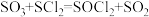 。已知
。已知 是一种液态化合物,遇水产生白雾和一种刺激性气体。利用如图装置制取
是一种液态化合物,遇水产生白雾和一种刺激性气体。利用如图装置制取 并检验生成的
并检验生成的 。
。
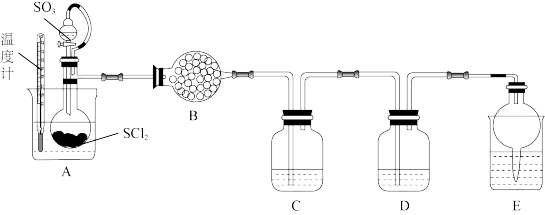
①装置B为无水 ,其作用是
,其作用是___________ 。
②装置C和装置D中的试剂分别是___________ 、___________ (填小写字母)。
a. 溶液 b.
溶液 b. 和
和 溶液 c.
溶液 c. 溶液 d.饱和的
溶液 d.饱和的 溶液
溶液
(4)利用摩尔盐分解产生的 ,设计实验探究亚硫酸与次氯酸的酸性强弱。
,设计实验探究亚硫酸与次氯酸的酸性强弱。
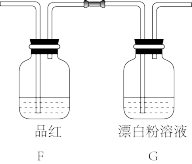
①将少量 气体直接通入装置G中,不能根据装置G中现象判断亚硫酸与次氯酸的酸性强弱,理由是
气体直接通入装置G中,不能根据装置G中现象判断亚硫酸与次氯酸的酸性强弱,理由是___________ (用化学反应方程式表示)。
②为了验证亚硫酸与次氯酸的酸性强弱,需要制备一种中间酸,装置F中另一种试剂是___________ ,其作用是___________ ,通过___________ (填现象)即可证明亚硫酸的酸性强于次氯酸。
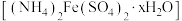 比一般的亚铁盐更稳定,是一种重要的定量分析化学试剂。回答下列问题:
比一般的亚铁盐更稳定,是一种重要的定量分析化学试剂。回答下列问题:(1)制备摩尔盐采用的方法是先在封闭体系中利用铁和稀硫酸反应制备硫酸亚铁溶液,再用新制的硫酸亚铁溶液和硫酸按饱和溶液反应制得。配制硫酸按饱和溶液的蒸馏水,需经煮沸并迅速冷却后再使用,目的是
(2)可以采用热重分析法测定摩尔盐样品中所含结晶水的个数,加热其晶体需要使用的实验仪器除了玻璃棒、三脚架、泥三角、酒精灯外,还需要的仪器有
 加热至两次质量恒重为
加热至两次质量恒重为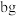 (假设减少的质量仅仅是晶体失水),则x的表达式为
(假设减少的质量仅仅是晶体失水),则x的表达式为(3)利用摩尔盐分解产生的
 ,可制取氯化亚砜
,可制取氯化亚砜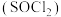 :
: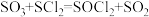 。已知
。已知 是一种液态化合物,遇水产生白雾和一种刺激性气体。利用如图装置制取
是一种液态化合物,遇水产生白雾和一种刺激性气体。利用如图装置制取 并检验生成的
并检验生成的 。
。
①装置B为无水
 ,其作用是
,其作用是②装置C和装置D中的试剂分别是
a.
 溶液 b.
溶液 b. 和
和 溶液 c.
溶液 c. 溶液 d.饱和的
溶液 d.饱和的 溶液
溶液(4)利用摩尔盐分解产生的
 ,设计实验探究亚硫酸与次氯酸的酸性强弱。
,设计实验探究亚硫酸与次氯酸的酸性强弱。
①将少量
 气体直接通入装置G中,不能根据装置G中现象判断亚硫酸与次氯酸的酸性强弱,理由是
气体直接通入装置G中,不能根据装置G中现象判断亚硫酸与次氯酸的酸性强弱,理由是②为了验证亚硫酸与次氯酸的酸性强弱,需要制备一种中间酸,装置F中另一种试剂是
您最近一年使用:0次
2022-07-15更新
|
303次组卷
|
2卷引用:河南省开封市五县2021-2022学年高二下学期期末考试化学试题
解题方法
5 . 某化学小组制备 并验证
并验证 的部分性质,装置如图所示(部分夹持装置省略):
的部分性质,装置如图所示(部分夹持装置省略):

(1)仪器a的名称是___________ 。
(2)装置A制取 的反应中,利用了浓硫酸的
的反应中,利用了浓硫酸的___________ 性,___________ (填“能”或“不能”)用浓硝酸代替。
(3)在滴加浓硫酸之前,需先通入一段时间的 ,此操作的目的是
,此操作的目的是___________ 。
(4)装置B中的反应生成乳白色浑浊的同时生成了一种强碱,则该反应的化学方程式为___________ 。
(5)装置D验证了 的漂白性,为了进一步探究
的漂白性,为了进一步探究 与品红作用的可逆性,请写出有关实验操作及现象:
与品红作用的可逆性,请写出有关实验操作及现象:___________ 。
(6)为测定装置E中收集到的混合气体中二氧化硫的含量,进行如下操作:

当注入标准状况下10mL混合气体时,酸性 ,溶液恰好褪色,假设混合气体中
,溶液恰好褪色,假设混合气体中 能被
能被 溶液充分吸收。已知:
溶液充分吸收。已知: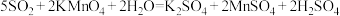 。该混合气体中二氧化硫的体积分数为
。该混合气体中二氧化硫的体积分数为___________ 。
 并验证
并验证 的部分性质,装置如图所示(部分夹持装置省略):
的部分性质,装置如图所示(部分夹持装置省略):
(1)仪器a的名称是
(2)装置A制取
 的反应中,利用了浓硫酸的
的反应中,利用了浓硫酸的(3)在滴加浓硫酸之前,需先通入一段时间的
 ,此操作的目的是
,此操作的目的是(4)装置B中的反应生成乳白色浑浊的同时生成了一种强碱,则该反应的化学方程式为
(5)装置D验证了
 的漂白性,为了进一步探究
的漂白性,为了进一步探究 与品红作用的可逆性,请写出有关实验操作及现象:
与品红作用的可逆性,请写出有关实验操作及现象:(6)为测定装置E中收集到的混合气体中二氧化硫的含量,进行如下操作:

当注入标准状况下10mL混合气体时,酸性
 ,溶液恰好褪色,假设混合气体中
,溶液恰好褪色,假设混合气体中 能被
能被 溶液充分吸收。已知:
溶液充分吸收。已知: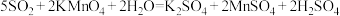 。该混合气体中二氧化硫的体积分数为
。该混合气体中二氧化硫的体积分数为
您最近一年使用:0次
2022-07-04更新
|
280次组卷
|
2卷引用:河南省平顶山市2021-2022学年高一下学期期末调研化学试题
名校
6 . 物质的类别和元素的化合价是研究物质性质的两个重要角度。回答下列问题:
I.硫元素在不同价态之间的转化为:
SO2 Na2SO3溶液
Na2SO3溶液 Na2S2O3溶液
Na2S2O3溶液
(1)“反应①”常使用NaOH溶液,该转化说明SO2的类别属于___________ 。
(2)欲制备Na2S2O3,从氧化还原的角度分析,“反应②”合理的是___________ (填标号)。
a.Na2SO3+Na2SO4 b.Na2SO3+S c.Na2SO3+Na2S2O5
II.某实验小组用铜片与浓硫酸反应并验证SO2性质的实验装置如图。
(3)装置A用于验证SO2的___________ 性,装置D的作用是___________ 。
(4)装置B的现象为___________ ,装置C的离子方程式为___________ 。
(5)若用装置乙代替装置甲,装置乙的优点是___________ (任写一点)。
(6)将28.8 g的铜片加入到25 mL 18 mol/L的硫酸中并加热,被还原的硫酸的物质的量为___________(填标号)。
I.硫元素在不同价态之间的转化为:
SO2
 Na2SO3溶液
Na2SO3溶液 Na2S2O3溶液
Na2S2O3溶液(1)“反应①”常使用NaOH溶液,该转化说明SO2的类别属于
(2)欲制备Na2S2O3,从氧化还原的角度分析,“反应②”合理的是
a.Na2SO3+Na2SO4 b.Na2SO3+S c.Na2SO3+Na2S2O5
II.某实验小组用铜片与浓硫酸反应并验证SO2性质的实验装置如图。

(3)装置A用于验证SO2的
(4)装置B的现象为
(5)若用装置乙代替装置甲,装置乙的优点是
(6)将28.8 g的铜片加入到25 mL 18 mol/L的硫酸中并加热,被还原的硫酸的物质的量为___________(填标号)。
| A.大于0.225 mol | B.等于0.225 mol |
| C.小于0.225 mol | D.在0.225 mol和0.45 mol之间 |
您最近一年使用:0次
2022-01-19更新
|
254次组卷
|
2卷引用:河南省南阳市邓州市第一高级中学校2023-2024学年高一上学期期末考试化学试题
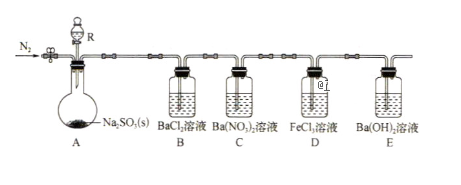
7 . MnSO4晶体是一种易溶于水的微红色晶体,某校同学设计实验制备并检验MnSO4的性质。回答下列问题:
(1)甲组同学设计用SO2和适量纯净的MnO2制备MnSO4,其装置如下:

①A装置中固体药品X通常是______ 填化学式)。
②B装置中通SO2的导管末端接多孔球泡的目的是______ ;C装置用于吸收少量的SO2,发生反应的离子方程式为______ 。
(2)乙组同学定性检验甲组同学的产品中Mn2+的存在,取少量晶体溶于水,加入(NH4)2S2O8溶液,滴入硝酸银(作催化剂),微热振荡,溶液显紫色,发生反应的离子方程式为______ 。
(3)丙组同学为检验无水MnSO4(接近白色)的热分解产物,将MnSO4晶体脱水后放入下图所示的装置中,打开K1和K2,缓慢通入N2,加热,硬质玻璃管中最后得到黑色固体。

①检验分解的气态产物中是否有SO2及SO3,装置E、F中的溶液依次是______ 、______ (填字母)。
a.Ba(NO3)2溶液 b.BaCl2溶液 c.品红溶液 d.浓硫酸
②若D中得到的黑色粉末为Mn3O4,E、F中均有明显现象,则D中发生反应的化学方程式为______ 。
(4)丁组同学设计实验以丙组同学得到的黑色粉末为原料,利用铝热反应原理将其还原为金属锰,所需的药品除氯酸钾外,还需要______ 。
(1)甲组同学设计用SO2和适量纯净的MnO2制备MnSO4,其装置如下:

①A装置中固体药品X通常是
②B装置中通SO2的导管末端接多孔球泡的目的是
(2)乙组同学定性检验甲组同学的产品中Mn2+的存在,取少量晶体溶于水,加入(NH4)2S2O8溶液,滴入硝酸银(作催化剂),微热振荡,溶液显紫色,发生反应的离子方程式为
(3)丙组同学为检验无水MnSO4(接近白色)的热分解产物,将MnSO4晶体脱水后放入下图所示的装置中,打开K1和K2,缓慢通入N2,加热,硬质玻璃管中最后得到黑色固体。

①检验分解的气态产物中是否有SO2及SO3,装置E、F中的溶液依次是
a.Ba(NO3)2溶液 b.BaCl2溶液 c.品红溶液 d.浓硫酸
②若D中得到的黑色粉末为Mn3O4,E、F中均有明显现象,则D中发生反应的化学方程式为
(4)丁组同学设计实验以丙组同学得到的黑色粉末为原料,利用铝热反应原理将其还原为金属锰,所需的药品除氯酸钾外,还需要
您最近一年使用:0次
2019-10-28更新
|
201次组卷
|
3卷引用:河南省天一大联考2019学年高三年级上学期期末考试化学试题
8 . 某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如图的实验装置:

(1)实验室用装置A,用浓硫酸和铜反应制备SO2,请写出化学反应方程式____________
(2)反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:B_____ 、D______ ,停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B_____ 、D______ 。
(3)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)____________ 。

(1)实验室用装置A,用浓硫酸和铜反应制备SO2,请写出化学反应方程式
(2)反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:B
(3)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)
您最近一年使用:0次
2020-02-15更新
|
179次组卷
|
2卷引用:河南省洛阳市2019-2020学年高一上学期期末考试化学试题
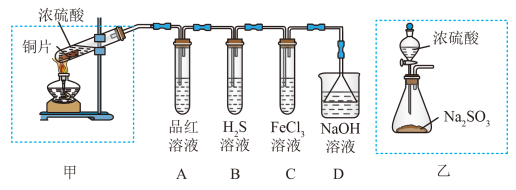
9 . 某课题组设计实验探究SO2的性质。
实验现象:B中无沉淀生成,C中有白色沉淀,D中溶液颜色变浅,E中产生白色沉淀.
(1)仪器R的名称是__________ .
(2)实验室在常温下用80%的硫酸与亚硫酸钠粉末反应制备SO2,写出A中反应的化学方程式:__________ .
(3)部分实验步骤如下:连接装置、检查气密性、装药品,向装置中通入一段时间N2,然后启动A中反应。“通入一段时间的N2"的目的是____ .
(4)探究装置C中通入SO2的量与产物的关系。
①他们提出如下猜想:
猜想1:通入过量的SO2,则发生反应的离子方程式为Ba2++2NO3-+3SO2+2H2O=BaSO4+2SO42-+2NO+4H+
猜想2:通入少量的SO2,则发生反应的离子方程式为__________ 。
② 请你帮他们设计实验证明猜想1和猜想2哪个合理,完成下列实验:
提供试剂:溴水、铜粉、Ba(NO3)2溶液、BaCl2溶液、Na2CO3溶液
(5)下列可检验装置D反应后溶液中是否有Fe2+的最佳试剂是(填字母)( )
A.KSCN溶液B.NaOH溶液C.K3[Fe(CN)6]溶液D.KSCN溶液和双氧水
(6)常温下,实验完毕后,分离、提纯装置E中白色固体M,取适量M于试管中,滴少量盐酸(M剩余),所得溶液的pH__________ 7(填“>”“<”或“=”)。

实验现象:B中无沉淀生成,C中有白色沉淀,D中溶液颜色变浅,E中产生白色沉淀.
(1)仪器R的名称是
(2)实验室在常温下用80%的硫酸与亚硫酸钠粉末反应制备SO2,写出A中反应的化学方程式:
(3)部分实验步骤如下:连接装置、检查气密性、装药品,向装置中通入一段时间N2,然后启动A中反应。“通入一段时间的N2"的目的是
(4)探究装置C中通入SO2的量与产物的关系。
①他们提出如下猜想:
猜想1:通入过量的SO2,则发生反应的离子方程式为Ba2++2NO3-+3SO2+2H2O=BaSO4+2SO42-+2NO+4H+
猜想2:通入少量的SO2,则发生反应的离子方程式为
② 请你帮他们设计实验证明猜想1和猜想2哪个合理,完成下列实验:
提供试剂:溴水、铜粉、Ba(NO3)2溶液、BaCl2溶液、Na2CO3溶液
| 实验步骤 | 实验现象及结论 |
| 取少量C中反应后溶液于试管中, |
A.KSCN溶液B.NaOH溶液C.K3[Fe(CN)6]溶液D.KSCN溶液和双氧水
(6)常温下,实验完毕后,分离、提纯装置E中白色固体M,取适量M于试管中,滴少量盐酸(M剩余),所得溶液的pH
您最近一年使用:0次
2017-05-13更新
|
200次组卷
|
3卷引用:河南省新乡市延津县高级中学2016-2017学年高二(卫星班)下学期期末考试理综化学试题
河南省新乡市延津县高级中学2016-2017学年高二(卫星班)下学期期末考试理综化学试题(已下线)解密06 非金属及其化合物(教师版)——备战2018年高考化学之高频考点解密山东省新泰市第二中学2019届高三上学期阶段性测试(三)理科综合化学试题
名校
10 . 下列实验中,能达到相应实验目的的是
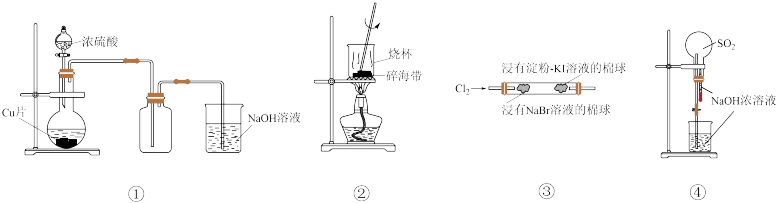

| A.图①可用于制备和收集 SO2 |
| B.图②可灼烧海带 |
| C.图③可证明氧化性:Cl2>Br2>I2 |
| D.图④可进行喷泉实验 |
您最近一年使用:0次
2023-07-05更新
|
136次组卷
|
2卷引用:河南省洛阳市2022-2023学年高一下学期期末质量检测化学试卷



