名校
解题方法
1 . 某小组同学采用以下装置验证SO2的性质:(夹持及加热装置略)

(1)写出圆底烧瓶中发生反应的化学方程式:___________ 。
(2)从实验目的分析,试管1、4的目的都是为了证明SO2具有___________ (性质),试管2是为了证明SO2具有___________ (性质)。
(3)除上述两种性质外,你认为SO2还具有的性质是___________ ,可以通过加入___________ (填试剂名称)加以证明。
(4)经过实验,观察到如下实验现象:
①试管1中___________ 。
②试管2中有黄色浑浊出现,写出反应的化学方程式___________ 。
(5)试管3中无明显现象,将其分成两份,分别加入下列物质均产生沉淀。将产生的沉淀的化学式填入下表相应位置。
(6)试管4和试管5均加入NaOH溶液,在实验目的上的不同点是___________ 。
(7)欲制备Na2S2O3,从氧化还原角度分析,合理的是___________(填序号)。

(1)写出圆底烧瓶中发生反应的化学方程式:
(2)从实验目的分析,试管1、4的目的都是为了证明SO2具有
(3)除上述两种性质外,你认为SO2还具有的性质是
(4)经过实验,观察到如下实验现象:
①试管1中
②试管2中有黄色浑浊出现,写出反应的化学方程式
(5)试管3中无明显现象,将其分成两份,分别加入下列物质均产生沉淀。将产生的沉淀的化学式填入下表相应位置。
| 加入的物质 | O2 | 氨水 |
| 沉淀的化学式 |
(7)欲制备Na2S2O3,从氧化还原角度分析,合理的是___________(填序号)。
| A.Na2S+S | B.Na2SO3+S | C.Na2SO3+Na2SO4 | D.SO2+Na2SO4 |
您最近一年使用:0次
2 . 二氧化硫具有漂白性,工业上常用二氧化硫来漂白纸浆、毛、丝、草帽等。此外二氧化硫还能够抑制霉菌和细菌的滋生,可用作防腐剂。
Ⅰ.甲组同学拟利用 粉与浓硫酸反应制取
粉与浓硫酸反应制取 (标准状况下)
(标准状况下) 。实验方案设计如下:取
。实验方案设计如下:取 粉与
粉与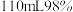 的浓硫酸(含
的浓硫酸(含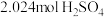 )混合,加热充分反应,待
)混合,加热充分反应,待 粉全部溶解后,干燥并收集气体。
粉全部溶解后,干燥并收集气体。
(1)写出 粉与浓硫酸反应制备
粉与浓硫酸反应制备 的化学方程式:
的化学方程式:__________________ 。
(2)乙组同学认为:按甲组同学实验方案无法达到实验目的,并且制得气体应该含有杂质,该杂质为_________ (填化学式)。
(3)为了检验甲组同学所制气体的成分,乙组同学按甲组同学的实验方案制备气体,并设计了如图所示的实验装置进行检验。(已知酸性高锰酸钾溶液及B中试剂均过量)
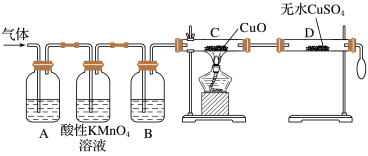
①A中试剂是品红溶液,作用是____________ 。
②B中所装试剂为____________ 。
③证明气体中混有杂质气体的实验现象是:________ 。
Ⅱ. 是常见的大气污染物,燃煤是产生
是常见的大气污染物,燃煤是产生 的主要原因。
的主要原因。
(4)工业上有多种方法可以减少 的排放。往煤中添加一些石灰石,可使燃煤过程中产生的
的排放。往煤中添加一些石灰石,可使燃煤过程中产生的 转化成硫酸钙,该反应的化学方程式是
转化成硫酸钙,该反应的化学方程式是___________ 。
(5)丙组同学认为 溶液可以做
溶液可以做 的吸收液,从而减少实验室
的吸收液,从而减少实验室 的排放。乙组同学认为丙组同学的假设不成立,为此乙组同学设计了如下实验(夹持装置和加热装置略,气密性已检验):
的排放。乙组同学认为丙组同学的假设不成立,为此乙组同学设计了如下实验(夹持装置和加热装置略,气密性已检验):
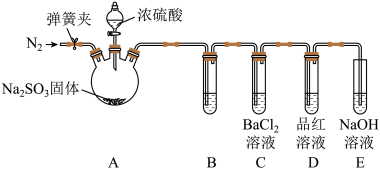
已知: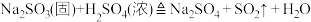
反应开始后,B、C试管中除了有气泡外,未见其他现象;D中红色褪去。通过乙组同学的实验,得出的结论是___________ 。
Ⅰ.甲组同学拟利用
 粉与浓硫酸反应制取
粉与浓硫酸反应制取 (标准状况下)
(标准状况下) 。实验方案设计如下:取
。实验方案设计如下:取 粉与
粉与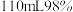 的浓硫酸(含
的浓硫酸(含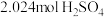 )混合,加热充分反应,待
)混合,加热充分反应,待 粉全部溶解后,干燥并收集气体。
粉全部溶解后,干燥并收集气体。(1)写出
 粉与浓硫酸反应制备
粉与浓硫酸反应制备 的化学方程式:
的化学方程式:(2)乙组同学认为:按甲组同学实验方案无法达到实验目的,并且制得气体应该含有杂质,该杂质为
(3)为了检验甲组同学所制气体的成分,乙组同学按甲组同学的实验方案制备气体,并设计了如图所示的实验装置进行检验。(已知酸性高锰酸钾溶液及B中试剂均过量)

①A中试剂是品红溶液,作用是
②B中所装试剂为
③证明气体中混有杂质气体的实验现象是:
Ⅱ.
 是常见的大气污染物,燃煤是产生
是常见的大气污染物,燃煤是产生 的主要原因。
的主要原因。(4)工业上有多种方法可以减少
 的排放。往煤中添加一些石灰石,可使燃煤过程中产生的
的排放。往煤中添加一些石灰石,可使燃煤过程中产生的 转化成硫酸钙,该反应的化学方程式是
转化成硫酸钙,该反应的化学方程式是(5)丙组同学认为
 溶液可以做
溶液可以做 的吸收液,从而减少实验室
的吸收液,从而减少实验室 的排放。乙组同学认为丙组同学的假设不成立,为此乙组同学设计了如下实验(夹持装置和加热装置略,气密性已检验):
的排放。乙组同学认为丙组同学的假设不成立,为此乙组同学设计了如下实验(夹持装置和加热装置略,气密性已检验):
已知:
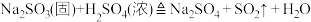
反应开始后,B、C试管中除了有气泡外,未见其他现象;D中红色褪去。通过乙组同学的实验,得出的结论是
您最近一年使用:0次
名校
解题方法
3 . 近年我国某些城市酸雨污染较为严重,主要是因为大量燃烧含硫量高的煤。
【实验目的】通过实验证明煤中含有碳元素和硫元素。
(1)查阅资料知,二氧化硫能使高锰酸钾溶液褪色。请完成该反应的离子方程式:
____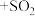 ____
____ _____=_____
_____=_____ _____
_____ ____
____ 。
。____________
(2)根据上述资料,甲同学和丙同学分别设计实验方案进行探究。
【实验操作】甲同学进行了如图所示A、B两步实验。
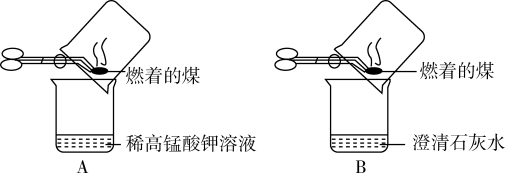
【实验现象】A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊。
【得出结论】煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素。
①乙同学认为甲同学的方案不合理,其理由是_____________________ 。
【实验操作】丙同学进行了如图所示实验。
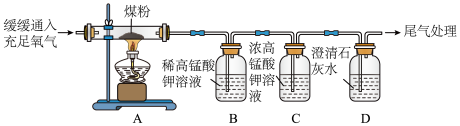
②C装置的作用是_____________________ 。
③证明煤中含有碳元素和硫元素的现象是_______________________ 。
④C装置中的浓高锰酸钾溶液也可以替换为_______________ (填标号)。
A.足量I2的淀粉溶液B.足量饱和 溶液
溶液
C.足量 溶液D.足量溴水
溶液D.足量溴水
【实验目的】通过实验证明煤中含有碳元素和硫元素。
(1)查阅资料知,二氧化硫能使高锰酸钾溶液褪色。请完成该反应的离子方程式:
____
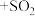 ____
____ _____=_____
_____=_____ _____
_____ ____
____ 。
。(2)根据上述资料,甲同学和丙同学分别设计实验方案进行探究。
【实验操作】甲同学进行了如图所示A、B两步实验。

【实验现象】A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊。
【得出结论】煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素。
①乙同学认为甲同学的方案不合理,其理由是
【实验操作】丙同学进行了如图所示实验。

②C装置的作用是
③证明煤中含有碳元素和硫元素的现象是
④C装置中的浓高锰酸钾溶液也可以替换为
A.足量I2的淀粉溶液B.足量饱和
 溶液
溶液C.足量
 溶液D.足量溴水
溶液D.足量溴水
您最近一年使用:0次
2020-10-10更新
|
405次组卷
|
6卷引用:安徽师大附中2019-2020学年高一下学期线上质量评估(期中)化学试题
4 . 下列实验方案不能 达到实验目的的是
| 编号 | 实验目的 | 实验方案 |
| A | 比较C和Si的非金属性强弱 | 向Na2SiO3溶液中通入CO2,观察溶液中的现象 |
| B | 探究SO2的漂白性 | 向装有品红溶液的试管中通入SO2,观察溶液中的现象,加热,再次观察现象 |
| C | 制备Fe(OH)3胶体 | 在盛有氯化铁溶液的烧杯中倒入氢氧化钠溶液 |
| D | 检验氯气的产生 | 将湿润的淀粉KI试纸靠近导管口,观察试纸变色现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
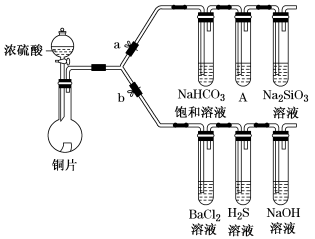
5 . 根据要求完成下列各小题实验目的。(a、b为弹簧夹,加热及固定装置已略去)
① 连接仪器、________ 、加药品后,打开a关闭b,然后滴入浓硫酸,加热。
② 铜与浓硫酸反应的化学方程式是_______ 。装置A中试剂是_______ 。
③ 能说明碳的非金属性比硅强的实验现象是_________ 。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
① 在(1)①操作后打开b,关闭a。
② H2S溶液中有浅黄色浑浊出现,化学方程式是____ 。
③ BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
写出其中SO2显示还原性生成沉淀的离子方程式_________ 。
① 连接仪器、
② 铜与浓硫酸反应的化学方程式是
③ 能说明碳的非金属性比硅强的实验现象是
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
① 在(1)①操作后打开b,关闭a。
② H2S溶液中有浅黄色浑浊出现,化学方程式是
③ BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
您最近一年使用:0次
2020-03-06更新
|
148次组卷
|
6卷引用:2014-2015黑龙江省哈尔滨师大附中高一下学期第一次月考化学试卷
2012·上海奉贤·二模
6 . 为探究SO2与可溶性钡盐能否反应生成白色BaSO3沉淀,甲、乙两同学用下图所示装置进行实验(夹持装置、加热装置已略,气密性已检验)

实验操作和现象:
(1)A中反应的化学方程式是_________ 。
(2)C中可溶性钡盐溶液X为________ 。实验过程中,发现液体Y不能很顺利地滴下,则可如何改进:_______ 。
(3)分析B中不溶于稀盐酸的沉淀的产生原因,甲同学认为是_____ ,乙同学认为是白雾参与反应。
为证实各自的观点,在原实验基础上;甲同学在原有操作之前,先通N2一段时间。乙同学则在A、B间增加盛有饱和NaHSO3溶液的洗气瓶D。甲、乙各自进行实验,B中现象分别如右表:
由此得出的结论是_______ 。
(4)丙将甲乙两同学的方案进行联合试验,发现B中无沉淀生成,而C中产生白色沉淀,但无红棕色气体。C中反应的化学方程式是_______ 。
(5)丁同学认为丙选择的两种钡盐比较相似,于是丁在丙的基础上将B、C中的钡盐分别换成过量新制的醋酸钡溶液、Ba(AlO2)2溶液,发现B、C中均立即产生大量白色沉淀,该沉淀可溶于稀盐酸,并产生能使澄清石灰水变浑浊的气体。C中沉淀为_______ 。实验室里欲获得该沉淀,所需要的玻璃仪器是_____ 。
(6)结合实验目的,根据四位同学的实验操作和实验现象,你得出的结论是_______ 。

实验操作和现象:
| 操 作 | 现 象 |
| 关闭弹簧夹,滴加一定量液体Y,加强热; | A中有白雾生成,红色固体Z的表面产生气泡。B中有气泡冒出,产生大量白色沉淀。C中产生白色沉淀,液面上方略显红棕色并逐渐消失。 |
| 打开弹簧夹,通入气体N2,停止加热,一段时间后关闭; | |
| 从B、C中分别取少量白色沉淀,加稀盐酸。 | 均未发现白色沉淀溶解 |
(2)C中可溶性钡盐溶液X为
(3)分析B中不溶于稀盐酸的沉淀的产生原因,甲同学认为是
为证实各自的观点,在原实验基础上;甲同学在原有操作之前,先通N2一段时间。乙同学则在A、B间增加盛有饱和NaHSO3溶液的洗气瓶D。甲、乙各自进行实验,B中现象分别如右表:
| 甲 | 大量不溶于稀盐酸的白色沉淀 |
| 乙 | 少量不溶于稀盐酸的白色沉淀 |
(4)丙将甲乙两同学的方案进行联合试验,发现B中无沉淀生成,而C中产生白色沉淀,但无红棕色气体。C中反应的化学方程式是
(5)丁同学认为丙选择的两种钡盐比较相似,于是丁在丙的基础上将B、C中的钡盐分别换成过量新制的醋酸钡溶液、Ba(AlO2)2溶液,发现B、C中均立即产生大量白色沉淀,该沉淀可溶于稀盐酸,并产生能使澄清石灰水变浑浊的气体。C中沉淀为
(6)结合实验目的,根据四位同学的实验操作和实验现象,你得出的结论是
您最近一年使用:0次
解题方法
7 . 下列实验装置不能达到实验目的的是( )
实验室用装置甲制备氨气
实验室用装置甲制备氨气
 | 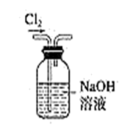 | 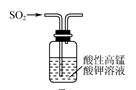 |  |
甲 | 乙 | 丙 | 丁 |
| A.实验室用装置甲制备氨气 |
| B.用装置乙除去Cl2中混有的少量HCl |
| C.用装置丙验证SO2的还原性 |
| D.用装置丁制取Fe(OH)2 |
您最近一年使用:0次
2020-09-02更新
|
212次组卷
|
2卷引用:海南省天一大联考2020届高三第一次模拟考试化学试题
解题方法
8 . 用下图所示的装置进行实验(夹持仪器略去),a、b、c中分别盛有试剂1、2、3,能达到实验目的的是
| 选项 | 试剂1 | 试剂2 | 试剂3 | 实验目的 | 装置 |
| A | 浓盐酸 | KMnO4 | 饱和NaCl溶液 | 制备干燥纯净的Cl2 |  |
| B | 稀硫酸 | NaHCO3 | Na2SiO3溶液 | 验证非金属性:C>Si | |
| C | 稀硫酸 | 溶液X | 澄清石灰水 | 验证X中是否有 | |
| D | 70%硫酸 | Na2SO3 | 酸性KMnO4溶液 | 验证SO2具有漂白性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
9 . 用如图所示的装置进行实验(夹持及尾气处理仪器略去),能达到实验目的的是
| 选项 | a中试剂 | b中试剂 | c中试剂 | 实验目的 | 装置 |
| A | 氨水 | CaO | 无 | 制取并收集氨气 |  |
| B | 浓盐酸 | MnO2 | 饱和NaCl溶液 | 制备纯净的Cl2 | |
| C | 浓盐酸 | Na2CO3 | Na2SiO3溶液 | 比较酸性强弱: H2CO3>H2SiO3 | |
| D | 浓硫酸 | Na2SO3 | KMnO4酸性溶液 | 验证SO2具有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-06-13更新
|
1811次组卷
|
12卷引用:北京市朝阳区2020届高三第二次学业水平等级性考试化学试题
北京市朝阳区2020届高三第二次学业水平等级性考试化学试题(已下线)小题必刷17 碳、硅与无机非金属材料——2021年高考化学一轮复习小题必刷(通用版)山东省潍坊第一中学2021届高三上学期开学检测化学试题山东省枣庄滕州一中2021届高三10月月考化学试题山东省德州市2021届高三上学期期中考试化学试题(已下线)专题08 常见无机物及其应用——备战2021年高考化学纠错笔记湖南省常德市芷兰实验中学2020-2021学年高一下学期第一次月考化学试题江西省九校2021-2022学年高三上学期期中联考化学试题北京市海淀区中关村中学2022届高三下学期三模化学试题北京市第十二中学2021-2022学年高一下学期6月月考化学试题北京十二中2021-2022学年高一下学期六月月考(等级考)化学试题(已下线)专题23 化学实验基础性选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
10 . CuI是有机合成的一种催化剂,受热易氧化。实验室可通过向CuSO4与NaI的混合溶液中通入SO2制备CuI(2CuSO4+2NaI+SO2+2H2O 2CuI↓+2H2SO4+Na2SO4)。下列实验原理和装置不能达到实验目的的是( )
2CuI↓+2H2SO4+Na2SO4)。下列实验原理和装置不能达到实验目的的是( )
 2CuI↓+2H2SO4+Na2SO4)。下列实验原理和装置不能达到实验目的的是( )
2CuI↓+2H2SO4+Na2SO4)。下列实验原理和装置不能达到实验目的的是( )A. 制备SO2 制备SO2 |
B.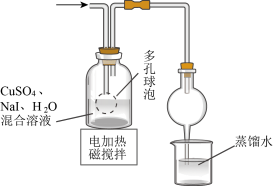 制备CuI并制备少量含SO2的溶液 制备CuI并制备少量含SO2的溶液 |
C.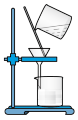 将CuI与母液分离并用装置制得的含SO2的溶液洗涤沉淀 将CuI与母液分离并用装置制得的含SO2的溶液洗涤沉淀 |
D. 加热干燥湿的CuI固体 加热干燥湿的CuI固体 |
您最近一年使用:0次
2019-05-24更新
|
810次组卷
|
6卷引用:【市级联考】江苏省盐城市2019届高三下学期第四次模拟考试化学试题



