1 . 如图是研究二氧化硫性质的微型实验装置。现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气。下列说法中错误的是
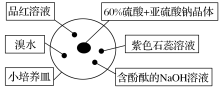
| A.紫色石蕊溶液变蓝色 | B.品红溶液褪色 |
| C.溴水颜色褪去 | D.含酚酞的NaOH溶液红色变浅或褪色 |
您最近一年使用:0次
2020-08-13更新
|
1685次组卷
|
35卷引用:2015-2016学年广西柳州铁路一中高一上期末化学试卷
2015-2016学年广西柳州铁路一中高一上期末化学试卷(已下线)同步君 必修1 第4章 第3节 二氧化硫和三氧化硫高中化学人教版 必修1 第四章 非金属及其化合物 3.硫和氮的氧化物 二氧化硫和三氧化硫湖北省长阳县第一高级中学2017-2018学年高一上学期期末考试化学试题云南省玉溪市新平三中2019-2020学年高一上学期12月月考化学试题步步为赢 高一化学寒假作业:作业十四 硫和氮的氧化物鲁科版高中化学必修1第三章《自然界中的元素》测试卷新人教版必修2同步测试:5.1.2硫酸 硫酸根离子的检验贵州省榕江县第三高级中学2019-2020学年高一上学期期末考试化学试题云南省师宗县第二中学2019-2020学年高一上学期期末考试化学试题5.1.1 硫和二氧化硫——2020年春高一新人教版第二册化学一课一练山东省济宁市第二中学2019-2020学年高一下学期第一次线上检测(实验班)化学试题2020年春高一化学新人教版第二册课后同步:5.1.1 硫和二氧化硫重庆市万州区龙驹中学2019-2020高一3月月考化学试题黑龙江省哈尔滨市宾县第二中学2019-2020学年高二下学期期中考试化学试题安徽省亳州市涡阳县第九中学2018-2019学年高一下学期第一次周测化学试题(已下线)3.2.1 自然界中的硫 二氧化硫练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)苏教版(2020)高一必修第一册专题4 总结检测鲁科版(2019)高一必修第一册第3章 物质的性质与转化 第2节 硫的转化 综合训练高一必修第二册(人教2019版)第五章 第一节 硫及其化合物 综合训练(已下线)4.3.1 硫及其氧化物(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版)(人教版2019)必修第二册 第五章 化工生产中的重要非金属元素 第一节 硫及其化合物人教版2019必修第二册 第五章 第一节 第1课时 硫和二氧化硫福建省三明市第一中学2020-2021学年高一下学期开学考试化学试题甘肃省天水市第一中学2020-2021学年高一下学期第一阶段考试化学(理)试题安徽省六安市舒城县2020-2021学年高一下学期期末考试化学试题(已下线)第02讲 三氧化硫和硫酸(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)吉林省长春汽车经济技术开发区第三中学 2021-2022学年 高一下学期线上月考化学试题江苏省天一中学2021-2022学年高一下学期期中考试(文)化学试题海南省海口市灵山中学2021-2022学年高一下学期第三次月考化学试题上海市第五十四中学2021-2022学年高一上学期12月月考化学试题上海市第四中学2022-2023学年高一上学期期末考试化学试题甘肃省华亭市第一中学2021-2022学年高一下学期期末考试化学试题宁夏银川市育才中学2022-2023学年高一下学期5月期中考试化学试题河南省鄢陵县第一高级中学2023-2024学年高一下学期开学考试化学试题
12-13高一下·广东佛山·期中
名校
2 . 下列实验装置不能达到实验目的的是


| A.图甲:用SO2做喷泉实验 | B.图乙:验证Cu与浓硝酸反应的热量变化 |
| C.图丙:验证NH3易溶于水 | D.图丁:比较Na2CO3与NaHCO3的稳定性 |
您最近一年使用:0次
2021-06-22更新
|
908次组卷
|
42卷引用:【全国百强校】广西南宁市第二中学2017-2018学年高一下学期期中考试(理)化学试题
【全国百强校】广西南宁市第二中学2017-2018学年高一下学期期中考试(理)化学试题(已下线)2012-2013学年广东省佛山市佛山一中高一下学期期中考试化学试卷(已下线)2012-2013学年广东省佛山市佛山一中高一下学期期中考试化学试卷2015-2016学年山东省滕州市第二中学高一上学期12月月考化学试卷2015-2016学年黑龙江省双鸭山一中高一上期末化学试卷2016-2017学年河北省武邑中学高二上学期期末考试化学试卷2016-2017学年黑龙江省双鸭山市第一中学高一4月月考化学试卷宁夏育才中学2017-2018学年高一上学期期末考试化学试题【全国百强校】黑龙江省哈尔滨师范大学附属中学2017-2018学年高一下学期期中考试化学(理)试题【全国百强校】黑龙江省双鸭山市第一中学2017-2018学年高二下学期期末考试化学试题【全国百强校】吉林省长春外国语学校2018-2019学年高二上学期期初考试化学试题辽宁省大连市育明高级中学2018-2019学年高二上学期期初考试化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高一上学期期末考试化学试题福建省华安县第一中学2018-2019学年高一下学期第一次月考化学试题【校级联考】湖北省部分重点中学2018-2019学年高一下学期期中考试化学试题山西省忻州市第一中学北校2019-2020学年高一3月月考化学试题天津市宁河区芦台二中2019-2020学年高一下学期第一次阶段测试化学试题重庆市育才中学2019-2020学年高一下学期3月月考化学试题四川省内江市第六中学2019-2020学年高一下学期入学考试化学A试题四川省资中县第三中学2019-2020学年高一4月测试化学试题四川省内江市第六中学2019-2020学年高一下学期入学考试化学C试题四川省威远县连界一中2019-2020学年高一4月测试化学试题广东省珠海一中高一化学下学期综合测试试卷黑龙江省七台河市第一中学2019-2020学年高一下学期期中考试化学试题西藏自治区日喀则市南木林高级中学2019-2020学年高一下学期期中考试化学试题云南省昆明市第十四中学2018-2019学年高一下学期期中考试化学试题(已下线)练习16 生活中的含氮化合物-2020-2021学年【补习教材·寒假作业】高一化学(苏教版)江西省赣州市赣县第三中学2020-2021学年高一下学期2月入学考试化学试题湖南省重点中学2020-2021学年高一下学期3月联考化学试题(已下线)【浙江新东方】高中化学20210513-041【2021】【高一下】河北省大联考2020-2021学年高一下学期4月月考化学试题黑龙江省哈尔滨市延寿县第二中学2020-2021学年高一5月月考化学试题广东省广州市北大附中为明广州实验学校2020-2021学年高一下学期期中考试化学试题河北省张家口市第一中学2020-2021学年高一下学期期中考试化学试题云南省临沧市凤庆县第一中学2021-2022学年高一下学期3月份考试化学试题江西省抚州市临川第二中学2021-2022学年高一下学期第一次月考化学试题(已下线)【期中复习】必刷题-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)广东省茂名化州市第一中学2021-2022学年高一下学期期中考试化学试题天津市第二南开学校2021-2022学年高一年级下学期期中阶段性质量调查化学试题河南省洛阳市洛阳格致学校2021-2022学年高一下学期三月月考化学试题四川省内江市威远中学校2022-2023学年高一下学期期中考试化学试题 云南省玉溪第一中学2022-2023学年高一下学期期中考试化学试题
名校
解题方法
3 . 将二氧化硫通入显红色的酚酞试液中,发现红色消失,主要原因是( )
| A.二氧化硫具有漂白性 | B.二氧化硫具有还原性 |
| C.二氧化硫具有氧化性 | D.二氧化硫溶于水后生成酸 |
您最近一年使用:0次
2020-02-18更新
|
1093次组卷
|
7卷引用:广西隆林县第二中学2019-2020学年高一上学期期末考试化学试题
4 . 在如图所示的装置中,干燥烧瓶内盛有某种气体甲,烧杯和胶头滴管内盛放某种液体乙。挤压胶头滴管,使少量液体乙进入烧瓶,下列与实验事实不相符的是( )
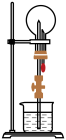
| A.甲:NH3,乙:H2O(含酚酞溶液),现象:形成红色喷泉 |
| B.甲:NO,乙:H2O(含石蕊溶液),现象:形成红色喷泉 |
| C.甲:HCl,乙:AgNO3溶液,现象:形成白色喷泉 |
| D.甲:SO2,乙:NaOH溶液,现象:形成无色喷泉 |
您最近一年使用:0次
2020-09-12更新
|
604次组卷
|
9卷引用:鲁科版(2019)高一必修第一册第3章 物质的性质与转化 第3节 氮的循环 课时2 氨的转化与生成
鲁科版(2019)高一必修第一册第3章 物质的性质与转化 第3节 氮的循环 课时2 氨的转化与生成高一必修第二册(人教2019版)第五章 第二节 氮及其化合物 课时2 氨与铵盐广西南宁市英华学校2020-2021学年高一上学期期末考试化学试题黑龙江省牡丹江市海林市朝鲜族中学2020-2021学年高一4月月考化学试题 山东省济宁市嘉祥县第一中学2022-2023学年高一下学期3月月考化学试题 黑龙江省双鸭山市第一中学2022-2023学年高一下学期4月月考(普通班)化学试题辽宁省东港市第二中学2023-2024学年高二上学期开学考试化学试题辽宁省大连市第八中学2022-2023学年高一4月阶段测试化学试题山东省淄博市张店区潘庄高级中学2023-2024学年高一下学期第一次月考化学试题
20-21高一上·全国·假期作业
名校
解题方法
5 . 下列变化可以说明SO2具有漂白性的是
| A.SO2通入溴水中,溴水褪色 |
| B.SO2通入酸性高锰酸钾溶液中,溶液的紫红色褪去 |
| C.SO2通入品红溶液中,溶液的红色褪去 |
| D.SO2通入滴有酚酞的氢氧化钠溶液中,溶液的红色褪去 |
您最近一年使用:0次
2021-01-14更新
|
364次组卷
|
9卷引用:练习15 含硫化合物的性质和应用-2020-2021学年【补习教材·寒假作业】高一化学(苏教版)
(已下线)练习15 含硫化合物的性质和应用-2020-2021学年【补习教材·寒假作业】高一化学(苏教版)广西贺州第五高级中学2012-2022学年高一下学期第一次月考化学试题吉林省大安市第六中学2020-2021学年高一下学期期中化学试题重庆市名校联盟2021-2022学年高一下学期第一次联合考试化学试题广东省江门市江门一中2020-2021学年高一下学期第二次月考化学试题云南红河县第一中学2021-2022学年高一下学期期末考试化学试题云南省易门县一中2021-2022学年高一下学期3月月考化学试题广东深圳市龙岗区德琳学校2021-2022学年高一下学期期中考试化学试题湖南省邵东市第一中学2022-2023学年高一上学期期末测试化学试题
10-11高二下·辽宁·期中
名校
解题方法
6 . 下列除去杂质的方法正确的是
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液;
③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏。
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液;
③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏。
| A.①② | B.②④ | C.③④ | D.②③ |
您最近一年使用:0次
2023-05-19更新
|
222次组卷
|
50卷引用:2010-2011学年辽宁省东北育才学校高二下学期期中考试化学试卷
(已下线)2010-2011学年辽宁省东北育才学校高二下学期期中考试化学试卷(已下线)2010-2011年云南省玉溪一中高一下学期期末考试化学卷(已下线)2011-2012学年吉林省扶余一中高二下学期期中考试化学试卷(已下线)2011-2012学年广东省佛山一中高二下学期期末考试化学试卷(已下线)2011-2012学年湖北武汉部分重点中学高一下学期期末考试化学题(已下线)2012年人教版高中化学选修6 2.2 物质的制备练习卷(已下线)2013届甘肃省河西五市部分普通高中高三第一次联合考试化学试卷(已下线)2013-2014学年江苏常州某重点高中高二上学期第二次月考化学试卷(已下线)2015年同步课时练(人教选修5)综合检测卷(二)(已下线)2015届河南省焦作市高三上学期期中化学试卷2015-2016学年四川省华蓥市高一下期末化学试卷(已下线)同步君 选修五 第一章 第四节 第一课时 有机物的分离和提纯辽宁省瓦房店市高级中学2016-2017学年高一下学期期末考试化学试题宁夏银川一中2017-2018学年高二上学期期中考试化学试题高中化学人教版 选修五 第一章 第四节 有机物的分离和提纯辽宁省大石桥市第二高级中学2017-2018学年高二12月月考化学试题江西省高安中学2017-2018学年高二1月月考化学试题陕西省定边县安边中学2017-2018学年高二上学期期末考试化学试题【全国百强校】河北省辛集中学2017-2018学年高一6月月考化学试题【全国百强校】新疆生产建设兵团第二中学2017-2018学年高一下学期期末考试化学试题【全国百强校】黑龙江省双鸭山市第一中学2017-2018学年高一下学期期末考试化学试题云南省腾冲市第八中学2018-2019学年高二上学期期中考试化学试题山东省德州市夏津县第一中学2018-2019学年高一下学期第二次月考化学试题天津市南开中学人教版高中化学选修5预习练习:第三章 第三节 羧酸 酯7.3.2 乙酸——2020年春高一新人教版第二册化学一课一练2020年春高一化学新人教版第二册课后同步:7.3.2 乙酸辽宁省凌源市第三高级中学2019-2020学年高二第二次月考化学试题辽宁省大连市瓦房店市实验高级中学2018-2019学年高二下学期月考化学试题辽宁省丹东市2018-2019学年高二下学期期末质量监测化学试题甘肃省张掖市山丹县第一中学2019-2020学年高二下学期期中考试化学试题(已下线)甘肃省天水市第一中学2019-2020学年高二下学期第一学段考试化学试题(理科)广东省深圳市2020届高三二模热身试题化学试题甘肃省天水市第一中学2019-2020学年高二下学期第一学段考试化学试题陕西省西安市远东第一中学2018-2019学年高一下学期第二次月考化学试题广西南宁市东盟中学2020-2021学年高二上学期期末考试化学试题黑龙江省牡丹江市第一高级中学2021届高三上学期期末化学试题江西省南昌市新建一中2020-2021学年高二下学期第一次月考化学试题河北省石家庄市藁城新冀明中学2020-2021学年高二下学期第二次月考化学试题(已下线)第一章 有机化合物的结构特点与研究方法 章末测试(A)-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修3)四川省凉山宁南中学2021-2022学年高二上学期开学考试化学试题江西省萍乡市芦溪中学2020 -2021学年高一下学期5月月考化学试题江西省南昌市外国语学校2021-2022学年高二下学期第一次月考化学(理科)试题 (已下线)第21讲 乙酸(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)专题强化练2 常见有机化合物的检验、分离与提纯黑龙江省大兴安岭实验中学2021-2022学年高三上学期期末考试化学试题陕西省西安市鄠邑区第二中学2021-2022学年高二下学期第一次月考化学试题云南省昆明市第一中学2022-2023学年高二上学期期中考试化学试题安徽省合肥市庐巢七校联考2022-2023学年高二下学期期中考试化学试题安徽省滁州市定远中学2022-2023学年高二下学期5月教学质量检测化学试题云南省开远市第一中学校2022-2023学年高一下学期期末考试化学试题
名校
7 . 下列过程,观察不到颜色变化的是( )
| A.NO气体暴露在空气中 |
| B.往FeCl3溶液中滴入KSCN溶液 |
| C.Cl2通过湿润的有色布条 |
| D.往NaOH溶液中通入CO2 |
您最近一年使用:0次
2020-01-17更新
|
286次组卷
|
7卷引用:福建省晋江市养正中学2019-2020学年高二上学期第二次月考化学试题
名校
解题方法
8 . SO2溶于水后,与水反应生成H2SO3,下列对于H2SO3的性质预测正确的是( )
| A.有氧化性,无还原性,无酸性 |
| B.有氧化性,有还原性,有酸性 |
| C.有还原性,无氧化性,无酸性 |
| D.有还原性,无氧化性,有酸性 |
您最近一年使用:0次
2020-03-12更新
|
191次组卷
|
3卷引用:广西壮族自治区崇左市扶绥县第二中学2019-2020学年高一上学期期末考试化学试题
名校
9 . 某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5 μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)PM2.5分散在空气中形成的分散系________ (填“属于”或“不属于”)胶体。
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断待测试样为________ (填“酸”或“碱”)性,表示该试样酸碱性的c(H+)或c(OH-)=________ mol·L-1。
(3)煤燃烧排放的烟气含有SO2和NOx,形成酸雨,污染大气,采用NaClO2溶液在碱性条件下可对烟气进行脱硫,脱硝,效果非常好。完成下列对烟气脱硝过程的离子方程式。______  +
+______ NO+______ =______ Cl-+______  +
+______
(4)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。写出焦炭与水蒸气反应的化学方程式:__________________ 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是______ (填字母)。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(5)汽车尾气中NOx和CO的生成及转化。
①汽车启动后,汽缸温度越高,单位时间内NO排放量越大,写出汽缸中生成NO的化学方程式:_________________________________________________________________ 。
②汽车燃油不完全燃烧时产生CO,目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为__________________________________________________ 。
(1)PM2.5分散在空气中形成的分散系
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ |  |  |  | Cl- |
| 浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断待测试样为
(3)煤燃烧排放的烟气含有SO2和NOx,形成酸雨,污染大气,采用NaClO2溶液在碱性条件下可对烟气进行脱硫,脱硝,效果非常好。完成下列对烟气脱硝过程的离子方程式。
 +
+ +
+(4)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。写出焦炭与水蒸气反应的化学方程式:
②洗涤含SO2的烟气。以下物质可作洗涤剂的是
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(5)汽车尾气中NOx和CO的生成及转化。
①汽车启动后,汽缸温度越高,单位时间内NO排放量越大,写出汽缸中生成NO的化学方程式:
②汽车燃油不完全燃烧时产生CO,目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为
您最近一年使用:0次
2020-08-14更新
|
129次组卷
|
10卷引用:广西壮族自治区崇左市大新县大新中学2019-2020学年高一上学期期末考试化学试题
广西壮族自治区崇左市大新县大新中学2019-2020学年高一上学期期末考试化学试题广西来宾市忻城县高级中学2019-2020学年高一上学期期末考试化学试题天津市耀华中学2017-2018学年高一上学期期末考试化学试题鲁科版必修一2019—2020学年高一上学期期末考试模拟试题贵州省施秉县一中2019-2020学年高一上学期期末考试化学试题(已下线)4.3 防治二氧化硫对环境的污染练习(1)——《高中新教材同步备课》(苏教版 必修第一册)鲁科版(2019)高一必修第一册第3章 物质的性质与转化 总结检测黑龙江省齐齐哈尔三立高级中学2022届高三上学期开学考试化学试题山东省威海乳山市第一中学2022-2023学年高一上学期12月月考化学试题微项目 论证重污染天气“汽车限行”的合理性
名校
10 . 物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据图1和图2所示,回答下列问题:
(1)Y的化学式为__________________
(2)欲制备Na2S2O3,从氧化还原角度分析,合理的是______________ (填序号)。
a.Na2S +S b.Na2SO3+S c.Na2SO3+Na2SO4 d.SO2+Na2SO4
(3)将X与O2混合,可生成淡黄色固体。该反应的氧化剂与还原剂物质的量之比为_____________ 。
(4)图2为铜丝与W的浓溶液反应并验证其产物性质的实验装置。
Ⅰ.①中反应的化学方程式是_____________ 。想要立即终止①的反应,最恰当的方法是__________ 。
a.上移铜丝,使其脱离溶液 b.撤去酒精灯 c.拔去橡胶塞倒出溶液
Ⅱ.④中棉花团的作用是_________________ 。
Ⅲ.反应停止后,待装置冷却,把③取下后向其中加入氯水,观察到白色沉淀生成,写出相关反应的离子方程式_________________

图1
(1)Y的化学式为
(2)欲制备Na2S2O3,从氧化还原角度分析,合理的是
a.Na2S +S b.Na2SO3+S c.Na2SO3+Na2SO4 d.SO2+Na2SO4
(3)将X与O2混合,可生成淡黄色固体。该反应的氧化剂与还原剂物质的量之比为
(4)图2为铜丝与W的浓溶液反应并验证其产物性质的实验装置。

图2
Ⅰ.①中反应的化学方程式是
a.上移铜丝,使其脱离溶液 b.撤去酒精灯 c.拔去橡胶塞倒出溶液
Ⅱ.④中棉花团的作用是
Ⅲ.反应停止后,待装置冷却,把③取下后向其中加入氯水,观察到白色沉淀生成,写出相关反应的离子方程式
您最近一年使用:0次
2017-03-30更新
|
485次组卷
|
4卷引用:2016-2017学年广西南宁市第三中学高一下学期第一次月考化学试卷
2016-2017学年广西南宁市第三中学高一下学期第一次月考化学试卷(已下线)广西南宁市第三中学2016-2017学年高一下学期第一次月考化学试题高一必修第一册(鲁科2019)第3章 第2节 硫的转化高一必修第一册(苏教2019)专题4 第二单元 硫及其化合物的相互转化2



