1 . 回答下列问题:
(1)氢氧燃料电池在电解质溶液为KOH溶液时,写出氢氧燃料电池工作时的负极电极反应式:_____
(2)在浓硝酸中放入铜片:开始反应的化学方程式为_______ ;若铜有剩余,则反应将要结束时的化学方程式_______ 。
(3)标准状状况下,排空法收集氯化氢气体,做喷泉实验时,如果气体没有溢出,实验完成时所得溶液的物质的量浓度为_______ mol/L(保留两位有效数字)
(4)SiO2在自然界中广泛存在,它是制备现代通讯材料_______ (写该材料名称)的主要原料。
(1)氢氧燃料电池在电解质溶液为KOH溶液时,写出氢氧燃料电池工作时的负极电极反应式:
(2)在浓硝酸中放入铜片:开始反应的化学方程式为
(3)标准状状况下,排空法收集氯化氢气体,做喷泉实验时,如果气体没有溢出,实验完成时所得溶液的物质的量浓度为
(4)SiO2在自然界中广泛存在,它是制备现代通讯材料
您最近一年使用:0次
2 . 化学是一门以实验为基础的自然科学。根据题意回答下列问题:
(1)光导纤维的成分是_______ (写分子式)。
(2)检验溶液中是否含有NH ,先加
,先加_______ (填“NaOH”或“NaCl”)溶液共热,产生能使湿润的红色石蕊试纸变蓝色的气体,即有NH3。
(3)铝具有较强的抗腐蚀性能,主要原因是铝化学性质活泼,表面形成一层致密的氧化膜。要使氧化膜溶解,可以使用NaOH 溶液,其反应原理为Al2O3+2NaOH =2_______ +H₂O。
(1)光导纤维的成分是
(2)检验溶液中是否含有NH
 ,先加
,先加(3)铝具有较强的抗腐蚀性能,主要原因是铝化学性质活泼,表面形成一层致密的氧化膜。要使氧化膜溶解,可以使用NaOH 溶液,其反应原理为Al2O3+2NaOH =2
您最近一年使用:0次
名校
解题方法
3 . 地壳中的某种元素在现代高科技产品中占有重要位置,足见化学对现代文明的重要作用。例如:
(1)计算机芯片的主要成分是:_______ ;
(2)光导纤维的主要成分是:_______ ,其遇到强碱易被腐蚀,请写出该物质与氢氧化钠溶液反应的化学方程式:_______ 。
(1)计算机芯片的主要成分是:
(2)光导纤维的主要成分是:
您最近一年使用:0次
2021-12-29更新
|
341次组卷
|
3卷引用:黑龙江省佳木斯市农垦建三江管理局第二高级中学2021-2022学年高一下学期第一次月考化学试题
4 . (1)SiO2在自然界中广泛存在,它是制备现代通讯材料___ (写该材料名称)的主要原料;以SiO2为原料,在工业上制备单质粗硅的化学方程式为___ ;在常温下,SiO2可与一种酸发生反应,该反应的化学方程式为___ 。该反应的重要应用是__ 。
(2)在一定体积的18mol/L的浓硫酸加入过量铜片,加热使之反应,被还原的硫酸为0.9mol。则浓硫酸的实际体积___ (填“大于”“小于”或“等于”)100mL。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式__ 。
(3)根据下图操作及现象推断酸X为__ 。
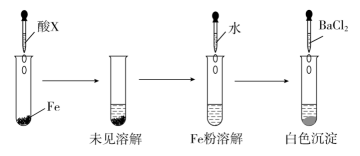
(2)在一定体积的18mol/L的浓硫酸加入过量铜片,加热使之反应,被还原的硫酸为0.9mol。则浓硫酸的实际体积
(3)根据下图操作及现象推断酸X为

您最近一年使用:0次
2021-06-23更新
|
152次组卷
|
2卷引用:黑龙江省哈尔滨市延寿县第二中学2020-2021学年高一5月月考化学试题
5 . 非金属及化合物是中学常见的重要物质。请根据题意,完成下列问题:
(1)下列哪种气体是酸雨的主要成分____________ ;
A.Cl2B.CO2C.SO2
(2)下列气体通入无色的稀酚酞溶液中,溶液变红色的是__________ ;
A.NH3B.NO2C.SO2
(3)下列物质,是制造光导纤维的材料__________ 。
A.Si B.SiO2C.Na2SiO3
(1)下列哪种气体是酸雨的主要成分
A.Cl2B.CO2C.SO2
(2)下列气体通入无色的稀酚酞溶液中,溶液变红色的是
A.NH3B.NO2C.SO2
(3)下列物质,是制造光导纤维的材料
A.Si B.SiO2C.Na2SiO3
您最近一年使用:0次
2020-06-01更新
|
192次组卷
|
3卷引用:黑龙江省鸡西市英桥高级中学2021-2022学年高一下学期期中考试化学试题
名校
6 . 化学知识与生产生活息息相关。
I.硅及其化合物
(1)硅及其化合物在现代信息技术中应用广泛。其中用于制造计算机芯片的材料是__________ (写化学式),用于制造光导纤维的材料是__________ (写化学式)。光导纤维在碱性土壤中易被腐蚀,请写出相关的离子反应方程式______________________
II.氯及其化合物
(2)漂白粉是生活常备用品,其主要成分是__________________ (写化学式);漂白粉保存不当易变质,请写出漂白粉失效的方程式________________ ;如不小心把漂白粉与洁厕灵(主要成分为盐酸)混合,易生成氯气使人中毒。请写出有关反应的离子方程式________________________ 。
(3)某实验小组,向一定量的石灰乳中缓慢匀速地通入足量氯气,发现产物中还混有了ClO3-,他们讨论后认为,是反应放热温度升高的原因。并画出了ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为下图(不考虑氯气和水的反应)。
①图中曲线I表示_____________ 离子的物质的量随反应时间变化的关系。
②所取石灰乳中含有Ca(OH)2的物质的量为__________ mol。
③另取一份与②等物质的量的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl-的物质的量为0.37mol,则产物中n(ClO-)/n(ClO3-)=______________ 。
III.氮及其化合物
(4)硝酸生产过程中排放出来的废气,含NO、NO2等大气污染物。
①工业上常用原理:NOx+NH3→N2+H2O,使其转化为无毒的N2,现有NO、NO2的混合3.0L,可与3.5L相同状况的NH3完全反应,全部转化为N2,则在原混合气体中NO和NO2的物质的量之比是_____________ ;
②已知碱能除去硝酸尾气:2NO2+2NaOH=NaNO2+NaNO3+H2O;NO+NO2+2NaOH=2NaNO2+H2O
根据硝酸尾气处理的反应原理,下列气体中不能被过量NaOH溶液吸收的是_______________
A.1molO2和4molNO2
B.1molO2和4molNO
C.1molNO和5molNO2
D.4molNO和1molNO2
(5)汽车排放的尾气中因含有氮的氧化物而污染大气,造成产生氮的氧化物的主要原因是_____________
A.燃烧含氮化合物燃料
B.燃烧含铅汽油
C.由于燃烧不充分
D.内燃机中空气中的N2在高温下被氧化
I.硅及其化合物
(1)硅及其化合物在现代信息技术中应用广泛。其中用于制造计算机芯片的材料是
II.氯及其化合物
(2)漂白粉是生活常备用品,其主要成分是
(3)某实验小组,向一定量的石灰乳中缓慢匀速地通入足量氯气,发现产物中还混有了ClO3-,他们讨论后认为,是反应放热温度升高的原因。并画出了ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为下图(不考虑氯气和水的反应)。
①图中曲线I表示
②所取石灰乳中含有Ca(OH)2的物质的量为
③另取一份与②等物质的量的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl-的物质的量为0.37mol,则产物中n(ClO-)/n(ClO3-)=

III.氮及其化合物
(4)硝酸生产过程中排放出来的废气,含NO、NO2等大气污染物。
①工业上常用原理:NOx+NH3→N2+H2O,使其转化为无毒的N2,现有NO、NO2的混合3.0L,可与3.5L相同状况的NH3完全反应,全部转化为N2,则在原混合气体中NO和NO2的物质的量之比是
②已知碱能除去硝酸尾气:2NO2+2NaOH=NaNO2+NaNO3+H2O;NO+NO2+2NaOH=2NaNO2+H2O
根据硝酸尾气处理的反应原理,下列气体中不能被过量NaOH溶液吸收的是
A.1molO2和4molNO2
B.1molO2和4molNO
C.1molNO和5molNO2
D.4molNO和1molNO2
(5)汽车排放的尾气中因含有氮的氧化物而污染大气,造成产生氮的氧化物的主要原因是
A.燃烧含氮化合物燃料
B.燃烧含铅汽油
C.由于燃烧不充分
D.内燃机中空气中的N2在高温下被氧化
您最近一年使用:0次
解题方法
7 . (1)光导纤维的主要成分是___ ,太阳能电池板的主要成分___ ;新制氯水呈___ 色,是因为有____ 溶在里面。
(2) 可以用________ 溶液区分SO2和CO2;________ 是一种有刺激性气味的碱性气体,能使红色石蕊试纸变蓝。硝酸中的N是+5价,具有强氧化性,因此硝酸与金属反应时_______ (填“能”或“不能”)生成氢气。
(2) 可以用
您最近一年使用:0次
名校
解题方法
8 . 按要求完成下列试题
(1)写出铝和氢氧化钾溶液反应的离子方程式:_______________
(2)实验室里制Cl2的离子方程式:_______________
(3)检验Cl-的方法为:_______________
(4)写出用熟石灰吸收氯气制漂白粉的化学方程式:_______________________________________ 。
(5)硅的用途为:_________________ ,二氧化硅的用途为:______________ ,
(6)向FeSO4溶液中滴入NaOH溶液现象为:_____________________________________________ ,请用化学方程式解释其现象:_______________
(7)在实验室里,制取氢氧化铝的离子方程式为:_______________
(8)过氧化钠和二氧化碳反应的化学方程式:_______________
根据这个反应过氧化钠的用途之一为:___________________________________ 。
(9)写出SO2使溴水褪色的化学方程式:___________________________________ 。
(10)请写出印刷电路板时铜和FeCl3溶液反应的离子方程式:______________________ 。
(1)写出铝和氢氧化钾溶液反应的离子方程式:
(2)实验室里制Cl2的离子方程式:
(3)检验Cl-的方法为:
(4)写出用熟石灰吸收氯气制漂白粉的化学方程式:
(5)硅的用途为:
(6)向FeSO4溶液中滴入NaOH溶液现象为:
(7)在实验室里,制取氢氧化铝的离子方程式为:
(8)过氧化钠和二氧化碳反应的化学方程式:
根据这个反应过氧化钠的用途之一为:
(9)写出SO2使溴水褪色的化学方程式:
(10)请写出印刷电路板时铜和FeCl3溶液反应的离子方程式:
您最近一年使用:0次
2016-12-09更新
|
175次组卷
|
2卷引用:2014-2015黑龙江省双鸭山市一中高一上期末化学试卷



