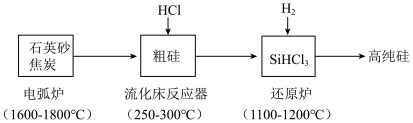
1 . 高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:___________ 。
(2)当有
 参与反应时,该反应转移的电子数是
参与反应时,该反应转移的电子数是___________ 。
(3)还原炉中发生的化学反应方程式为:___________ 。
(4)上述工艺生产中循环使用的物质除 、
、 外,还有
外,还有___________ 。
(5)工艺师常用氢氟酸来雕刻玻璃,该反应的化学方程式为___________ 。
(6)工业上可利用水玻璃和盐酸反应制备硅酸凝胶,进一步脱水处理可得到硅胶,写出水玻璃和盐酸反应的离子方程式:___________ 。
(7)关于硅及其相关化合物的叙述正确的是___________ 。
A.自然界中存在天然游离的硅单质
B.已知C与 的最高正价都是正四价,由于
的最高正价都是正四价,由于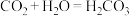 ,用类比法得知,
,用类比法得知,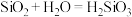
C.硅元素在金属与非金属的分界线处,因此具有弱导电性,一般可用于作为半导体材料
D. 既能和
既能和 溶液反应,又能和氢氟酸反应,所以是两性氧化物
溶液反应,又能和氢氟酸反应,所以是两性氧化物
E.玻璃、水泥、陶瓷都是传统的硅酸盐产品
(2)当有

 参与反应时,该反应转移的电子数是
参与反应时,该反应转移的电子数是(3)还原炉中发生的化学反应方程式为:
(4)上述工艺生产中循环使用的物质除
 、
、 外,还有
外,还有(5)工艺师常用氢氟酸来雕刻玻璃,该反应的化学方程式为
(6)工业上可利用水玻璃和盐酸反应制备硅酸凝胶,进一步脱水处理可得到硅胶,写出水玻璃和盐酸反应的离子方程式:
(7)关于硅及其相关化合物的叙述正确的是
A.自然界中存在天然游离的硅单质
B.已知C与
 的最高正价都是正四价,由于
的最高正价都是正四价,由于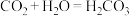 ,用类比法得知,
,用类比法得知,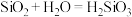
C.硅元素在金属与非金属的分界线处,因此具有弱导电性,一般可用于作为半导体材料
D.
 既能和
既能和 溶液反应,又能和氢氟酸反应,所以是两性氧化物
溶液反应,又能和氢氟酸反应,所以是两性氧化物E.玻璃、水泥、陶瓷都是传统的硅酸盐产品
您最近一年使用:0次
2024-08-14更新
|
53次组卷
|
2卷引用:广东省汕头市潮南区科利园实验学校2023-2024学年高一下学期第一次月考化学试题
2 . 高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:__________ 。当有1molC参与反应时,该反应转移的电子数是__________ 。
(2)还原炉中发生的化学反应方程式为:__________ 。
(3)上述工艺生产中循环使用的物质除Si、SiHCl3外,还有__________ 。
(4)工业上可利用水玻璃和盐酸反应制备硅酸凝胶,进一步脱水处理可得到硅胶,写出水玻璃和盐酸反应的离子方程式:__________ 。
(5)关于硅及其相关化合物的叙述正确的是__________ 。
A.自然界中存在天然游离的硅单质
B.因C与Si同族,由于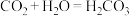 ,用类比法得知,
,用类比法得知,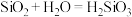
C.硅元素在金属与非金属的分界线处,因此具有弱导电性,一般可用于作为半导体材料
D.SiO2既能和NaOH溶液反应,又能和氢氟酸反应,所以是两性氧化物
E.玻璃、水泥、陶瓷都是传统的硅酸盐产品
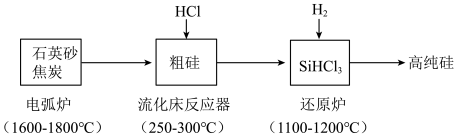
(2)还原炉中发生的化学反应方程式为:
(3)上述工艺生产中循环使用的物质除Si、SiHCl3外,还有
(4)工业上可利用水玻璃和盐酸反应制备硅酸凝胶,进一步脱水处理可得到硅胶,写出水玻璃和盐酸反应的离子方程式:
(5)关于硅及其相关化合物的叙述正确的是
A.自然界中存在天然游离的硅单质
B.因C与Si同族,由于
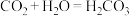 ,用类比法得知,
,用类比法得知,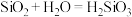
C.硅元素在金属与非金属的分界线处,因此具有弱导电性,一般可用于作为半导体材料
D.SiO2既能和NaOH溶液反应,又能和氢氟酸反应,所以是两性氧化物
E.玻璃、水泥、陶瓷都是传统的硅酸盐产品
您最近一年使用:0次
解题方法
3 . Ⅰ.非金属单质A经下图所示的过程可转化为含氧酸D,已知D为强酸。请回答下列问题。
①D的化学式是____________ 。
②在工业生产中,B气体大量排放,被雨水吸收后形成的___________ 会污染环境。
(2)若A在常温下为气体,C是红棕色的气体。
①A、C的化学式分别是____________ 、____________ 。
②D的浓溶液在常温下可与铜反应并生成C气体,该反应的化学方程式为__________ ;该反应_______ (填“属于”或“不属于”)氧化还原反应。
Ⅱ.已知A、B、C、D、E、F、G、H可以发生如图所示转化,反应中部分生成物已略去。其中,A、G为非金属单质,且常温下呈固态,形成G单质的元素在地壳中含量居第二位,B、C、H在通常情况下为气体,化合物C是一种能形成酸雨的大气污染物。
(3)写出E的一种用途:____________ 。
(4)反应②的离子方程式为___________ 。
(5)反应③的化学方程式是__________ 。
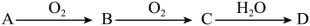
①D的化学式是
②在工业生产中,B气体大量排放,被雨水吸收后形成的
(2)若A在常温下为气体,C是红棕色的气体。
①A、C的化学式分别是
②D的浓溶液在常温下可与铜反应并生成C气体,该反应的化学方程式为
Ⅱ.已知A、B、C、D、E、F、G、H可以发生如图所示转化,反应中部分生成物已略去。其中,A、G为非金属单质,且常温下呈固态,形成G单质的元素在地壳中含量居第二位,B、C、H在通常情况下为气体,化合物C是一种能形成酸雨的大气污染物。
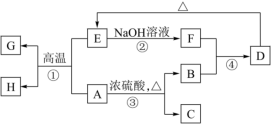
(3)写出E的一种用途:
(4)反应②的离子方程式为
(5)反应③的化学方程式是
您最近一年使用:0次
解题方法
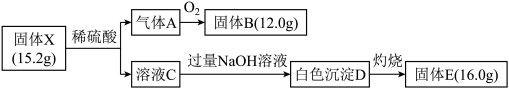
4 . 为探究某固体X(仅含两种短周期元素 )的组成和性质。设计并完成如下实验:
请回答:
(1)固体E的电子式为__________ 。
(2)固体X的化学式为__________ 。
(3)写出C→D的离子方程式__________ 。
(4)已知 与气体A在一定条件下反应后可得到一种耐高温材料(仅含两种元素,摩尔质量为
与气体A在一定条件下反应后可得到一种耐高温材料(仅含两种元素,摩尔质量为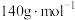 )和
)和 ,写出该反应的化学方程式
,写出该反应的化学方程式__________ 。
请回答:
(1)固体E的电子式为
(2)固体X的化学式为
(3)写出C→D的离子方程式
(4)已知
 与气体A在一定条件下反应后可得到一种耐高温材料(仅含两种元素,摩尔质量为
与气体A在一定条件下反应后可得到一种耐高温材料(仅含两种元素,摩尔质量为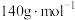 )和
)和 ,写出该反应的化学方程式
,写出该反应的化学方程式
您最近一年使用:0次
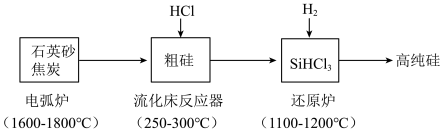
5 . I.高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:___________ 。当有1molC参与反应时,该反应转移的电子数目是___________ 。
(2)还原炉中发生的化学反应方程式为:___________ 。
(3)上述工艺生产中循环使用的物质除Si、 外,还有
外,还有___________ 。
(4)关于硅及其相关化合物的叙述正确的是___________。
Ⅱ.汽车尾气中含有CO、NO等多种污染物,回答以下问题。
(5)汽车燃料中一般不含氮,利用所学知识分析尾气中含有NO的原因:___________ (填化学方程式)。
(6)处理汽车尾气中NO和CO的一种方法:在汽车的排气管上装一个催化转化装置,使NO和CO在一定温度下均被催化转化为无毒气体。该反应的化学方程式为___________ 。
(7)NO、 都是空气污染物,等物质的量的NO和
都是空气污染物,等物质的量的NO和 的混合气体可与NaOH溶液反应生成
的混合气体可与NaOH溶液反应生成 ,反应的化学方程式为
,反应的化学方程式为___________ 。
(2)还原炉中发生的化学反应方程式为:
(3)上述工艺生产中循环使用的物质除Si、
 外,还有
外,还有(4)关于硅及其相关化合物的叙述正确的是___________。
| A.自然界中存在天然游离的硅单质 |
B.光导纤维的主要成分是 |
C.已知C与Si属于主族元素,由于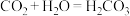 ,用类比法得知, ,用类比法得知,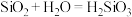 |
| D.硅酸钠的水溶液俗称水玻璃,具有粘性和耐高温,可以作为木材的粘合剂和防火材料。 |
Ⅱ.汽车尾气中含有CO、NO等多种污染物,回答以下问题。
(5)汽车燃料中一般不含氮,利用所学知识分析尾气中含有NO的原因:
(6)处理汽车尾气中NO和CO的一种方法:在汽车的排气管上装一个催化转化装置,使NO和CO在一定温度下均被催化转化为无毒气体。该反应的化学方程式为
(7)NO、
 都是空气污染物,等物质的量的NO和
都是空气污染物,等物质的量的NO和 的混合气体可与NaOH溶液反应生成
的混合气体可与NaOH溶液反应生成 ,反应的化学方程式为
,反应的化学方程式为
您最近一年使用:0次
2024-07-17更新
|
58次组卷
|
2卷引用:吉林省辽源市田家炳高中五校第七十七届期末联考2023-2024学年高一下学期7月期末考试化学试题
解题方法
6 . 层状结构的 薄膜能用于制作电极材料,
薄膜能用于制作电极材料, 薄膜由辉钼矿(主要含
薄膜由辉钼矿(主要含 及少量
及少量 、
、 )制得
)制得 后再与S经气相反应并沉积得到,其流程如下。
后再与S经气相反应并沉积得到,其流程如下。
(1)硫元素在周期表中位置_______ 。 的用途(写一种)
的用途(写一种)_______ 。
(2)“焙烧”时发生的主要反应的化学方程式_______ 。
(3)“浸取”后得到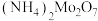 溶液,为提高“浸取”速率,可以采取的措施是(写一种)
溶液,为提高“浸取”速率,可以采取的措施是(写一种)_______ 。
(4)“滤渣”的主要成分除铁的氧化物外,还有_______ 。
(5)“灼烧”过程需回收利用的气体是_______ 。
(6)在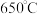 下气相沉积生成
下气相沉积生成 的反应需在特定气流中进行,选用
的反应需在特定气流中进行,选用 而不选用验纯后的
而不选用验纯后的 形成该气流的原因是
形成该气流的原因是_______ 。
(7)将 嵌入层状
嵌入层状 充电后得到的
充电后得到的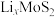 可作为电池负极,该负极放电时电极反应式
可作为电池负极,该负极放电时电极反应式_______ 。
 薄膜能用于制作电极材料,
薄膜能用于制作电极材料, 薄膜由辉钼矿(主要含
薄膜由辉钼矿(主要含 及少量
及少量 、
、 )制得
)制得 后再与S经气相反应并沉积得到,其流程如下。
后再与S经气相反应并沉积得到,其流程如下。
(1)硫元素在周期表中位置
 的用途(写一种)
的用途(写一种)(2)“焙烧”时发生的主要反应的化学方程式
(3)“浸取”后得到
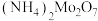 溶液,为提高“浸取”速率,可以采取的措施是(写一种)
溶液,为提高“浸取”速率,可以采取的措施是(写一种)(4)“滤渣”的主要成分除铁的氧化物外,还有
(5)“灼烧”过程需回收利用的气体是
(6)在
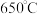 下气相沉积生成
下气相沉积生成 的反应需在特定气流中进行,选用
的反应需在特定气流中进行,选用 而不选用验纯后的
而不选用验纯后的 形成该气流的原因是
形成该气流的原因是(7)将
 嵌入层状
嵌入层状 充电后得到的
充电后得到的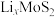 可作为电池负极,该负极放电时电极反应式
可作为电池负极,该负极放电时电极反应式
您最近一年使用:0次
名校
解题方法
7 . 含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)与A最外层电子数相同,但相对原子质量比A小的元素B的原子结构示意图为______ 。
(2)C与氢氟酸反应的化学方程式是_______ 。
(3)将C与纯碱混合高温熔融时反应生成D,同时还生成B的最高价氧化物E;将过量的E通入到D的水溶液中,生成了含A的化合物F。
①生成D的化学方程式为_______ ,生成F的化学方程式为_______ 。
②要将纯碱高温熔化,下列坩埚中可选用的是_______ 。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.铁坩埚
(1)与A最外层电子数相同,但相对原子质量比A小的元素B的原子结构示意图为
(2)C与氢氟酸反应的化学方程式是
(3)将C与纯碱混合高温熔融时反应生成D,同时还生成B的最高价氧化物E;将过量的E通入到D的水溶液中,生成了含A的化合物F。
①生成D的化学方程式为
②要将纯碱高温熔化,下列坩埚中可选用的是
A.普通玻璃坩埚 B.石英玻璃坩埚 C.铁坩埚
您最近一年使用:0次
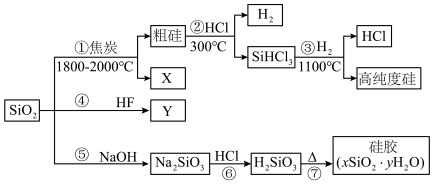
8 . 硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。二氧化硅又称硅石,是制备硅及其化合物的重要原料,部分转化过程如图所示。回答下面问题:___________ 。可以循环使用的物质为___________ (填化学式,下同)和___________ 。
(2)光导纤维是一种良好的通讯材料,其成分是___________ (填化学式)。
(3)生产磨砂玻璃时可以用HF溶蚀玻璃,是因为HF溶液可与SiO2反应,其化学方程式为___________ 。
(4)关于硅及其相关化合物的叙述正确的是___________ (填字母)。
A.晶体硅熔点高、硬度大,故可用作半导体材料
B.玻璃、水泥、陶瓷都是传统的硅酸盐产品
C.二氧化硅是酸性氧化物,所以能溶于水且可与水反应生成硅酸
D.SiO2既能和NaOH溶液反应,又能和氢氟酸反应,所以是两性氧化物
E.碳化硅是一种新型陶瓷材料,具有耐高温、耐磨的特点
(5)碳化硅是一种性能优异的无机非金属材料,它的熔点高,硬度大,电绝缘性好,化学性质稳定,但生产成本较高。根据氮和硅的原子结构示意图、元素周期律的知识,写出氮化硅的化学式___________ 。
(2)光导纤维是一种良好的通讯材料,其成分是
(3)生产磨砂玻璃时可以用HF溶蚀玻璃,是因为HF溶液可与SiO2反应,其化学方程式为
(4)关于硅及其相关化合物的叙述正确的是
A.晶体硅熔点高、硬度大,故可用作半导体材料
B.玻璃、水泥、陶瓷都是传统的硅酸盐产品
C.二氧化硅是酸性氧化物,所以能溶于水且可与水反应生成硅酸
D.SiO2既能和NaOH溶液反应,又能和氢氟酸反应,所以是两性氧化物
E.碳化硅是一种新型陶瓷材料,具有耐高温、耐磨的特点
(5)碳化硅是一种性能优异的无机非金属材料,它的熔点高,硬度大,电绝缘性好,化学性质稳定,但生产成本较高。根据氮和硅的原子结构示意图、元素周期律的知识,写出氮化硅的化学式
您最近一年使用:0次
名校
9 . 四氢铝钠(NaAlH4)是强还原剂,高铁酸钠( )是一种绿色净水剂。以工业制备硫酸的烧渣(主要成分为
)是一种绿色净水剂。以工业制备硫酸的烧渣(主要成分为 、
、 和
和 ,含少量
,含少量 )为原料制备四氢铝钠和高铁酸钠的流程如下,回答下列问题:
)为原料制备四氢铝钠和高铁酸钠的流程如下,回答下列问题:___________ (任写一个)。
(2)“转化”中 的具体作用是
的具体作用是___________ ;“分离”的操作是指___________ 。
(3)由 制备
制备 溶液的离子方程式为
溶液的离子方程式为___________ 。
(4)“沉铝”时通入过量 发生反应的离子方程式为
发生反应的离子方程式为___________ ;所得滤液中的溶质有___________ (写化学式)。
(5)“合成”中,发生反应的化学方程式为(乙醚作溶剂,不参与反应)___________ 。
(6) 中氢的化合价为
中氢的化合价为___________ ;“有效氢”指单位质量(1g)含氢还原剂的还原能力相当于多少克氢气的还原能力。则 的“有效氢”为
的“有效氢”为___________ (保留三位有效数字)。
 )是一种绿色净水剂。以工业制备硫酸的烧渣(主要成分为
)是一种绿色净水剂。以工业制备硫酸的烧渣(主要成分为 、
、 和
和 ,含少量
,含少量 )为原料制备四氢铝钠和高铁酸钠的流程如下,回答下列问题:
)为原料制备四氢铝钠和高铁酸钠的流程如下,回答下列问题: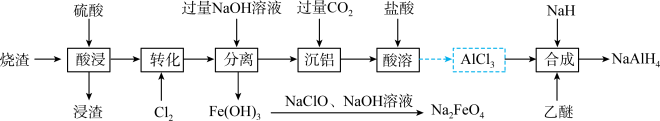
(2)“转化”中
 的具体作用是
的具体作用是(3)由
 制备
制备 溶液的离子方程式为
溶液的离子方程式为(4)“沉铝”时通入过量
 发生反应的离子方程式为
发生反应的离子方程式为(5)“合成”中,发生反应的化学方程式为(乙醚作溶剂,不参与反应)
(6)
 中氢的化合价为
中氢的化合价为 的“有效氢”为
的“有效氢”为
您最近一年使用:0次
10 . 高纯度的二氧化硅可用来制造光纤。某稻壳灰的主要成分为 、C及少量的
、C及少量的 、
、 、
、 、
、 等,通过如下流程可由稻壳灰制备较纯净的二氧化硅。
等,通过如下流程可由稻壳灰制备较纯净的二氧化硅。
(1)“滤渣A”的主要成分有_______ (填化学式),其中一种物质可用作外墙涂料,该物质的俗称为_______ 。
(2)步骤②滤液中主要存在的阳离子为 、
、 、
、_______ (填离子符号)。生成“滤渣B”的离子方程式为_______ 。
(3)实验室进行步骤③用到的仪器有坩埚钳、酒精灯、三脚架、泥三角和_______ 。
(4)为确认HCl、 、
、 的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。
的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。 溶液,其作用是
溶液,其作用是_______ 。
②装置C所盛试剂是_______ 溶液(填化学式)。
③由此可得出的结论是酸性:_______ 。
 、C及少量的
、C及少量的 、
、 、
、 、
、 等,通过如下流程可由稻壳灰制备较纯净的二氧化硅。
等,通过如下流程可由稻壳灰制备较纯净的二氧化硅。
(1)“滤渣A”的主要成分有
(2)步骤②滤液中主要存在的阳离子为
 、
、 、
、(3)实验室进行步骤③用到的仪器有坩埚钳、酒精灯、三脚架、泥三角和
(4)为确认HCl、
 、
、 的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。
的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。
 溶液,其作用是
溶液,其作用是②装置C所盛试剂是
③由此可得出的结论是酸性:
您最近一年使用:0次
2024-05-05更新
|
137次组卷
|
2卷引用:江苏省徐州市金科大联考2023-2024学年度下学期第一次质量检测高一化学试卷



