1 . 类比推理是化学中常用的思维方法,下列推理正确的是
| A.SiH4的沸点高于CH4,推测HCl的沸点也高于HF |
| B.Na2O2与CO2反应生成Na2CO3与O2,推测Na2O2与SO2反应生成Na2SO3与O2 |
| C.CO2气体通入足量Ca(ClO)2溶液生成CaCO3和HClO,推测CO2气体通入足量NaClO溶液生成Na2CO3和HClO |
| D.CO2为直线形分子,推测COS(氧硫化碳)也是直线形分子 |
您最近一年使用:0次
2 . 下列“类比”合理的是
| A.Na2O2与CO2反应生成Na2CO3和O2,则Na2O2与SO2反应生成Na2SO3和O2 |
| B.Na和O2在点燃条件下生成Na2O2,则Na在CO2中燃烧也有Na2O2生成 |
| C.Na3N与盐酸反应生成NaCl和NH4Cl,则Mg3N2与盐酸反应生成MgCl2和NH4Cl |
| D.NaCl固体和浓硫酸共热生成硫酸钠和氯化氢气体,则NaI固体和浓硫酸共热生成硫酸钠和碘化氢气体 |
您最近一年使用:0次
名校
解题方法
3 . Na2O2是重要的化工原料,具有多种用途。
(1)Na2O2具有氧化性,可以将SO2氧化为硫酸钠,写出该反应的化学方程式:____ ,该反应中,Na2O2的作用为____ (填“还原剂”“氧化剂”或“既是氧化剂又是还原剂”)。
(2)Na2O2与CO2反应可以产生氧气。某同学通过下列装置验证Na2O2能否与CO2反应。(图中铁架台等装置已略去)。
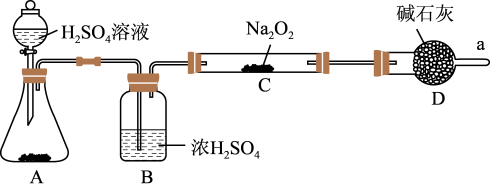
①装置A的名称是____ ,A中的固体为____ ,装置B中试剂的作用为___ 。
②若Na2O2能与CO2反应,则装置C中的现象是____ 。
(3)碱石灰(成分是氧化钙和NaOH固体)是干燥剂,在a处收集气体,检测发现该气体中没有氧气(过氧化钠足量),则说明过氧化钠与CO2气体不反应。该同学查阅相关文献,然后撤掉装置B,其他都保留(包括试剂),连接好装置后再次进行实验,重新收集气体检测,发现得到的气体几乎都是氧气,该实验结果说明过氧化钠与CO2气体反应需要____ 。
(4)将一定量的Na2O2固体投入到含有下列离子的溶液中:NO 、HCO
、HCO 、CO
、CO 、Na+,反应完毕后,溶液中上述离子数目几乎不变的有(不考虑溶液体积的变化)
、Na+,反应完毕后,溶液中上述离子数目几乎不变的有(不考虑溶液体积的变化)____ (填离子符号)。
(1)Na2O2具有氧化性,可以将SO2氧化为硫酸钠,写出该反应的化学方程式:
(2)Na2O2与CO2反应可以产生氧气。某同学通过下列装置验证Na2O2能否与CO2反应。(图中铁架台等装置已略去)。

①装置A的名称是
②若Na2O2能与CO2反应,则装置C中的现象是
(3)碱石灰(成分是氧化钙和NaOH固体)是干燥剂,在a处收集气体,检测发现该气体中没有氧气(过氧化钠足量),则说明过氧化钠与CO2气体不反应。该同学查阅相关文献,然后撤掉装置B,其他都保留(包括试剂),连接好装置后再次进行实验,重新收集气体检测,发现得到的气体几乎都是氧气,该实验结果说明过氧化钠与CO2气体反应需要
(4)将一定量的Na2O2固体投入到含有下列离子的溶液中:NO
 、HCO
、HCO 、CO
、CO 、Na+,反应完毕后,溶液中上述离子数目几乎不变的有(不考虑溶液体积的变化)
、Na+,反应完毕后,溶液中上述离子数目几乎不变的有(不考虑溶液体积的变化)
您最近一年使用:0次
2022-03-06更新
|
154次组卷
|
5卷引用:云南省丽江市第一高级中学2022-2023学年高一下学期期末考试化学试题
20-21高二下·江苏南通·阶段练习
解题方法
4 . 某溶液中含有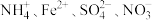 离子,分别取该溶液向其中加入指定物质,反应后的溶液中大量存在的一组离子正确的是
离子,分别取该溶液向其中加入指定物质,反应后的溶液中大量存在的一组离子正确的是
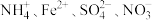 离子,分别取该溶液向其中加入指定物质,反应后的溶液中大量存在的一组离子正确的是
离子,分别取该溶液向其中加入指定物质,反应后的溶液中大量存在的一组离子正确的是A.加入过量稀 : :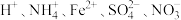 |
B.加入过量 溶液: 溶液: |
C.加入过量 溶液: 溶液: |
D.加入过量 : :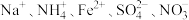 |
您最近一年使用:0次
5 . 如图装置,试管中盛有水(含酚酞),气球a中盛有干燥的Na2O2颗粒。U形管中注有浅红色的水。将气球用橡皮筋紧缚在试管口。实验时将气球中的Na2O2抖落到试管b的水中。
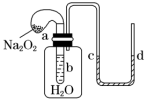
以下描述的现象不正确的是

以下描述的现象不正确的是
| A.气球a被吹大 | B.试管内溶液变淡黄色 |
| C.试管内溶液先变红后褪色 | D.U形管水位:d>c |
您最近一年使用:0次
6 . 如表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是
| 选项 | Ⅰ | Ⅱ | 判断 |
| A | 向滴有酚酞的水溶液中加Na2O2,溶液只变红 | Na2O2与水反应生成氢氧化钠 | Ⅰ对;Ⅱ对;有关系 |
| B | Na2O2可作潜水艇的供氧剂 | Na2O2能和CO2、H2O反应生成O2 | Ⅰ对;Ⅱ对;有关系 |
| C | 金属钠在空气中很容易变质 | 金属钠具有强还原性 | Ⅰ错;Ⅱ对;有关系 |
| D | 小苏打常用作发酵粉 | NaHCO3可与盐酸反应 | Ⅰ对;Ⅱ错;无关系 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
7 . 下列说法中正确的是( )
| A.过氧化钠投入硫酸亚铁溶液中剧烈反应生成白色沉淀和氢气 |
| B.铁丝在氯气中燃烧,可观察到集气瓶内有红棕色的雾出现 |
| C.过氧化钠可以作防毒面具中的供氧剂,还可作漂白剂 |
| D.通过过滤能区分氢氧化铁胶体和氯化铁溶液 |
您最近一年使用:0次
2021-01-31更新
|
245次组卷
|
3卷引用:湖南省常德市2020-2021学年高一上学期期末联考化学试题
8 . 某些氧化物在一定条件下能与 反应,且反应极有规律,如
反应,且反应极有规律,如 ;
;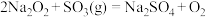 (g表示物质为气态)。据此判断下列化学方程式错误的是
(g表示物质为气态)。据此判断下列化学方程式错误的是
 反应,且反应极有规律,如
反应,且反应极有规律,如 ;
;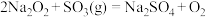 (g表示物质为气态)。据此判断下列化学方程式错误的是
(g表示物质为气态)。据此判断下列化学方程式错误的是A. | B.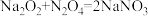 |
C.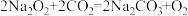 | D.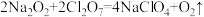 |
您最近一年使用:0次
解题方法
9 . SO2和NOx是主要的大气污染物。某学习小组认为一定条件下,用NH3与NO2反应转化为无污染物质可进行汽车尾气无害化处理。
(1)氨气的制备
①实验室制取氨气的化学方程式为________ 。
②实验室制备和收集纯净、干燥的氨气,可以选择如图装置中的______ (填字母序号),C中试剂为______ 。
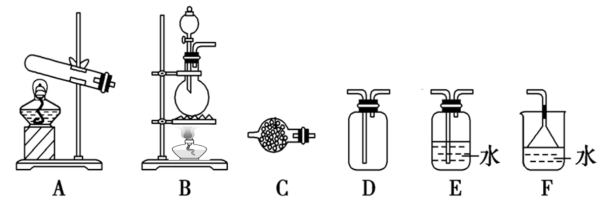
(2)氨气与二氧化氮的反应(已知:2NO2+2NaOH=NaNO3+NaNO2+H2O)。
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好),在一定温度下按如图装置进行实验。烧杯Z中应盛装___ 。
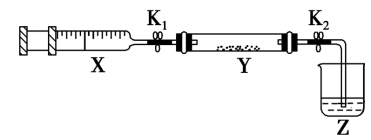
(3)该小组进一步研究SO2的性质,探究SO2能否与Na2O2发生氧化还原反应。实验室用铜丝和浓硫酸反应生成SO2的化学方程式为_______ 。利用(2)中装置,将Y中的药品更换为少量Na2O2,将注射器X中SO2慢推入Y中,Y装置中淡黄色粉末颜色变成白色。设计方案检验生成的白色物质中含有 ,其方案为
,其方案为_______ 。写出SO2与Na2O2反应的化学方程式并用单线桥标出电子转移的方向和数目_______ 。
(1)氨气的制备
①实验室制取氨气的化学方程式为
②实验室制备和收集纯净、干燥的氨气,可以选择如图装置中的

(2)氨气与二氧化氮的反应(已知:2NO2+2NaOH=NaNO3+NaNO2+H2O)。
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好),在一定温度下按如图装置进行实验。烧杯Z中应盛装

| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中 | ②反应的化学方程式 |
| 将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
| 打开K2 | ③ | ④ |
 ,其方案为
,其方案为
您最近一年使用:0次
名校
解题方法
10 . 下列关于金属及其化合物的说法正确的是
| A.已知CCl4不可燃且不与Na反应,故少量的Na可保存在CCl4液体中 |
| B.向紫色石蕊试液中加入较多Na2O2粉末,溶液变为蓝色并有气泡产生 |
| C.还原铁粉与水蒸气在高温下反应生成有磁性的氧化亚铁 |
| D.胃酸过多的病人,可以服用适量含有氢氧化铝的胃药 |
您最近一年使用:0次
2021-01-27更新
|
270次组卷
|
4卷引用:四川省绵阳市2020-2021学年高一上期期末考试化学试题



