解题方法
1 . 下列关于钠及其化合物的说法正确的是
A. 和 和 都具有强还原性 都具有强还原性 |
B. 和 和 长期露置于空气中,最终产物不相同 长期露置于空气中,最终产物不相同 |
C.将足量的 和 和 分别加入含有酚酞的水中,最终所得溶液均为红色 分别加入含有酚酞的水中,最终所得溶液均为红色 |
D.将少量 和 和 分别加入 分别加入 溶液中,均产生蓝色沉淀同时放出无色气体 溶液中,均产生蓝色沉淀同时放出无色气体 |
您最近一年使用:0次
2024-01-13更新
|
147次组卷
|
2卷引用:云南省昆明市五华区2023-2024学年高一上学期1月期末化学试题
名校
解题方法
2 . 有人设计出一种在隔绝空气条件下让钠与 溶液反应,观察
溶液反应,观察 颜色的实验。实验时,往
颜色的实验。实验时,往 的大试管中先加
的大试管中先加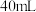 煤油,取
煤油,取 粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入
粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入 溶液
溶液 不含
不含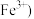 使煤油的液面至橡胶塞,并夹紧弹簧夹
使煤油的液面至橡胶塞,并夹紧弹簧夹 如图所示
如图所示 。下列说法错误的是
。下列说法错误的是

 溶液反应,观察
溶液反应,观察 颜色的实验。实验时,往
颜色的实验。实验时,往 的大试管中先加
的大试管中先加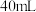 煤油,取
煤油,取 粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入
粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入 溶液
溶液 不含
不含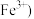 使煤油的液面至橡胶塞,并夹紧弹簧夹
使煤油的液面至橡胶塞,并夹紧弹簧夹 如图所示
如图所示 。下列说法错误的是
。下列说法错误的是

| A.长颈漏斗中的液面上升 |
| B.大试管下层溶液出现白色沉淀,并可持续较长时间 |
| C.用过氧化钠代替钠也可以观察到此现象 |
| D.该反应同时也能说明钠不能与硫酸亚铁溶液发生置换反应 |
您最近一年使用:0次
2023-10-05更新
|
252次组卷
|
4卷引用:北京师范大学附属中学2023-2024学年高一上学期期末考试化学试卷
北京师范大学附属中学2023-2024学年高一上学期期末考试化学试卷安徽省肥东县综合高中2022-2023学年高一上学期11月期中化学试题广东省东莞市东莞中学松山湖学校2023-2024学年高一上学期期中考试化学试卷(已下线)专题03 铁 金属材料-【寒假自学课】2024年高一化学寒假提升学与练(人教版2019)
名校
3 . 为了探究过氧化钠的强氧化性,某小组设计了如图所示的实验装置。实验步骤及现象如下:
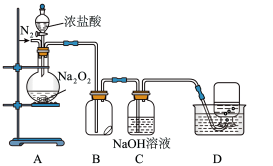
I.检查装置气密性后,装入药品并连接仪器。
Ⅱ.缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,A中剧烈反应,有黄绿色气体产生。
Ⅲ.待产生连续气泡后,将装置D中的导管末端伸入集气瓶中,收集到无色气体。
Ⅳ.反应一段时间后,关闭分液漏斗的活塞,再通一段时间N2,直至装置中气体变为无色。
回答下列问题:
(1)盛放浓盐酸的仪器名称是:___________ 滴加浓盐酸前先通一定量的N2,目的是___________ 。
(2)推测装置D中收集的无色气体是___________ ,进一步检验该气体成分的实验操作是___________ 。
(3)装置B中湿润的淀粉碘化钾试纸变蓝。甲同学认为是生成的氯气氧化了碘化钾;乙同学认为使试纸变蓝的原因也可能是___________ ;丙同学认为在此装置基础上增设一个装置就能证明甲、乙同学的结论。你认为丙同学的设计是___________ 。
(4)实验证明Na2O2能与HCl发生化学反应生成Cl2,该反应的化学方程式为:___________ 。

I.检查装置气密性后,装入药品并连接仪器。
Ⅱ.缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,A中剧烈反应,有黄绿色气体产生。
Ⅲ.待产生连续气泡后,将装置D中的导管末端伸入集气瓶中,收集到无色气体。
Ⅳ.反应一段时间后,关闭分液漏斗的活塞,再通一段时间N2,直至装置中气体变为无色。
回答下列问题:
(1)盛放浓盐酸的仪器名称是:
(2)推测装置D中收集的无色气体是
(3)装置B中湿润的淀粉碘化钾试纸变蓝。甲同学认为是生成的氯气氧化了碘化钾;乙同学认为使试纸变蓝的原因也可能是
(4)实验证明Na2O2能与HCl发生化学反应生成Cl2,该反应的化学方程式为:
您最近一年使用:0次
名校
4 . “类比”是预测物质性质与化学反应的重要方法之一,但“类比”不能违背客观事实,下列“类比”合理的是
| A.Na2O2与CO2反应生成Na2CO3和O2,则Na2O2与SO2反应生成Na2SO3和O2 |
| B.Na在空气中燃烧生成Na2O2,则同族的Li在空气中燃烧也生成Li2O2 |
| C.Al(OH)3溶于NaOH溶液生成Na[Al(OH)4],则Be(OH)2也能溶于NaOH溶液生成Na2[Be(OH)4] |
| D.Al3+与S2﹣在水溶液中因水解无法大量共存,则Fe3+与S2﹣在水溶液中也因水解无法大量共存 |
您最近一年使用:0次
2023-07-24更新
|
269次组卷
|
4卷引用:浙江省宁波市九校2022-2023学年高二上学期期末联考化学试题
5 . 下列各组物质之间可以按“物质A→物质B→物质C→物质D”关系直接转化的是
A.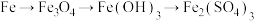 |
B.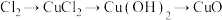 |
C. |
D. |
您最近一年使用:0次
6 . 过氧化钠可用作熔矿剂,使一些难溶于酸的矿物变成可溶于水或酸的物质。过氧化钠与铬铁矿[主要成分为亚铬酸亚铁 ]反应的化学方程式为
]反应的化学方程式为 。下列有关说法错误的是
。下列有关说法错误的是
 ]反应的化学方程式为
]反应的化学方程式为 。下列有关说法错误的是
。下列有关说法错误的是A. 和 和 反应,生成物为 反应,生成物为 |
B.该反应中的氧化产物是 和 和 |
C.若有 被氧化,则被 被氧化,则被 还原的 还原的 为 为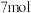 |
D.每生成 氧化钠转移电子的物质的量是 氧化钠转移电子的物质的量是 |
您最近一年使用:0次
2023-07-14更新
|
139次组卷
|
2卷引用:四川省凉山州2022-2023学年高二下学期期末考试化学试题
7 . 下列反应与 相比较,
相比较, 的作用相同的是
的作用相同的是
 相比较,
相比较, 的作用相同的是
的作用相同的是A.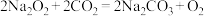 |
B.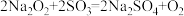 |
C.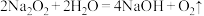 |
D. |
您最近一年使用:0次
解题方法
8 . 下列说法正确的是
A.相同条件下, 与稀盐酸反应速率比 与稀盐酸反应速率比 快 快 |
B. 能和水反应生成碱,所以是碱性氧化物 能和水反应生成碱,所以是碱性氧化物 |
C. 和 和 组成元素相同,与 组成元素相同,与 反应产物也相同 反应产物也相同 |
D. 具有强氧化性,可用作自来水的消毒剂 具有强氧化性,可用作自来水的消毒剂 |
您最近一年使用:0次
名校
9 . 化学实验是研究物质组成和探究物质性质的重要途径。
I.某澄清透明溶液(忽略水的电离),可能含有 、
、 、
、 、
、 、
、 、
、 、
、 等离子中的几种,且离子的物质的量相等(即离子数目相等),为分析其成分,取此溶液分别进行了三个实验,其操作和有关现象如图所示。请你根据上述实验推断:
等离子中的几种,且离子的物质的量相等(即离子数目相等),为分析其成分,取此溶液分别进行了三个实验,其操作和有关现象如图所示。请你根据上述实验推断:
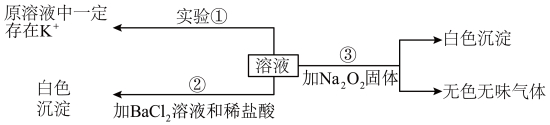
(1)实验①的焰色试验,需要透过_______ ,来观察火焰的颜色。
(2)取100mL溶液进行实验②,经足量盐酸洗涤、干燥后,得沉淀质量为2.33g。该溶液中 的物质的量浓度为
的物质的量浓度为_______ 。
(3)实验③产生的无色无味气体为_______ ,白色沉淀为_______ (填物质化学式)。原溶液中一定存在的离子有_______ 。
(4)向该溶液中加入硫酸酸化,再通入 气体,发生反应使该溶液的颜色发生变化,写出该反应的离子方程式
气体,发生反应使该溶液的颜色发生变化,写出该反应的离子方程式_______ (已知该反应中氧化剂和还原剂的个数比为2:5)。
Ⅱ. 具有强氧化性,
具有强氧化性, 具有还原性,某同学根据氧化还原反应的知识推测,
具有还原性,某同学根据氧化还原反应的知识推测, 与
与 能发生反应。为了验证此推测结果,该同学设计并进行了如图所示实验。其中装置A用锌和稀盐酸制取氢气。
能发生反应。为了验证此推测结果,该同学设计并进行了如图所示实验。其中装置A用锌和稀盐酸制取氢气。
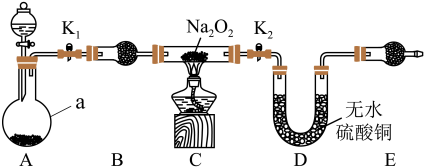
(5)仪器a的名称是_______ ,装置B的作用是_______ 。
(6)下面是实验过程中的重要操作,正确的顺序是_______。
(7)实验过程中观察到淡黄色粉末慢慢变成白色固体,无水硫酸铜未变蓝色。由此可推测出 与
与 反应生成的产物为
反应生成的产物为_______ 。
I.某澄清透明溶液(忽略水的电离),可能含有
 、
、 、
、 、
、 、
、 、
、 、
、 等离子中的几种,且离子的物质的量相等(即离子数目相等),为分析其成分,取此溶液分别进行了三个实验,其操作和有关现象如图所示。请你根据上述实验推断:
等离子中的几种,且离子的物质的量相等(即离子数目相等),为分析其成分,取此溶液分别进行了三个实验,其操作和有关现象如图所示。请你根据上述实验推断:
(1)实验①的焰色试验,需要透过
(2)取100mL溶液进行实验②,经足量盐酸洗涤、干燥后,得沉淀质量为2.33g。该溶液中
 的物质的量浓度为
的物质的量浓度为(3)实验③产生的无色无味气体为
(4)向该溶液中加入硫酸酸化,再通入
 气体,发生反应使该溶液的颜色发生变化,写出该反应的离子方程式
气体,发生反应使该溶液的颜色发生变化,写出该反应的离子方程式Ⅱ.
 具有强氧化性,
具有强氧化性, 具有还原性,某同学根据氧化还原反应的知识推测,
具有还原性,某同学根据氧化还原反应的知识推测, 与
与 能发生反应。为了验证此推测结果,该同学设计并进行了如图所示实验。其中装置A用锌和稀盐酸制取氢气。
能发生反应。为了验证此推测结果,该同学设计并进行了如图所示实验。其中装置A用锌和稀盐酸制取氢气。
(5)仪器a的名称是
(6)下面是实验过程中的重要操作,正确的顺序是_______。
A.加热至 逐渐熔化,反应一段时间 逐渐熔化,反应一段时间 | B.用小试管收集气体并检验其纯度 |
C.打开 、 、 ,通入氢气 ,通入氢气 | D.停止加热,充分冷却,关闭 、 、 |
 与
与 反应生成的产物为
反应生成的产物为
您最近一年使用:0次
2023-02-09更新
|
264次组卷
|
2卷引用:江西省萍乡市2022-2023学年高一上学期期末考试化学试题
名校
10 . 类比思想是化学学习中的重要思想,下列各项中由客观事实类比得到的结论正确的是
| 选项 | 客观事实 | 类比结论 |
| A | 电解熔融的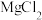 制备镁 制备镁 | 电解熔融的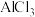 可制备铝 可制备铝 |
| B |  与 与 溶液反应生成 溶液反应生成 |  与 与 溶液反应可生成 溶液反应可生成 |
| C |  与 与 反应生成 反应生成 和 和 |  与 与 反应生成 反应生成 和 和 |
| D |  可作净水剂 可作净水剂 |  也可作净水剂 也可作净水剂 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-02-08更新
|
307次组卷
|
4卷引用:河北省沧州市2022-2023学年高三上学期期末考试化学试题



