名校
解题方法
1 . 化学在工农业生产和日常生活中都有重要应用。下列叙述正确的是
| A.雾霾天气对人的健康造成危害,“雾”和“霾”的分散质微粒相同 |
| B.碳酸氢钠药片可用于治疗胃酸过多,与醋同服可提高疗效 |
| C.食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用都是防止食品氧化变质 |
| D.碳酸钠可用作食用碱 |
您最近一年使用:0次
名校
解题方法
2 . 下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 陈述Ⅲ |
| A | 纯碱可用于治疗胃酸过多 | 纯碱可与盐酸反应 | Ⅰ对,Ⅱ对,无 |
| B | 将过氧化钠加入石蕊溶液中,石蕊先变红,后褪色 | 过氧化钠与水反应生成氢氧化钠,有氧化性物质生成 | Ⅰ对,Ⅱ对,有 |
| C | 金属钠保存在煤油中以隔绝空气 | 常温下,金属钠在空气中会被氧化生成过氧化钠 | Ⅰ对,Ⅱ对,有 |
| D | 过氧化钠可用于制作呼吸面罩 | 过氧化钠能和 、 、 反应生成氧气 反应生成氧气 | Ⅰ对,Ⅱ对,有 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-10-17更新
|
657次组卷
|
6卷引用:湖北省重点高中智学联盟2023-2024学年高一上学期10月联考化学试题
名校
解题方法
3 . 下列日常生活中的物质与其用途不对应的是
| A.NaCl——用作调味品 | B. ——配制生理盐水 ——配制生理盐水 |
C. ——用作补钙剂 ——用作补钙剂 | D. ——焙制糕点 ——焙制糕点 |
您最近一年使用:0次
2023-10-13更新
|
205次组卷
|
2卷引用:湖北省荆州中学2023-2024学年高一上学期10月月考化学试题
名校
解题方法
4 . 关于物质分类的正确组合是
| 分类组合 | 碱 | 酸 | 碱性氧化物 | 酸性氧化物 | 纯净物 |
| A |  |  |  |  | 合金 |
| B | 纯碱 |  |  |  | 硫酸 |
| C |  |  |  |  | 盐酸 |
| D |  |  |  | 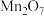 | 胆矾 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
5 . 利用如图装置,将试剂①逐滴加入试剂②中,对③中现象的预测一定不能实现的是
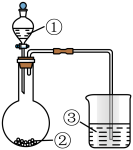

试剂① | 试剂② | 试剂③ | 对③现象的预测 | |
A | 双氧水 | MnO2 | KI溶液+淀粉溶液+稀硫酸 | 溶液呈现特殊的蓝色 |
B | 浓盐酸 | MnO2 | KSCN溶液+FeCl2溶液 | 溶液呈现血红色 |
C | 盐酸 | 石灰石 | Na2CO3饱和溶液 | 有白色浑浊 |
D | 浓氨水 | 生石灰 | AlCl3溶液 | 出现白色胶状沉淀 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
6 . 下列有关实验操作正确的是
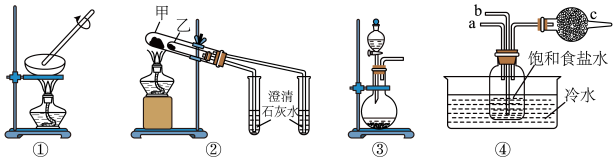

| A.用装置①做钠在空气中燃烧的实验 |
| B.装置②可用于证明碳酸钠与碳酸氢钠的热稳定性,乙试管中装碳酸氢钠 |
| C.用二氧化锰和浓盐酸制氯气,可在装置③中进行 |
| D.装置④是模拟“侯氏制碱法”制取NaHCO3的部分装置,CO2应该从a口通入 |
您最近一年使用:0次
2023-07-15更新
|
304次组卷
|
3卷引用:湖北省黄冈市2022-2023学年高一上学期11月期中考试化学试题
解题方法
7 . 类比是研究物质性质常用的方法之一,下列类比不合理的是
A.由 能与 能与 反应生成 反应生成 ,推测 ,推测 能与 能与 反应生成 反应生成 |
| B.向碳酸钠固体滴加几滴水,测得温度上升,推测向碳酸氢钠固体滴几滴水温度也上升 |
| C.硅可作半导体器件,推测周期表金属与非金属交界线的锗具有半导体性能 |
D. 溶液能与 溶液能与 反应,推测 反应,推测 溶液能与稀硫酸反应 溶液能与稀硫酸反应 |
您最近一年使用:0次
2023-02-17更新
|
340次组卷
|
2卷引用:湖北省黄冈市重点校2022-2023学年高一下学期期末综合选拔性联考化学试题
名校
8 . 下列有关物质的性质与用途,具有对应关系的是
A. 溶液显碱性,可用于实验室制取 溶液显碱性,可用于实验室制取 |
| B.NaClO具有强氧化性,常作为杀菌、消毒剂 |
C.Na能与 反应,可用于工业制食盐 反应,可用于工业制食盐 |
D. 的溶液显酸性,可用于图书馆灭火 的溶液显酸性,可用于图书馆灭火 |
您最近一年使用:0次
2022-11-04更新
|
113次组卷
|
4卷引用:湖北省宜昌市协作体2022-2023学年高一上学期期中考试化学试题
9 . 纯碱 是一种重要的化工原料。实验室利用侯氏制碱法原理制备纯碱的流程如图所示:
是一种重要的化工原料。实验室利用侯氏制碱法原理制备纯碱的流程如图所示:
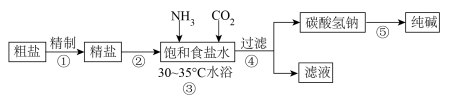
已知:i.氨气极易溶于水,且氨水呈碱性;
ii.实验所用粗盐中含有杂质 、
、 和
和 。
。
回答下列问题:
(1)过滤时常用到的玻璃仪器为_______ 。
(2)精制粗盐时,为除去 、
、 和
和 ,应依次加入
,应依次加入_______ 、_______ 、NaOH溶液,过滤,然后加入盐酸。
(3)步骤③中发生反应的化学方程式为_______ 。实验中先通入 的目的是
的目的是_______ 。
(4)步骤⑤由碳酸氢钠制备纯碱的方法是_______ ,对应的化学方程式为_______ 。
(5)请设计实验证明纯碱溶液呈碱性:_______
 是一种重要的化工原料。实验室利用侯氏制碱法原理制备纯碱的流程如图所示:
是一种重要的化工原料。实验室利用侯氏制碱法原理制备纯碱的流程如图所示:
已知:i.氨气极易溶于水,且氨水呈碱性;
ii.实验所用粗盐中含有杂质
 、
、 和
和 。
。回答下列问题:
(1)过滤时常用到的玻璃仪器为
(2)精制粗盐时,为除去
 、
、 和
和 ,应依次加入
,应依次加入(3)步骤③中发生反应的化学方程式为
 的目的是
的目的是(4)步骤⑤由碳酸氢钠制备纯碱的方法是
(5)请设计实验证明纯碱溶液呈碱性:
您最近一年使用:0次
名校
解题方法
10 . 化工专家侯德榜发明的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献,某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备NaHCO3,进一步处理得到产品Na2CO3和NH4Cl,实验流程如图:
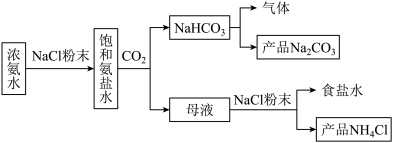
回答下列问题:
(1)侯氏制碱的主要产品是Na2CO3,其俗名是_______ 。
(2)生成NaHCO3的总反应的化学方程式为_______ 。
(3)从下图A~E中选择合适的仪器制备NaHCO3,正确的连接顺序是_______ (按气流方向,用小写字母表示),A中仪器M的名称为_______ ,B中使用雾化装置的优点是_______ 。
A.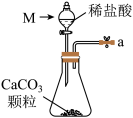 B.
B.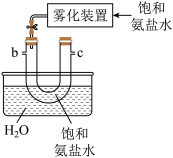 C.
C.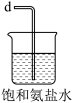
D.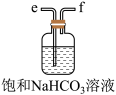 E.
E.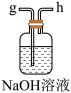
(4)反应完成后,将B中U形管内的混合物处理得到固体NaHCO3和滤液:
①灼烧NaHCO3,发生反应为:2NaHCO3 Na2CO3+H2O↑+CO2↑。
Na2CO3+H2O↑+CO2↑。
若灼烧前后固体质量减少1.24g,则生成的Na2CO3的质量为_______ g。
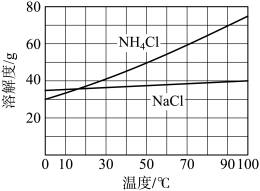
②向滤液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)→NaCl(aq)+NH4Cl(s)过程。为使NH4Cl沉淀充分析出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为蒸发浓缩、_______ 、过滤、洗涤、干燥。
(5)工业纯碱中可能混有少量NaCl,同学们对工业纯碱样品展开探究。
探究一:确定纯碱样品中是否含有NaCl
有同学认为该实验方案有错误,正确方案应选用_______ (填字母)代替稀盐酸。
a.CaCl2溶液 b.稀硝酸 c.BaCl2溶液
探究二:测定纯碱样品中Na2CO3的质量分数
【方案1】称取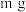 样品溶解,加入过量CaCl2溶液,搅拌至反应完全。过滤、洗涤、干燥,称量沉淀的质量为n g,则样品中Na2CO3的质量分数为
样品溶解,加入过量CaCl2溶液,搅拌至反应完全。过滤、洗涤、干燥,称量沉淀的质量为n g,则样品中Na2CO3的质量分数为_______ 。
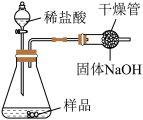
【方案2】如图所示,取样品于锥形瓶中,加入足量稀盐酸。反应结束后,根据干燥管增重计算Na2CO3的质量分数。若结果大于100%,可能的原因是_______ 。

回答下列问题:
(1)侯氏制碱的主要产品是Na2CO3,其俗名是
(2)生成NaHCO3的总反应的化学方程式为
(3)从下图A~E中选择合适的仪器制备NaHCO3,正确的连接顺序是
A.
 B.
B. C.
C.
D.
 E.
E.
(4)反应完成后,将B中U形管内的混合物处理得到固体NaHCO3和滤液:
①灼烧NaHCO3,发生反应为:2NaHCO3
 Na2CO3+H2O↑+CO2↑。
Na2CO3+H2O↑+CO2↑。若灼烧前后固体质量减少1.24g,则生成的Na2CO3的质量为
②向滤液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)→NaCl(aq)+NH4Cl(s)过程。为使NH4Cl沉淀充分析出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为蒸发浓缩、

(5)工业纯碱中可能混有少量NaCl,同学们对工业纯碱样品展开探究。
探究一:确定纯碱样品中是否含有NaCl
| 实验操作 | 现象 | 结论 |
| 取样品加水溶解,加入过量稀盐酸至反应完全 | 有气泡产生 | 样品中有NaCl |
| 向上述溶液中继续滴加适量AgNO3溶液 | 有 |
a.CaCl2溶液 b.稀硝酸 c.BaCl2溶液
探究二:测定纯碱样品中Na2CO3的质量分数
【方案1】称取
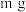 样品溶解,加入过量CaCl2溶液,搅拌至反应完全。过滤、洗涤、干燥,称量沉淀的质量为n g,则样品中Na2CO3的质量分数为
样品溶解,加入过量CaCl2溶液,搅拌至反应完全。过滤、洗涤、干燥,称量沉淀的质量为n g,则样品中Na2CO3的质量分数为【方案2】如图所示,取样品于锥形瓶中,加入足量稀盐酸。反应结束后,根据干燥管增重计算Na2CO3的质量分数。若结果大于100%,可能的原因是

您最近一年使用:0次



