名校
解题方法
1 . 为从粗食盐水中除去 、
、 、
、 等离子,以制得精盐水,某同学设计如下方案:
等离子,以制得精盐水,某同学设计如下方案:
 、
、 、
、 等离子,以制得精盐水,某同学设计如下方案:
等离子,以制得精盐水,某同学设计如下方案: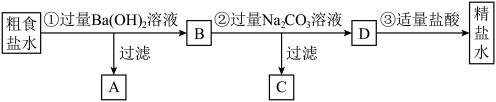
A. 中主要有 中主要有 和 和 ,也可能有一些 ,也可能有一些 |
B.②中加入过量 溶液的主要目的是为了除去 溶液的主要目的是为了除去 、 、 |
C. 中主要只有 中主要只有 、 、 、 、 这3种离子 这3种离子 |
D.③中发生的反应只有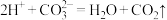 |
您最近一年使用:0次
2024-01-27更新
|
246次组卷
|
29卷引用:江苏省盐城市2021-2022学年高一下学期期末考试化学试题
江苏省盐城市2021-2022学年高一下学期期末考试化学试题北京市昌平区2019-2020学年高一上学期期末考试化学试题辽宁省营口市2020-2021学年高一上学期期末考试化学试题专题3 第三单元 海洋化学资源的综合利用-高中化学苏教2019版必修第一册北京市房山区2020-2021学年高一上学期期末考试化学试题河南省濮阳市油田第一中学2021年高一上学期第一次月考化学试题云南省昆明市第三中学2021-2022学年高一下学期期中考试化学试题湖北省武汉市第十一中学2022-2023学年高一上学期10月月考化学试题浙江省嘉善中学2022-2023学年高一上学期10月份检测化学试题四川省成都外国语学校2022-2023学年高一上学期期中考试化学试题北京市第二中学2022-2023学年高一上学期11月月考化学试题福建省厦门市第十中学2022-2023学年高一上学期期中考试化学试题天津市和平区2022-2023学年高一上学期期末考试化学试题陕西省西安市鄠邑区2022-2023学年高一下学期期中考试化学试题山西省实验中学2023-2024学年高一上学期第一次月考化学试题河南省焦作市博爱县第一中学2023-2024学年高三上学期9月月考化学试题福建省厦门市翔安第一中学2023-2024学年高三上学期10月月考化学试题福建省三明第一中学2023-2024学年高一上学期期中考试化学试题四川省宜宾市叙州区第二中学校2023-2024学年高二上学期10月月考化学试题河南省焦作市博爱县第一中学2023-2024学年高二上学期10月月考化学试题福建省厦门市湖滨中学2023-2024学年高一上学期期中考试化学试题福建省福清西山学校2023-2024学年高一上学期12月月考化学试题福建省三明市五校2023-2024学年高一上学期期中联考化学试题湖南省衡阳市衡阳县2023-2024学年高一上学期1月期末考试化学试题黑龙江省鸡西市密山市2023-2024学年高二上学期9月月考化学试题四川省绵阳市三台中学2023-2024学年高一下学期3月月考化学试题北京师范大学第二附属中学2023-2024学年高一下学期3月化学测试题5.1.3 硫酸根离子检验、粗盐的提纯 随堂练习安徽省合肥市第一六八中2023-2024学年高一下学期期中考试化学试题
11-12高三·北京·阶段练习
名校
2 . 过氧化氢俗称双氧水,为运输、使用的方便,工业常将H2O2转化为固态的过碳酸钠晶体(其化学式为2Na2CO3.3H2O2),该晶体具有Na2CO3和H2O2的双重性质。下列物质不会使过碳酸钠晶体失效的是
| A.MnO2 | B.H2S | C.稀盐酸 | D.NaHCO3 |
您最近一年使用:0次
2023-08-26更新
|
251次组卷
|
12卷引用:江苏省2001年高中学生化学奥林匹克竞赛(初赛)试题
江苏省2001年高中学生化学奥林匹克竞赛(初赛)试题(已下线)2013届北京市北师特学校高三第二次月考化学试卷(已下线)2012-2013学年湖北省沙市中学高一第六次周考化学试卷2016-2017学年天津市部分区高一上学期期末化学试卷河南省商丘市第一高级中学2017-2018学年高一上学期第二次月考化学试题人教版(2019)高一必修第一册 第二章 第一节综合训练天津市部分区2020-2021学年高一上学期期中考试化学试题江西省赣州市信丰中学2020-2021学年高三上学期第二次月考化学试题辽宁省鞍山市岫岩满族自治县高级中学2021-2022学年高三下学期期中质量检测化学试题云南省昭通市盐津县第三中学2021-2022学年高一上学期12月考试化学试题辽宁省大连市第八中学2022-2023学年高三上学期10月月考化学试题浙江金华第一中学2023-2024学年高一上学期10月月考化学试题
3 . 纯碱是玻璃、制皂、造纸、纺织和漂染等工业的基本原料。
I.我国著名科学家侯德榜先生改进索尔维法(又名氨碱法)制取纯碱,生产出 和
和 两种产品。侯氏联合制碱法的工艺流程如下:
两种产品。侯氏联合制碱法的工艺流程如下:

(1)该流程中生成 的化学方程式为
的化学方程式为_______ 。
(2)由 制得
制得 产品的化学方程式为
产品的化学方程式为_______ 。
(3)向母液b中通氨气并加入食盐粉,通氨气的作用有_______(填序号)。
Ⅱ.常温下,向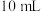 含
含 的溶液中,逐滴加入含溶质
的溶液中,逐滴加入含溶质 的盐酸溶液
的盐酸溶液 ,溶液中含碳元素的各种微粒的含量随溶液
,溶液中含碳元素的各种微粒的含量随溶液 变化的部分情况如图所示。
变化的部分情况如图所示。

(4)在滴加盐酸的过程中 的数目变化的原因是
的数目变化的原因是_______ 、_______ (分别用离子方程式表示)。
(5)反应结束时,溶液中含碳元素的微粒的含量比反应开始时低的原因是_______ 。
Ⅲ.某实验小组将 和固体分别配制成
和固体分别配制成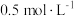 的溶液,设计如下方案并对反应现象作出预测:
的溶液,设计如下方案并对反应现象作出预测:
(6)实际实验后,发现操作2的现象为产生白色沉淀和气体,与预测有差异。则该条件下, 溶液与
溶液与 溶液反应的离子方程式为
溶液反应的离子方程式为_______ 。
I.我国著名科学家侯德榜先生改进索尔维法(又名氨碱法)制取纯碱,生产出
 和
和 两种产品。侯氏联合制碱法的工艺流程如下:
两种产品。侯氏联合制碱法的工艺流程如下:
(1)该流程中生成
 的化学方程式为
的化学方程式为(2)由
 制得
制得 产品的化学方程式为
产品的化学方程式为(3)向母液b中通氨气并加入食盐粉,通氨气的作用有_______(填序号)。
A.使 结晶析出 结晶析出 | B.使 更多地析出 更多地析出 |
C.增大 浓度,使 浓度,使 更多地析出 更多地析出 | D.使 转化为 转化为 ,提高析出的 ,提高析出的 纯度 纯度 |
Ⅱ.常温下,向
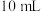 含
含 的溶液中,逐滴加入含溶质
的溶液中,逐滴加入含溶质 的盐酸溶液
的盐酸溶液 ,溶液中含碳元素的各种微粒的含量随溶液
,溶液中含碳元素的各种微粒的含量随溶液 变化的部分情况如图所示。
变化的部分情况如图所示。
(4)在滴加盐酸的过程中
 的数目变化的原因是
的数目变化的原因是(5)反应结束时,溶液中含碳元素的微粒的含量比反应开始时低的原因是
Ⅲ.某实验小组将
 和固体分别配制成
和固体分别配制成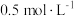 的溶液,设计如下方案并对反应现象作出预测:
的溶液,设计如下方案并对反应现象作出预测:| 实验方案 | 预测现象 | 预测依据 |
操作1:向 溶液中滴加 溶液中滴加  溶液 溶液 | 有白色沉淀 |  溶液中的 溶液中的 浓度较大,能与 浓度较大,能与 发生反应 发生反应 |
操作2:向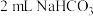 溶液中滴加 溶液中滴加  溶液 溶液 | 无白色沉淀 |  溶液中的 溶液中的 浓度很小,不能与 浓度很小,不能与 反应 反应 |
 溶液与
溶液与 溶液反应的离子方程式为
溶液反应的离子方程式为
您最近一年使用:0次
2023-03-09更新
|
211次组卷
|
2卷引用:江苏省苏州市木渎高级中学2022-2023学年高一下学期期初调研化学试题
名校
解题方法
4 . 向等物质的量浓度的NaOH和 的混合溶液中加入稀盐酸。下列离子方程式与事实不相符的是
的混合溶液中加入稀盐酸。下列离子方程式与事实不相符的是
 的混合溶液中加入稀盐酸。下列离子方程式与事实不相符的是
的混合溶液中加入稀盐酸。下列离子方程式与事实不相符的是A. |
B. |
C. |
D. |
您最近一年使用:0次
2022-12-08更新
|
317次组卷
|
4卷引用:江苏省南京师范大学附属中学2022-2023学年高一上学期12月月考化学试题
名校
解题方法
5 . 某K2CO3固体样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种。现将13.8g样品加入足量水,样品全部溶解,再加入过量的CaCl2溶液,得到9g沉淀。对样品所含杂质判断完全正确的是
| A.肯定有KNO3,可能还含有Na2CO3 | B.肯定有KNO3,没有Na2CO3 |
| C.肯定没有Ba(NO3)2,可能有KNO3 | D.肯定没有Na2CO3和Ba(NO3)2 |
您最近一年使用:0次
2022-09-26更新
|
502次组卷
|
13卷引用:江苏省南菁高级中学2020-2021学年高一上学期第一次阶段性检测考试化学试题
江苏省南菁高级中学2020-2021学年高一上学期第一次阶段性检测考试化学试题浙江省温州市新力量联盟2018-2019学年高一上学期期末考试化学试题(已下线)【新东方】2020-55吉林省长春市第八中学2020-2021学年高一上学期第一次月考化学试题浙江省淳安县汾口中学2020-2021学年高二12月月考化学试题上海市格致中学2021-2022学年高三下学期模拟考试化学试题上海市格致中学2021-2022学年高三下学期模拟考试化学试题(已下线)第二章 化学物质及其变化(测)-2023年高考化学一轮复习讲练测(全国通用)黑龙江省龙西北八校联合体2022-2023学年高一上学期第一次月考化学试题辽宁省大连育明高级中学2022-2023学年高一上学期10月月考化学试题甘肃省张掖市高台县第一中学2022-2023学年高一下学期开学检测化学试题内蒙古赤峰红旗中学2022-2023学年高一上学期11月期中考试化学试题浙江省淳安县汾口中学2023-2024学年高二上学期12月检测化学试题
名校
解题方法
6 . 关于Na2CO3和NaHCO3性质的叙述正确的是
| A.在水中的溶解度:Na2CO3<NaHCO3 |
| B.热稳定性:Na2CO3>NaHCO3 |
| C.与酸反应放出气体的速率:Na2CO3>NaHCO3 |
| D.Na2CO3不能转化成NaHCO3,而NaHCO3能转化为Na2CO3 |
您最近一年使用:0次
2021-11-17更新
|
778次组卷
|
21卷引用:2015-2016学年江苏省海安实验中学高一上学期期中测试化学试卷
2015-2016学年江苏省海安实验中学高一上学期期中测试化学试卷2015-2016学年四川省雅安天全中学高一上学期11月月考化学试卷2015-2016学年安徽省六安一中高一上学期期末化学试卷2015-2016学年甘肃省嘉峪关一中高一上学期期末化学试卷2015-2016学年黑龙江省绥棱一中高二6月月考化学试卷辽宁省辽阳2017-2018学年高一化学期末考试题陕西省西安市第八十三中学2017-2018学年第一学期期末考试高一年级化学试卷安徽省滁州市定远县重点中学2020-2021学年高一10月月考化学试题山西省古县第一中学2020-2021学年高一上学期期中化学试题安徽省六安市舒城育才学校2020-2021学年高一12月月考化学试题吉林省长春市榆树高级中学2020-2021学年高一上学期期末考试化学试题福建省莆田锦江中学2020-2021学年高一上学期期末考试化学试题甘肃省临夏县中学2020-2021学年高一上学期期末考试化学试题河北省石家庄精英中学2018-2019学年高一上学期期末考试化学试题山西省大同市2021-2022学年高一上学期期中化学试题吉林省前郭尔罗斯蒙古族自治县蒙古族中学2021-2022学年高一上学期第二次月考化学试题陕西省西安市西航一中2021-2022学年高一上学期第二次月考化学试题(已下线)2.1.3 碳酸钠和碳酸氢钠-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)江西省丰城市第九中学2021-2022学年高一上学期期末考试化学试题(已下线)【知识图鉴】单元讲练测必修第一册第二单元02基础练河北省石家庄市西山学校2022-2023学年高一上学期期末考试化学试题
名校
解题方法
7 . 室温下,通过下列实验探究Na2CO3溶液的性质。
下列有关说法正确的是
| 实验 | 实验操作和现象 |
| 1 | 用pH试纸测定0.lmol·L‑1Na2CO3溶液的pH,测得pH约为12 |
| 2 | 向0.1mol·L‑1Na2CO3溶液中加入过量0.2mol·L‑1CaCl2溶液,产生白色沉淀 |
| 3 | 向0.1mol·L‑1Na2CO3溶液中通入过量CO2,测得溶液pH约为8 |
| 4 | 向0.1mol·L‑1Na2CO3溶液中滴加几滴0.05mol·L‑1HCl,观察不到实验现象 |
| A.0.1mol·L‑1Na2CO3溶液的碱性比0.1mol·L‑1NaOH溶液的碱性强 |
| B.实验2反应静置后的上层清液中有未反应的CaCl2分子 |
C.实验3得到的溶液中,含有碳元素的微粒只有HCO |
D.实验4中反应的离子方程式为H++CO =HCO =HCO |
您最近一年使用:0次
名校
8 . 常温下,用如图1所示装置,分别向25mL0.3mol·L−1Na2CO3溶液和25mL0.3mol·L−1NaHCO3溶液中逐滴滴加0.3mol·L−1的稀盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图2所示。下列说法正确的是


| A.X曲线为Na2CO3溶液的滴定曲线 |
| B.b点溶液的pH大于c点溶液的pH |
C.c点的溶液中:c(HCO )>c(H2CO3)>c(CO )>c(H2CO3)>c(CO ) ) |
| D.a、d两点水的电离程度:a<d |
您最近一年使用:0次
名校
解题方法
9 . 钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某化学小组同学对其进行下列研究。
[查阅资料]
i. NaN3受撞击会生成Na、 N2
ii.NaN3遇盐酸、H2SO4溶液无气体生成。
iii.叠氮化钠(NaN3)的一种生产工艺流程如下:

[问题探究]
(1)汽车受撞击后,30毫秒内引发NaN3迅速分解,该反应的化学方程式为___________ ;
(2)①反应器(I)发生反应的类型为___________ ;液态氨需过量,其原因是___________ 。
②反应器(II)中反应的化学方程式为___________ 。
(3)工业级NaN3中常含有少量的Na2CO3,其原因是___________ (用化学方程式表示) ;
(4)为测定某工业级NaN3样品Na2CO3的质量分数,小组同学设计了如图实验装置:

①小明同学认为通过测定装置I中反应前后B的质量差,再通过相应计算,就可测定Na2CO3的质量分数,
小组同学通过讨论认为不可行,其理由可能是___________ (答出一种即可)
②小明同学在大家讨论的基础上,又设计了装置II,请分析:装置II中A的作用是___________ 。 若无装置C,对测定结果造成的影响是___________ (填“偏大” 、“偏小” 或“无影响”)。装置E的作用是 ___________ 。
③根据装置II,小组同学设计的实验步骤有:
a.称量装置D
b.称量样品,检查装置气密性
c.打开弹簧夹,鼓入空气
d.关闭弹簧夹,打开分液漏斗的活塞和玻璃塞,注入足量稀硫酸,关闭活塞和玻璃塞,其正确的顺序为____________ (填字母序号,可重复)
[查阅资料]
i. NaN3受撞击会生成Na、 N2
ii.NaN3遇盐酸、H2SO4溶液无气体生成。
iii.叠氮化钠(NaN3)的一种生产工艺流程如下:

[问题探究]
(1)汽车受撞击后,30毫秒内引发NaN3迅速分解,该反应的化学方程式为
(2)①反应器(I)发生反应的类型为
②反应器(II)中反应的化学方程式为
(3)工业级NaN3中常含有少量的Na2CO3,其原因是
(4)为测定某工业级NaN3样品Na2CO3的质量分数,小组同学设计了如图实验装置:

①小明同学认为通过测定装置I中反应前后B的质量差,再通过相应计算,就可测定Na2CO3的质量分数,
小组同学通过讨论认为不可行,其理由可能是
②小明同学在大家讨论的基础上,又设计了装置II,请分析:装置II中A的作用是
③根据装置II,小组同学设计的实验步骤有:
a.称量装置D
b.称量样品,检查装置气密性
c.打开弹簧夹,鼓入空气
d.关闭弹簧夹,打开分液漏斗的活塞和玻璃塞,注入足量稀硫酸,关闭活塞和玻璃塞,其正确的顺序为
您最近一年使用:0次
13-14高三上·黑龙江双鸭山·期末
名校
解题方法
10 . 下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是
| A.Na和O2 | B.NaOH和CO2 | C.NaHCO3和NaOH | D.Na2CO3和HCl |
您最近一年使用:0次
2021-02-05更新
|
308次组卷
|
27卷引用:江苏省盐城市响水县清源高级中学2022-2023学年高一上学期期末测试化学试题
江苏省盐城市响水县清源高级中学2022-2023学年高一上学期期末测试化学试题(已下线)专题05 金属钠及钠的化合物-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)(已下线)2013届黑龙江省集贤县第一中学高三上学期期末考试化学试卷(已下线)2014年化学高考总复习课时演练 3-1钠及其重要化合物练习卷(已下线)2014届广东阳东广雅中学阳春实验中学上学期期末高一化学试卷2015届福建省莆田八中高三第一次月考化学试卷2015-2016学年吉林松原油田高中高一下期初考试化学试卷(已下线)同步君 必修1 第3章 第2节 钠的化合物2016-2017学年浙江省绍兴一中高一上期中化学卷2016-2017学年河北省张家口市第一中学高一(衔接班)上学期期中(理)化学试卷湖南省衡阳县第一中学2017-2018学年高一上学期期中考试化学试题高中化学人教版 必修1 第三章 金属及其化合物 2.几种重要的金属化合物 钠的重要化合物人教版2017-2018学年高一化学必修1:3.1 金属的化学性质 同步测试(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第1讲 钠及其氧化物【押题专练】内蒙古通辽实验中学2018-2019学年高一上学期12月月考化学试题浙江省余姚中学2019-2020学年高一上学期期中考试化学试题湖南师范大学附属中学2019-2020学年高一上学期第二次大练习化学试题上海市行知中学2017-2018学年高二上学期期末(等级考)化学试题新疆博尔塔拉蒙古自治州第五师高级中学2019-2020学年高一上学期第二次月考化学试题(已下线)【浙江新东方】双师(20)四川省成都市实验外国语学校(西区)2020-2021学年高一上学期11月月考化学测试卷河南省豫西名校2020-2021学年高一上学期第二次联考化学试题黑龙江省伊春市友好区第三中学2021-2022学年高一上学期期中考试化学试题(已下线)第5章 金属及其化合物(章末复习)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)广东省阳西县第一中学2021-2022学年高一上学期第一次月考化学试题宁夏石嘴山市平罗中学2021-2022学年高一上学期期末考试化学试题海南省琼海市嘉积中学2023-2024学年高一上学期期末考试化学试题B卷



