名校
1 . 下列有关说法正确的是
| A.碳酸钠能与酸反应,不仅可用它来调节面团的酸度,还可用作膨松剂 |
| B.用活性炭漂白红墨水和用臭氧漂白纸浆,二者漂白原理相同 |
C.可以用84消毒液和淀粉检验加碘盐中添加的是碘化钾 还是碘酸钾 还是碘酸钾 |
D.向 还原 还原 得到的黑色固体中,先加入盐酸再加入 得到的黑色固体中,先加入盐酸再加入 溶液,溶液不显红色,说明黑色固体中无 溶液,溶液不显红色,说明黑色固体中无 |
您最近一年使用:0次
解题方法
2 . 课外兴趣小组的同学探究Na2CO3和NaHCO3的性质,并测定混合物中NaHCO3的含量。
实验一:Na2CO3和NaHCO3溶解性与碱性的比较
(1)室温下,Na2CO3的溶解度大于NaHCO3的实验证据是_____________ 。
(2)该实验_____________ (填“能”或“不能”)说明Na2CO3溶液的碱性强于NaHCO3溶液,理由是_____________ 。
实验二:Na2CO3和NaHCO3与澄清石灰水反应的比较
查阅资料:可以用pH表示溶液酸碱性的强弱。常温下,pH<7,溶液为酸性;pH=7,溶液为中性;pH>7,溶液为碱性。pH越小,c(OH-)越小,溶液碱性越弱。
(3)上述实验中,向澄清石灰水中滴加Na2CO3溶液,OH-未参与该反应的实验证据是_____________ 。
(4)滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,结合离子方程式说明原因:_____________ 。
实验三:Na2CO3和NaHCO3混合物(不考虑其他杂质)中NaHCO3质量分数的测定
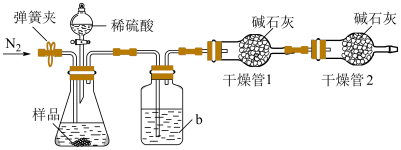
实验装置如图所示。称取19.0g待测样品于锥形瓶中,反应前先打开弹簧夹,通入一段时间的N2,然后关闭弹簧夹,接上总质量为200.0g的干燥管1,再接上干燥管2,打开分液漏斗的活塞,滴加稀硫酸进行反应。待锥形瓶中不再有气泡产生,关闭分液漏斗的活塞,打开弹簧夹,再通入一段时间的N2,最后取下干燥管1,称得其质量为208.8g。
(5)①洗气瓶中盛放的液体是_________________ (填名称)。
②第一次通入N2的目的是_________________ 。第二次通入N2的目的是_________________ 。如果没有进行第一次通N2的操作,测量的结果将会_________________ (填“偏大”“偏小”或“不变”)。
③计算出混合物中NaHCO3的质量分数为_________________ %(保留1位小数)。
实验一:Na2CO3和NaHCO3溶解性与碱性的比较
| 序号 | 实验操作 | 实验现象 | |
| ① | 在两支试管中分别加入1gNa2CO3、NaHCO3,再加入5mL水,充分振荡;用温度计测量两试管中溶液温度的变化 | Na2CO3 | NaHCO3 |
| 温度由17.6℃变为23.2℃;放置到室温时,试管内无固体 | 温度由17.6℃变为17.2℃;放置到室温时,试管内有少量固体残留 | ||
| ② | 室温时,分别向①所得溶液中滴入2滴酚酞溶液 | 溶液变红 | 溶液变微红 |
(1)室温下,Na2CO3的溶解度大于NaHCO3的实验证据是
(2)该实验
实验二:Na2CO3和NaHCO3与澄清石灰水反应的比较
查阅资料:可以用pH表示溶液酸碱性的强弱。常温下,pH<7,溶液为酸性;pH=7,溶液为中性;pH>7,溶液为碱性。pH越小,c(OH-)越小,溶液碱性越弱。
| 实验操作 | 实验数据 |
测量如下实验过程的pH变化 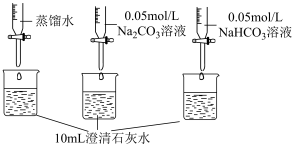 | 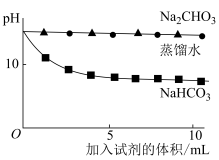 |
(3)上述实验中,向澄清石灰水中滴加Na2CO3溶液,OH-未参与该反应的实验证据是
(4)滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,结合离子方程式说明原因:
实验三:Na2CO3和NaHCO3混合物(不考虑其他杂质)中NaHCO3质量分数的测定

实验装置如图所示。称取19.0g待测样品于锥形瓶中,反应前先打开弹簧夹,通入一段时间的N2,然后关闭弹簧夹,接上总质量为200.0g的干燥管1,再接上干燥管2,打开分液漏斗的活塞,滴加稀硫酸进行反应。待锥形瓶中不再有气泡产生,关闭分液漏斗的活塞,打开弹簧夹,再通入一段时间的N2,最后取下干燥管1,称得其质量为208.8g。
(5)①洗气瓶中盛放的液体是
②第一次通入N2的目的是
③计算出混合物中NaHCO3的质量分数为
您最近一年使用:0次
名校
3 . 下列方案设计、现象和结论正确的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 比较 和 和 溶液碱性强弱 溶液碱性强弱 | 同温下,向等浓度的两溶液中分别滴入3滴酚酞,观察现象 | 观察到红色较深的是 ,说明碱性 ,说明碱性 大于 大于 |
| B | 区别 和 和 固体 固体 | 分别在两支试管中分别加入少量待检验固体,再加入几滴水,用温度计测定变化 | 温度升高的是 固体,温度降低的是 固体,温度降低的是 固体 固体 |
| C | 检验纯碱溶液中是否存在NaCl | 向待测液中加入 溶液,观察现象 溶液,观察现象 | 若有白色沉淀产生,则溶液中存在 |
| D | 检验 是否有漂白性 是否有漂白性 | 将干燥的 通入装有潮湿有色布条的广口瓶中,观察现象 通入装有潮湿有色布条的广口瓶中,观察现象 | 若有色布条颜色逐渐褪去,则说明 有漂白性 有漂白性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-11-29更新
|
588次组卷
|
3卷引用:四川省成都市第七中学2023-2024学年高一上学期期中考试化学试题
名校
解题方法
4 . 某化学兴趣小组在实验室中模拟工业制备碳酸氢钠晶体。在浓氨水中加入NaCl粉末得到饱和氨盐水。向饱和氨盐水(NH3·H2O)中通入CO2,获得碳酸氢钠晶体。并进一步处理得到产品Na2CO3和NH4Cl,实验装置如图,回答下列问题:
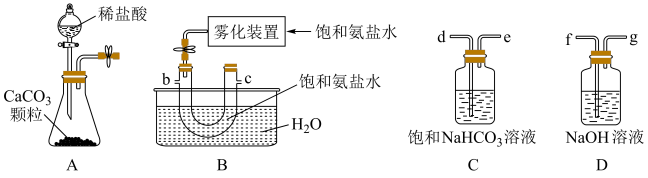
(1)用A~D仪器制备NaHCO3,正确的连接顺序是a→________ (按气流方向,用小写字母表示)。
(2)某同学实验室发现A中分液漏斗内的稀盐酸没有滴下,于是将A 装置图改进后可使稀盐酸顺利滴下,请回答改进后的A装置中的橡皮导管的作用。
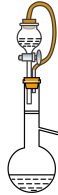 (改进后的A装置)
(改进后的A装置)
①____________________ 。
②__________________ 。
(3)反应完成后,将B中U形管内的混合物处理得到滤液和固体NaHCO3。生成NaHCO3的总反应的化学方程式为________________ 。
(4)对固体NaHCO3充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重0.28g,则固体NaHCO3的质量为___________ g。
(5)D装置NaOH溶液中吸收一定量的CO2后,充分反应后,将溶液蒸发结晶,得到少量白色固体,请设计实验确认该团队的成分:
①提出合理假设:
假设1:该固体为NaOH和Na2CO3
假设2:该固体只有Na2CO3
假设3:该固体只有___________ 。
假设4:该固体为______________ 。
②请涉及实验验证假设1的固体是NaOH和Na2CO3,写出步骤及预期的实验现象和结论。(步骤可不填满也可增加)
限选的试剂、仪器:1mol/L HCl、1mol/L MgCl2、0.5mol/L BaCl2和1mol/L Ba(OH)2溶液,甲基橙、酚酞试液,试管、胶头滴管、过滤装置。

(1)用A~D仪器制备NaHCO3,正确的连接顺序是a→
(2)某同学实验室发现A中分液漏斗内的稀盐酸没有滴下,于是将A 装置图改进后可使稀盐酸顺利滴下,请回答改进后的A装置中的橡皮导管的作用。
 (改进后的A装置)
(改进后的A装置)①
②
(3)反应完成后,将B中U形管内的混合物处理得到滤液和固体NaHCO3。生成NaHCO3的总反应的化学方程式为
(4)对固体NaHCO3充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重0.28g,则固体NaHCO3的质量为
(5)D装置NaOH溶液中吸收一定量的CO2后,充分反应后,将溶液蒸发结晶,得到少量白色固体,请设计实验确认该团队的成分:
①提出合理假设:
假设1:该固体为NaOH和Na2CO3
假设2:该固体只有Na2CO3
假设3:该固体只有
假设4:该固体为
②请涉及实验验证假设1的固体是NaOH和Na2CO3,写出步骤及预期的实验现象和结论。(步骤可不填满也可增加)
限选的试剂、仪器:1mol/L HCl、1mol/L MgCl2、0.5mol/L BaCl2和1mol/L Ba(OH)2溶液,甲基橙、酚酞试液,试管、胶头滴管、过滤装置。
| 实验步骤: | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| 步骤3: |
您最近一年使用:0次
2022-12-26更新
|
206次组卷
|
2卷引用:湖北省武汉市第六中学2021-2022学年高一上学期10月月考化学试题
解题方法
5 . 某化学兴趣小组同学探究Na2CO3和NaHCO3与澄清石灰水的反应,常温下向两等份澄清石灰水中分别滴加0.05mol•L-1Na2CO3溶液和0.05mol•L-1NaHCO3溶液,测得实验过程中溶液的pH变化如图所示。下列说法错误的是
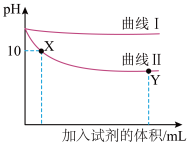

| A.曲线I表示的是滴加Na2CO3溶液的pH变化 |
| B.曲线Ⅱ反应至Ca2+恰好完全沉淀时,对应溶液的pH>7 |
| C.Y点时,溶液中的溶质只有NaHCO3 |
D.X点时,发生反应的离子方程式为2HCO +2OH-+Ca2+=CaCO3↓+CO +2OH-+Ca2+=CaCO3↓+CO +2H2O +2H2O |
您最近一年使用:0次
名校
解题方法
6 . 某化学实验小组在学习完钠盐的知识后,在实验室探究 的有关性质。
的有关性质。
Ⅰ.查阅资料及已有知识:
(1)①相同温度下,等浓度溶液的碱性:
_________  (填“>”“=”“<”)
(填“>”“=”“<”)
② 不能与
不能与 溶液反应,
溶液反应, 能与
能与 溶液反应。
溶液反应。
③ 固体受热易分解,其化学方程式为
固体受热易分解,其化学方程式为_________ 。
Ⅱ.探究实验:
(2)探究实验1:在锥形瓶内装入饱和 溶液,用
溶液,用 传感器测定密闭装置中
传感器测定密闭装置中 的分压,测得
的分压,测得 的分压与温度的变化如图1所示。溶液温度在
的分压与温度的变化如图1所示。溶液温度在 之前,溶液中
之前,溶液中 的分压增大的主要原因是
的分压增大的主要原因是_________ ;溶液温度升高到 之后,溶液中
之后,溶液中 的分压急剧增大的原因是
的分压急剧增大的原因是_________ 。

(3)探究实验2:将 为8.31的
为8.31的 溶液装入烧杯中,加入几滴酚酞溶液,加热,溶液
溶液装入烧杯中,加入几滴酚酞溶液,加热,溶液 变化与加热时间的关系如图2所示,冷却至室温,测得溶液
变化与加热时间的关系如图2所示,冷却至室温,测得溶液 为8.86。根据溶液
为8.86。根据溶液 的变化,请用文字描述加热过程中的溶液的颜色变化:
的变化,请用文字描述加热过程中的溶液的颜色变化:_________ 。

(4)探究实验3:在锥形瓶内加入水,用 传感器测定密闭装置中
传感器测定密闭装置中 的分压,缓慢加入碳酸氢钠固体,再加入氯化钙固体,测得
的分压,缓慢加入碳酸氢钠固体,再加入氯化钙固体,测得 的分压的变化曲线如图3所示。根据
的分压的变化曲线如图3所示。根据 的分压的变化曲线可知,
的分压的变化曲线可知, 溶液与
溶液与 溶液
溶液_________ 发生反应(填“能”、“不能”),若能,请写出反应离子方程式,若不能,请说明理由。_________ 。

 的有关性质。
的有关性质。Ⅰ.查阅资料及已有知识:
(1)①相同温度下,等浓度溶液的碱性:

 (填“>”“=”“<”)
(填“>”“=”“<”)②
 不能与
不能与 溶液反应,
溶液反应, 能与
能与 溶液反应。
溶液反应。③
 固体受热易分解,其化学方程式为
固体受热易分解,其化学方程式为Ⅱ.探究实验:
(2)探究实验1:在锥形瓶内装入饱和
 溶液,用
溶液,用 传感器测定密闭装置中
传感器测定密闭装置中 的分压,测得
的分压,测得 的分压与温度的变化如图1所示。溶液温度在
的分压与温度的变化如图1所示。溶液温度在 之前,溶液中
之前,溶液中 的分压增大的主要原因是
的分压增大的主要原因是 之后,溶液中
之后,溶液中 的分压急剧增大的原因是
的分压急剧增大的原因是
(3)探究实验2:将
 为8.31的
为8.31的 溶液装入烧杯中,加入几滴酚酞溶液,加热,溶液
溶液装入烧杯中,加入几滴酚酞溶液,加热,溶液 变化与加热时间的关系如图2所示,冷却至室温,测得溶液
变化与加热时间的关系如图2所示,冷却至室温,测得溶液 为8.86。根据溶液
为8.86。根据溶液 的变化,请用文字描述加热过程中的溶液的颜色变化:
的变化,请用文字描述加热过程中的溶液的颜色变化:
(4)探究实验3:在锥形瓶内加入水,用
 传感器测定密闭装置中
传感器测定密闭装置中 的分压,缓慢加入碳酸氢钠固体,再加入氯化钙固体,测得
的分压,缓慢加入碳酸氢钠固体,再加入氯化钙固体,测得 的分压的变化曲线如图3所示。根据
的分压的变化曲线如图3所示。根据 的分压的变化曲线可知,
的分压的变化曲线可知, 溶液与
溶液与 溶液
溶液
您最近一年使用:0次
名校
7 . 某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
I.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用下图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。
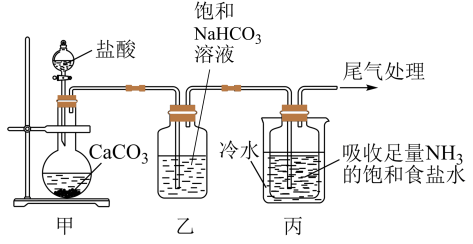
(1)装置乙的作用是_______ ,反应的化学方程式为_______ 。
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3。装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中反应的化学方程式为____ 。
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有过滤、洗涤、_______ ,最后一步发生反应的化学方程式为_______ 。
II.测定所得产品的组成和纯度
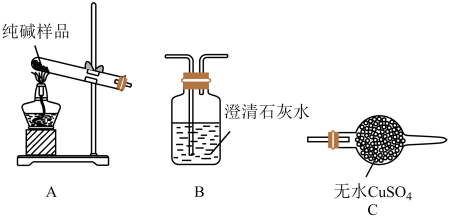
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:
(5)测定该纯碱样品的纯度:称取m1g样品,置于小烧杯中,加水溶解,滴加足量CaCl2溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为m2g。则该纯碱样品的纯度为_______ 。请另设计一个实验方案,测定纯碱样品的纯度(样品中只含有NaHCO3杂质)_______ 。
I.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用下图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。

(1)装置乙的作用是
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3。装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中反应的化学方程式为
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有过滤、洗涤、
II.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:

| 选择的装置(填编号) | 实验现象 | 实验结论 |
| 样品中含NaHCO3 |
您最近一年使用:0次
2022-08-21更新
|
474次组卷
|
2卷引用:陕西省西安市长安区第一中学2021-2022学年高一上学期期末考试化学试题
名校
解题方法
8 . 下列实验装置或实验操作正确,且能完成相应实验的是


| A.按照图甲中序号所示顺序向试管中加入试剂,制取乙酸乙酯 |
| B.利用图乙所示装置收集NO气体 |
C.将 通入图丙所示装置中进行尾气吸收 通入图丙所示装置中进行尾气吸收 |
| D.利用图丁装置验证碳酸钠和碳酸氢钠的稳定性 |
您最近一年使用:0次
2022-05-17更新
|
1670次组卷
|
4卷引用:河北省张家口市2022届高三第三次模拟考试化学试题
河北省张家口市2022届高三第三次模拟考试化学试题(已下线)专题11 化学实验基础-三年(2020-2022)高考真题分项汇编浙江省宁波市镇海中学2022-2023学年高三上学期(10月)选考模拟一化学试题福建省连城县第一中学2022-2023学年高三上学期第二次月考化学试题
名校
9 . 下列实验方案中,不能测定Na2CO3和NaHCO3混合物中NaHCO3质量分数的方案有
| A.取a克混合物与稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 |
| B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 |
| C.取a克混合物与足量Ca(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体 |
| D.取a克混合物充分加热后,固体质量减重bg |
您最近一年使用:0次
解题方法
10 . 碳酸钠是一种重要化工原料。以碳酸氢铵和氯化钠为原料制备碳酸钠,其步骤如下:①将氯化钠固体溶于水,并加入NH4HCO3粉末;②在30 ~ 50 °C条件下加热;③过滤,得到晶体A;④将晶体A在300°C加热,最后得到碳酸钠。已知:在铵盐的浓溶液中碳酸氢钠的溶解度较小。回答下列问题:
(1)步骤②中的加热方式是_______ 。
(2)写出生成晶体A的化学方程式_______ 。
(3)步骤④中“300° C加热”所选用的仪器是_______ (填标号)。
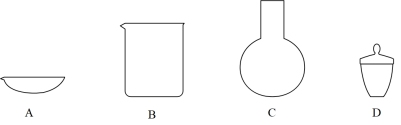
(4)下列有关碳酸钠和碳酸氢钠的叙述正确的是_______。
(5)世界最早工业生产碳酸钠的方法是路布兰(N.Leblanc)法,其流程为:流程I是向NaCl(s)中加浓H2SO4并加热到600 -700℃,获得Na2SO4(s) ;流程II是Na2SO4(s)中加木炭、石灰石并加热到1000℃,获得Na2CO3(s)。其中流程II的反应分步进行:①Na2SO4+4C Na2S+4CO↑;②Na2S与石灰石发生复分解反应。流程II的总反应方程式为
Na2S+4CO↑;②Na2S与石灰石发生复分解反应。流程II的总反应方程式为_______ ;Na2S在流程II中所起的作用有_______ (填编号)。
a.催化剂 b.中间产物 c.氧化产物 d.还原产物
(6)检验产品中是否有杂质碳酸氢钠:称取w1g样品于坩埚中,充分加热后,得到w2g残留固体。若含碳酸氢钠杂质,则w1_______ w2(选填“>”、“<”或“=”)。
(1)步骤②中的加热方式是
(2)写出生成晶体A的化学方程式
(3)步骤④中“300° C加热”所选用的仪器是

(4)下列有关碳酸钠和碳酸氢钠的叙述正确的是_______。
| A.常温下,向相同浓度的碳酸钠和碳酸氢钠溶液中各滴入2滴酚酞试液,前者红色更深 |
| B.碳酸钠的热稳定性弱于碳酸氢钠 |
| C.常温下,相同浓度的碳酸钠和碳酸氢钠分别与足量的等浓度盐酸反应,前者反应更剧烈 |
| D.在两支试管里分别加入碳酸钠固体和碳酸氢钠固体各1g,再各滴入几滴水,前者试管底部变热,后者变冷 |
 Na2S+4CO↑;②Na2S与石灰石发生复分解反应。流程II的总反应方程式为
Na2S+4CO↑;②Na2S与石灰石发生复分解反应。流程II的总反应方程式为a.催化剂 b.中间产物 c.氧化产物 d.还原产物
(6)检验产品中是否有杂质碳酸氢钠:称取w1g样品于坩埚中,充分加热后,得到w2g残留固体。若含碳酸氢钠杂质,则w1
您最近一年使用:0次



