名校
解题方法
1 . 用废铁屑[主要成分为Fe和铁锈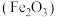 ,还含有C等难溶于酸的杂质]为原料制备
,还含有C等难溶于酸的杂质]为原料制备 的一种实验流程如下:
的一种实验流程如下:

下列与流程相关的装置或操作正确且能达到实验目的的是
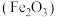 ,还含有C等难溶于酸的杂质]为原料制备
,还含有C等难溶于酸的杂质]为原料制备 的一种实验流程如下:
的一种实验流程如下:
下列与流程相关的装置或操作正确且能达到实验目的的是

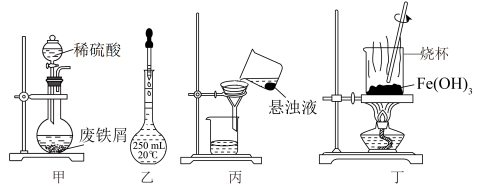
| A.可在装置甲中进行“酸浸”操作 |
B.按图乙所示操作配制“酸浸”所需的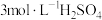 溶液 溶液 |
| C.用装置丙过滤“酸浸”后所得悬浊液 |
D.用装置丁灼烧 固体制 固体制 |
您最近一年使用:0次
2022-09-26更新
|
938次组卷
|
5卷引用:江苏省南京市江宁区2022-2023学年高三上学期期中考试化学试题
江苏省南京市江宁区2022-2023学年高三上学期期中考试化学试题江苏省常州市2022-2023学年高二下学期3月联合调研考试化学试题贵州省2022-2023学年高三上学期联考化学试题四川省泸县第一中学2022-2023学年高一上学期期末考试化学试题(已下线)专题24 实验分析设计型选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
名校
2 . 下列有关实验装置进行的相应实验,能达到实验目的的是
 |  |  |  |
| 图1 | 图2 | 图3 | 图4 |
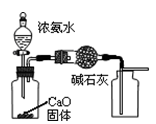
A.用图1所示装置制取并收集干燥纯净的 |
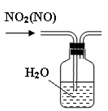
B.用图2所示装置可除去 中的NO 中的NO |
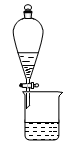
C.用图3所示装置可分离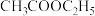 和饱和碳酸钠溶液 和饱和碳酸钠溶液 |
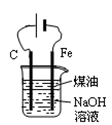
D.用图4所示装置制备 并能较长时间观察其颜色 并能较长时间观察其颜色 |
您最近一年使用:0次
2021-11-20更新
|
257次组卷
|
22卷引用:2015届江苏省南通中学高三12月月考化学试卷
2015届江苏省南通中学高三12月月考化学试卷2016届江苏省宿迁市三校高三9月学情调研化学试卷(已下线)2015届湖北省四校高三上学期期中联考化学试卷(已下线)2015届甘肃省天水市秦安县二中高三上学期期中考试化学试卷2015届湖南省怀化市高三第一次模拟考试理综化学试卷2016届湖南省长沙市明德中学高三上学期第三次月考化学试卷2016届浙江省严州中学新安江校区高三上学期第二次模拟化学试卷2016届山东省滕州一中高三上学期12月阶段测化学试卷2015-2016学年云南省玉溪一中高二下第一次月考化学卷2017届河北省邯郸一中等五校高三上学期第一次模拟化学试卷2017届山东省东营市胜利一中高三上期中化学卷陕西省西安中学2018届高三上学期第一次摸底考试化学试题湖南省长沙市明德中学2016届高三上学期第三次月考化学试题2019年高考化学一轮复习《化学实验基础知识》专题同步练习卷【全国百强校】广东省湛江市第一中学2018-2019学年高二上学期第二次大考(B卷)化学试题福建省泉州市永春一中2020届高三上学期期中考试化学试题2020届高中化学第一轮复习第十章《化学实验热点》测试卷B安徽省定远县育才学校2021届高三上学期第一次月考化学试题贵州省思南中学2021届高三上学期期中考试化学试题黑龙江省哈尔滨市第一中学2021届高三上学期期中考试化学试题天津市部分区2021-2022学年高三上学期期中练习化学试题河北省石家庄市辛集市2022-2023学年高二下学期7月期末考试化学试题
3 . 如图是铁与水蒸气反应的实验装置。在硬质玻璃管中放入还原铁粉和石棉绒(石棉绒是耐高温材料,与水、铁不反应)的混合物,加热,并通入水蒸气,就可以完成高温下铁与水蒸气反应的实验。_______ 。
(2)仪器a的名称是_______ 。
(3)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成气体的体积,计算铁粉的转化率。
①该同学应该先点燃_______ (填“A”或“B”)处的酒精灯(或酒精喷灯),测量气体体积不可以选用图中_______ (填“甲”“乙”或“丙”)装置。_______ 。( )
)
(4)将硬质玻璃管中反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸溶解并过滤,为探究反应后溶液中可能的阳离子,小林同学进行如下实验,请你将下表补充完整。

(2)仪器a的名称是
(3)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成气体的体积,计算铁粉的转化率。
①该同学应该先点燃

 )
) (4)将硬质玻璃管中反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸溶解并过滤,为探究反应后溶液中可能的阳离子,小林同学进行如下实验,请你将下表补充完整。
步骤 | 现象 | 解释(用离子方程式表示) | 结论 |
| I.取样,滴加KSCN溶液 | 溶液不变红色 | ①Fe3O4+8H+=Fe2++2Fe3++4H2O ② | Ⅲ.反应后的溶液中阳离子为 |
| Ⅱ.取样,滴加NaOH溶液 | 刚开始无明显现象,一段时间后先出现 | ③ ④Fe2++2OH- =Fe(OH)2↓ ⑤ |
您最近一年使用:0次
2021-01-13更新
|
256次组卷
|
2卷引用:江苏省天一中学2023-2024学年高一上学期12月月考(理科强化班)化学试题
解题方法
4 . 价类二维图是学习元素及其化合物知识的重要模型和工具。图1为某常见金属单质及其部分化合物的价类二维图。下列推断合理的是

| A.f,d均可通过化合反应制备 |
| B.可通过图2灼烧d得到c |
| C.可通过图3装置制备物质e,且较长时间不易被氧化 |
| D.a→f→g→e的每步转化均可一步实现 |
您最近一年使用:0次
2023-02-17更新
|
195次组卷
|
2卷引用:02 2024年苏州西交大附中高一3月月考
名校
5 . 高铁酸钾(K2FeO4)是一种新型绿色、高效的水处理剂,对病毒的去除率可达99.95%。某兴趣小组设计如下实验制备K2FeO4并探究其性质。
已知:①K2FeO4为紫色固体,微溶于KOH溶液;
② 具有强氧化性,在酸性或中性溶液中能快速产生O2,在碱性溶液中较稳定。
具有强氧化性,在酸性或中性溶液中能快速产生O2,在碱性溶液中较稳定。
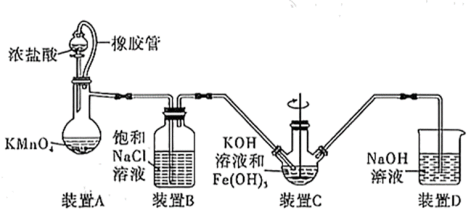
(1)制备K2FeO4(夹持装置略)
①如图所示,A为氯气发生装置,装置A中盛放KMnO4的仪器名称是_______ 。
②装置B的作用是_______ 。
③装置C中的KOH溶液需过量,目的是________ 。
④C中得到紫色固体和溶液。则C中Cl2与Fe(OH)3发生反应生成K2FeO4的离子方程式为______
(2)探究K2FeO4的性质甲同学取装置C中紫色溶液,加入稀硫酸,产生黄绿色气体,经检验气体中含有Cl2。该现象______ (填“能”或“不能”)证明“酸性条件下 氧化性强于Cl2”,并说明理由:
氧化性强于Cl2”,并说明理由:______ 。
(3)测定K2FeO4的产率若在制备装置C中加入Fe(OH)3的质量为10.7g,充分反应后经过滤、洗涤、干燥得K2FeO4固体9.9g,则K2FeO4的产率为________ 。
已知:①K2FeO4为紫色固体,微溶于KOH溶液;
②
 具有强氧化性,在酸性或中性溶液中能快速产生O2,在碱性溶液中较稳定。
具有强氧化性,在酸性或中性溶液中能快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)
①如图所示,A为氯气发生装置,装置A中盛放KMnO4的仪器名称是
②装置B的作用是
③装置C中的KOH溶液需过量,目的是
④C中得到紫色固体和溶液。则C中Cl2与Fe(OH)3发生反应生成K2FeO4的离子方程式为
(2)探究K2FeO4的性质甲同学取装置C中紫色溶液,加入稀硫酸,产生黄绿色气体,经检验气体中含有Cl2。该现象
 氧化性强于Cl2”,并说明理由:
氧化性强于Cl2”,并说明理由:(3)测定K2FeO4的产率若在制备装置C中加入Fe(OH)3的质量为10.7g,充分反应后经过滤、洗涤、干燥得K2FeO4固体9.9g,则K2FeO4的产率为
您最近一年使用:0次
2021-09-28更新
|
638次组卷
|
4卷引用:江苏省海安市南莫中学2022届高三上学期第一次月考备考金卷B卷化学试题
江苏省海安市南莫中学2022届高三上学期第一次月考备考金卷B卷化学试题内蒙古海拉尔第二中学2021-2022学年高三上学期第一次阶段考化学试题(已下线)押新高考卷16题 化学实验综合题-备战2022年高考化学临考题号押题(新高考通版)山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题



