湖南省衡阳市2022-2023学年高一上学期期末质量检测化学试题
湖南
高一
期末
2023-02-23
354次
整体难度:
容易
考查范围:
常见无机物及其应用、认识化学科学、物质结构与性质、化学与STSE、化学实验基础
湖南省衡阳市2022-2023学年高一上学期期末质量检测化学试题
湖南
高一
期末
2023-02-23
354次
整体难度:
容易
考查范围:
常见无机物及其应用、认识化学科学、物质结构与性质、化学与STSE、化学实验基础
一、单选题 添加题型下试题
单选题
|
容易(0.94)
1. 冬奥会开幕式上,绚烂的烟火给各国运动健儿留下了深刻的印象。下列有关焰色试验说法正确的是
| A.节日燃放的五彩缤纷的烟花,焰火中的红色来源于钠盐灼烧 |
| B.焰色试验实验中可选用稀硫酸洗净铂丝 |
| C.无法通过焰色试验区分碳酸钠溶液和碳酸氢钠溶液 |
| D.焰色试验属于化学变化 |
您最近一年使用:0次
2023-02-17更新
|
171次组卷
|
2卷引用:湖南省衡阳市2022-2023学年高一上学期期末质量检测化学试题
单选题
|
容易(0.94)
2. 歌曲《青花瓷》唱道“帘外芭蕉惹骤雨,门环惹铜绿”,其中的“铜绿”即是铜锈,它的化学成分是 (碱式碳酸铜)。铜在潮湿的空气中生锈的化学反应为
(碱式碳酸铜)。铜在潮湿的空气中生锈的化学反应为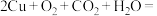
 。下列有关该反应的说法错误的是
。下列有关该反应的说法错误的是
 (碱式碳酸铜)。铜在潮湿的空气中生锈的化学反应为
(碱式碳酸铜)。铜在潮湿的空气中生锈的化学反应为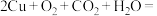
 。下列有关该反应的说法错误的是
。下列有关该反应的说法错误的是| A.“铜绿”从物质的分类角度来看属于碱 |
| B.该反应属于氧化还原反应,化合价发生改变的只有两种元素 |
| C.该反应中铜失电子,氧气得电子 |
| D.碱式碳酸铜既是氧化产物,又是还原产物 |
您最近一年使用:0次
2023-02-17更新
|
244次组卷
|
3卷引用:湖南省衡阳市2022-2023学年高一上学期期末质量检测化学试题
单选题
|
较易(0.85)
3. 类比和推理是化学研究的重要方法。下列应用该方法正确的是
A.铁和氯气反应生成 ,则铁和碘单质也生成 ,则铁和碘单质也生成 |
B. 与水反应生成HClO和HCl,则 与水反应生成HClO和HCl,则 与水反应也能生成HFO和HF 与水反应也能生成HFO和HF |
| C.铁能从硫酸铜溶液中置换出铜,则钠也能从硫酸铜溶液中置换出铜 |
| D.钠与氧气、水等反应时钠作还原剂,则金属单质参与反应可作还原剂 |
您最近一年使用:0次
单选题
|
较易(0.85)
4. 二氧化碳催化加氢合成乙烯( )是综合利用
)是综合利用 的热点研究领域,其反应可以表示为
的热点研究领域,其反应可以表示为 。若
。若 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是
 )是综合利用
)是综合利用 的热点研究领域,其反应可以表示为
的热点研究领域,其反应可以表示为 。若
。若 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是A. 个 个 分子的体积为44.8L 分子的体积为44.8L | B.6mol 中所含中子数为 中所含中子数为 |
C.1个 分子中所含原子数为 分子中所含原子数为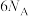 | D.18g 中所含H的数目为 中所含H的数目为 |
您最近一年使用:0次
单选题
|
容易(0.94)
名校
5. 我国承诺在2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当。在实际生产中,可利用反应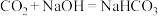 来捕捉废气中的
来捕捉废气中的 ,下列有关化学用语的说法正确的是
,下列有关化学用语的说法正确的是
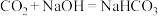 来捕捉废气中的
来捕捉废气中的 ,下列有关化学用语的说法正确的是
,下列有关化学用语的说法正确的是A.中子数为8的氧原子: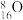 |
B. 、 、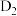 、 、 互为同位素 互为同位素 |
C. 的结构示意图: 的结构示意图: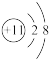 |
D. 的电离方程式: 的电离方程式: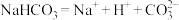 |
您最近一年使用:0次
2023-02-17更新
|
189次组卷
|
2卷引用:湖南省衡阳市2022-2023学年高一上学期期末质量检测化学试题
单选题
|
容易(0.94)
6. 下列与生活、生产相关的化学知识中,错误的是
A.二氧化氯( )和臭氧可用作自来水的消毒剂 )和臭氧可用作自来水的消毒剂 |
| B.漂白粉、漂白液和漂白精不仅可用作游泳池的消毒,还可用作漂白棉、麻、纸张和食物的漂白剂 |
C. 是一种红棕色粉末,俗称铁红,常用作油漆、涂料、油墨和橡胶的红色颜料 是一种红棕色粉末,俗称铁红,常用作油漆、涂料、油墨和橡胶的红色颜料 |
D.储氢合金是一类能够大量吸收 ,并与 ,并与 结合成金属氢化物的材料,如Ti−Fe合金和La−Ni合金 结合成金属氢化物的材料,如Ti−Fe合金和La−Ni合金 |
您最近一年使用:0次
单选题
|
较易(0.85)
解题方法
7. 下列离子方程式书写正确的是
A. 溶液腐蚀印刷电路铜板: 溶液腐蚀印刷电路铜板: |
B.将过量二氧化硫通入氢氧化钠溶液中: |
C.少量的 溶液与NaOH溶液反应: 溶液与NaOH溶液反应: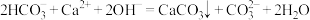 |
D.钠与水反应: |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
8. 价类二维图是学习元素及其化合物知识的重要模型和工具。图1为某常见金属单质及其部分化合物的价类二维图。下列推断合理的是
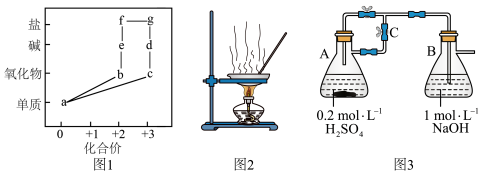

| A.f,d均可通过化合反应制备 |
| B.可通过图2灼烧d得到c |
| C.可通过图3装置制备物质e,且较长时间不易被氧化 |
| D.a→f→g→e的每步转化均可一步实现 |
您最近一年使用:0次
2023-02-17更新
|
198次组卷
|
2卷引用:湖南省衡阳市2022-2023学年高一上学期期末质量检测化学试题
单选题
|
较易(0.85)
9. 下列有关“实验操作”、“现象”及“实验结论”都正确的是
| 选项 | 实验操作 | 现象 | 实验结论 |
| A | 将氯气通入到紫色石蕊试液中 | 观察溶液先变红后褪色 | 氯气具有漂白性 |
| B | 在CO还原 ,得到的黑色固体中加入盐酸,固体溶解,再加入KSCN溶液 ,得到的黑色固体中加入盐酸,固体溶解,再加入KSCN溶液 | 溶液不显血红色 | 黑色固体一定是Fe |
| C | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 金属铝熔化而不滴落下来 | 金属铝熔点比氧化铝低 |
| D | 分别加热碳酸钠与碳酸氢钠固体 | 试管内壁均出现水珠 | 两种固体均受热分解 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较易(0.85)
10. 亚氯酸钠( )是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。一种制备亚氯酸钠的流程如下。已知:
)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。一种制备亚氯酸钠的流程如下。已知: 高于60℃时分解成
高于60℃时分解成 和NaCl。
和NaCl。
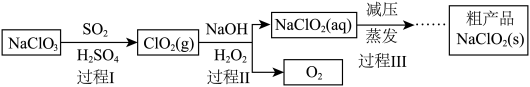
下列说法错误的是
 )是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。一种制备亚氯酸钠的流程如下。已知:
)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。一种制备亚氯酸钠的流程如下。已知: 高于60℃时分解成
高于60℃时分解成 和NaCl。
和NaCl。
下列说法错误的是
A.由过程Ⅰ反应可知还原性: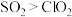 |
B.过程Ⅱ反应的离子方程式为: |
| C.过程Ⅲ的操作为减压蒸发、浓缩、冷却、过滤、洗涤、干燥 |
D.过程Ⅰ消耗 物质的量为的过程Ⅱ产生 物质的量为的过程Ⅱ产生 物质的量的2倍 物质的量的2倍 |
您最近一年使用:0次
二、多选题 添加题型下试题
多选题
|
较易(0.85)
解题方法
11. 下列说法中正确的是
A.向某溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色无味气体,则溶液中可能含有 |
B.向某溶液中先加几滴KSCN溶液,无明显现象,再滴入氯水,溶液变红,则溶液中一定存在 |
| C.向某黄色溶液中滴入几滴淀粉磺化钾溶液,溶液变蓝,则原溶液一定是氯水 |
D.向某溶液加入 溶液产生了白色沉淀,则该溶液中一定含有 溶液产生了白色沉淀,则该溶液中一定含有 |
您最近一年使用:0次
多选题
|
适中(0.65)
解题方法
12. 下列是某化学研究性学习小组对某无色水样成分的检验过程,已知该水样中只可能含有 、
、 、
、 、
、 、
、 、
、 、
、 、
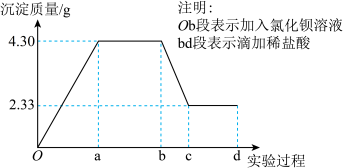
、 中的若干种离子,该小组同学取100mL水样进行实验:向样品中先滴加氯化钡溶液,再滴加2mol/L盐酸,实验过程中沉淀质量的变化如下图所示。下列说法正确的是
中的若干种离子,该小组同学取100mL水样进行实验:向样品中先滴加氯化钡溶液,再滴加2mol/L盐酸,实验过程中沉淀质量的变化如下图所示。下列说法正确的是
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的若干种离子,该小组同学取100mL水样进行实验:向样品中先滴加氯化钡溶液,再滴加2mol/L盐酸,实验过程中沉淀质量的变化如下图所示。下列说法正确的是
中的若干种离子,该小组同学取100mL水样进行实验:向样品中先滴加氯化钡溶液,再滴加2mol/L盐酸,实验过程中沉淀质量的变化如下图所示。下列说法正确的是
A.水样中一定不存在 、 、 、 、 ,可能存在 ,可能存在 |
B.水样中一定存在 、 、 ,可能存在 ,可能存在 |
| C.由b点到c点变化过程中消耗盐酸的体积为20mL |
D.水样中一定存在 ,且 ,且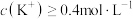 |
您最近一年使用:0次
三、单选题 添加题型下试题
单选题
|
适中(0.65)
解题方法
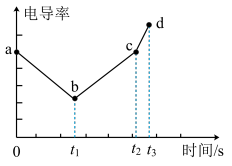
13. 实验室可借助电导率传感器研究溶液中离子反应的实质。将电导率传感器插入滴有酚酞的10mL0.01mol/L 溶液中,然后匀速滴入0.02mol/L的
溶液中,然后匀速滴入0.02mol/L的 溶液,电导率(电导率是以数字表示的溶液传导电流的能力)与时间的变化关系如下图。下列说法错误的是
溶液,电导率(电导率是以数字表示的溶液传导电流的能力)与时间的变化关系如下图。下列说法错误的是
 溶液中,然后匀速滴入0.02mol/L的
溶液中,然后匀速滴入0.02mol/L的 溶液,电导率(电导率是以数字表示的溶液传导电流的能力)与时间的变化关系如下图。下列说法错误的是
溶液,电导率(电导率是以数字表示的溶液传导电流的能力)与时间的变化关系如下图。下列说法错误的是
| A.实验过程中可观察到溶液由红色逐渐变为无色,同时产生白色沉淀 |
B.电导率最低点时,加入 溶液的体积为5mL 溶液的体积为5mL |
C.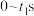 电导率逐渐减小,说明生成的 电导率逐渐减小,说明生成的 不是电解质 不是电解质 |
D. 到 到 时,电导率增大的原因是溶液中 时,电导率增大的原因是溶液中 、 、 、 、 的浓度增大 的浓度增大 |
【知识点】 物质水溶液的导电性解读 离子反应的发生及书写
您最近一年使用:0次
四、多选题 添加题型下试题
多选题
|
较难(0.4)
解题方法
14. 将一定质量的铁、氧化铁、氧化铜的混合物粉末加入100mL3.8mol/L盐酸中,充分反应后产生224mL (标准状况),残留固体0.64g,过滤,滤液中无
(标准状况),残留固体0.64g,过滤,滤液中无 。将滤液加水稀释到200mL,测得其中
。将滤液加水稀释到200mL,测得其中 为0.500mol/L。下列说法错误的是
为0.500mol/L。下列说法错误的是
 (标准状况),残留固体0.64g,过滤,滤液中无
(标准状况),残留固体0.64g,过滤,滤液中无 。将滤液加水稀释到200mL,测得其中
。将滤液加水稀释到200mL,测得其中 为0.500mol/L。下列说法错误的是
为0.500mol/L。下列说法错误的是| A.残留固体没有Fe,只有Cu | B.原混合物中单质铁的质量为4.48g |
C.反应中消耗的 的物质的量为0.33mol 的物质的量为0.33mol | D.溶液中没有 ,阳离子为 ,阳离子为 和 和 |
您最近一年使用:0次
五、填空题 添加题型下试题
填空题
|
适中(0.65)
解题方法
15. 生产、生活中处处有化学,利用所学化学知识回答下列问题。
(1)在潜水艇和消防员的呼吸面具中, 与
与 发生了反应,从氧化剂和还原剂的角度分析,在这个反应中
发生了反应,从氧化剂和还原剂的角度分析,在这个反应中 的作用是
的作用是_______ 。
(2)铁锅放置久了易生锈,铁锈的主要成分是氧化铁,从物质类别来看,它属于_______ (填“酸性氧化物”或“碱性氧化物”);从厨房选取除去铁锈的最佳试剂为_______ (a.食盐b.食醋c.小苏打d.洗洁精),该反应属于_______ (填四大基本反应类型之一)。
(3)维生素C在人体内有重要的功能,能帮助人体将从食物中摄取的、不易吸收的 转变为易吸收的
转变为易吸收的 ,这说明维生素具有
,这说明维生素具有_______ (填“氧化性”或“还原性”)。
(4)某自来水厂用漂白粉对自来水进行杀菌、消毒,其原理是_______ (用化学方程式说明)。
(1)在潜水艇和消防员的呼吸面具中,
 与
与 发生了反应,从氧化剂和还原剂的角度分析,在这个反应中
发生了反应,从氧化剂和还原剂的角度分析,在这个反应中 的作用是
的作用是(2)铁锅放置久了易生锈,铁锈的主要成分是氧化铁,从物质类别来看,它属于
(3)维生素C在人体内有重要的功能,能帮助人体将从食物中摄取的、不易吸收的
 转变为易吸收的
转变为易吸收的 ,这说明维生素具有
,这说明维生素具有(4)某自来水厂用漂白粉对自来水进行杀菌、消毒,其原理是
您最近一年使用:0次
六、解答题 添加题型下试题
解答题-无机推断题
|
较易(0.85)
名校
16. 短同期元素①~⑩在周期表中的位置如下表所示,请回答下列有关问题。
(1)④在元素周期表中的位置_______ 。
(2)以上元素所形成的最高价氧化物对应的水化物的酸性最强的酸是_______ (用化学式表示),其与⑨的最高价氧化物对应水化物反应的离子反应方程式为_______ 。
(3)⑥⑦⑩的简单离子的半径由大到小顺序为_______ (用离子符号表示),⑦⑧⑨的最高价氧化物对应的水化物的碱性由弱到强的顺序为_______ (用化学式表示)。
(4)①⑦的一种原子个数1∶1型化合物中①元素化合价为_______ ,标准状况下,该化合物与水反应产生11.2L气体时,转移电子数目为_______ 。
(5)①⑤的一种原子个数1∶1型化合物的分子式为_______ 。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | ② | ||||||
| 二 | ③ | ④ | ⑤ | ⑥ | ||||
| 三 | ⑦ | ⑧ | ⑨ | ⑩ |
(2)以上元素所形成的最高价氧化物对应的水化物的酸性最强的酸是
(3)⑥⑦⑩的简单离子的半径由大到小顺序为
(4)①⑦的一种原子个数1∶1型化合物中①元素化合价为
(5)①⑤的一种原子个数1∶1型化合物的分子式为
您最近一年使用:0次
2023-02-17更新
|
93次组卷
|
2卷引用:湖南省衡阳市2022-2023学年高一上学期期末质量检测化学试题
解答题-实验探究题
|
适中(0.65)
解题方法
17. 铁有两种氯化物,都是重要的化工试剂,它们的一些性质及制备方法如下所示:
Ⅰ.氯化铁:熔点为306℃、沸点为315℃,易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
Ⅱ.氯化亚铁:熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢气体来生产无水氯化亚铁。
实验室可用如图所示的装置模拟工业生产无水氯化铁,请回答相关问题。

(1)a管的作用是_______ 。
(2)装置A用 和浓盐酸制取氯气,A中反应的离子反应方程式为
和浓盐酸制取氯气,A中反应的离子反应方程式为_______ 。
(3)有人建议,将E装置改为装有碱石灰的干燥管更好,你认为_______ (填“合理”或“不合理”),理由是_______ 。
(4)用此装置制得的无水氯化铁含有_______ (填化学式)杂质。
(5)若要得到较纯净的无水氯化铁,对装置改进措施是_______ 。
Ⅰ.氯化铁:熔点为306℃、沸点为315℃,易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
Ⅱ.氯化亚铁:熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢气体来生产无水氯化亚铁。
实验室可用如图所示的装置模拟工业生产无水氯化铁,请回答相关问题。

(1)a管的作用是
(2)装置A用
 和浓盐酸制取氯气,A中反应的离子反应方程式为
和浓盐酸制取氯气,A中反应的离子反应方程式为(3)有人建议,将E装置改为装有碱石灰的干燥管更好,你认为
(4)用此装置制得的无水氯化铁含有
(5)若要得到较纯净的无水氯化铁,对装置改进措施是
您最近一年使用:0次
解答题-实验探究题
|
适中(0.65)
解题方法
18. 某校化学兴趣小组需要使用480mL0.15mol/LNaOH溶液。查阅资料知,由于称量、溶解和定容中都可能出现误差,因此所得溶液浓度并不准确等于0.15mol/L。现设计实验用NaOH固体配制溶液并用邻苯二甲酸氢钾(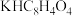 )测定所配NaOH溶液的准确浓度,实验步骤如下:
)测定所配NaOH溶液的准确浓度,实验步骤如下:
Ⅰ.配制溶液:
用托盘天平称取一定质量的NaOH固体,用适量水溶解;将所得溶液转移至容量瓶中,经洗涤→转移→定容→摇匀得到浓度约为0.15mol/L的NaOH溶液。
Ⅱ.测定溶液的准确浓度:
准确称取三份0.6120g邻苯二甲酸氢钾固体,配制成三份20mL溶液,分别在三份溶液中逐滴加入上述配制的NaOH溶液,当两者恰好完全反应时,平均消耗NaOH溶液的体积为20.03mL。
已知:邻苯二甲酸氢钾与氢氧化钠反应的化学方程式为 。
。
(1)“配制溶液”过程中,需要称取NaOH固体_______ g。
(2)该实验中容量瓶规格为_______ 。
a.480mL b.1000mL c.500mL d.250mL
(3)“配制溶液”过程中,将蒸馏水注入容量瓶,当液面离容量瓶颈部的刻度线1~2cm时,改用_______ 。盖好瓶塞,反复上下颠倒,摇匀。
(4)邻苯二甲酸氢钾属于_______ (填“电解质”或“非电解质”)。
(5)测定NaOH溶液的准确浓度为_______ (精确至小数点后4位)mol/L。
(6)该兴趣小组设计下图所示的实验装置,用所配的NaOH溶液测定ag镁铝合金中铝的含量,测得气体体积为VmL(已换算为标准状况下的体积),该实验中发生反应的离子方程式为_______ ;合金中铝的质量分数为_______ 。(用含a、V的字母表达)。

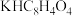 )测定所配NaOH溶液的准确浓度,实验步骤如下:
)测定所配NaOH溶液的准确浓度,实验步骤如下:Ⅰ.配制溶液:
用托盘天平称取一定质量的NaOH固体,用适量水溶解;将所得溶液转移至容量瓶中,经洗涤→转移→定容→摇匀得到浓度约为0.15mol/L的NaOH溶液。
Ⅱ.测定溶液的准确浓度:
准确称取三份0.6120g邻苯二甲酸氢钾固体,配制成三份20mL溶液,分别在三份溶液中逐滴加入上述配制的NaOH溶液,当两者恰好完全反应时,平均消耗NaOH溶液的体积为20.03mL。
已知:邻苯二甲酸氢钾与氢氧化钠反应的化学方程式为
 。
。(1)“配制溶液”过程中,需要称取NaOH固体
(2)该实验中容量瓶规格为
a.480mL b.1000mL c.500mL d.250mL
(3)“配制溶液”过程中,将蒸馏水注入容量瓶,当液面离容量瓶颈部的刻度线1~2cm时,改用
(4)邻苯二甲酸氢钾属于
(5)测定NaOH溶液的准确浓度为
(6)该兴趣小组设计下图所示的实验装置,用所配的NaOH溶液测定ag镁铝合金中铝的含量,测得气体体积为VmL(已换算为标准状况下的体积),该实验中发生反应的离子方程式为

您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、认识化学科学、物质结构与性质、化学与STSE、化学实验基础
试卷题型(共 18题)
题型
数量
单选题
11
多选题
3
填空题
1
解答题
3
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 焰色试验 | |
| 2 | 0.94 | 无机物质的分类 酸、碱、盐、氧化物的概念及其相互联系 氧化还原反应基本概念 氧化还原反应的几组概念 | |
| 3 | 0.85 | 氯气的化学性质 钠与氧气等非金属的反应 钠与盐溶液的反应 铁与非金属单质反应 | |
| 4 | 0.85 | 22.4L/mol适用条件 根据n=m/M进行相关计算 结合物质结构基础知识与NA相关推算 | |
| 5 | 0.94 | 原子结构示意图、离子结构示意图 电离方程式 原子中相关数值及其之间的相互关系 元素、核素、同位素 | |
| 6 | 0.94 | 漂白粉和漂粉精 几种铁的氧化物的物理性质及用途 化学科学对人类文明发展的意义 金属与合金性能比较 | |
| 7 | 0.85 | 离子方程式的书写 离子方程式的正误判断 钠与水反应原理 铁盐 | |
| 8 | 0.65 | 氢氧化亚铁 氢氧化铁化学性质 铁三角转化条件分析及判断 与“铁三角”有关的推断 | |
| 9 | 0.85 | 氯气的化学性质 碳酸钠与碳酸氢钠鉴别的实验 铝与氧气的反应 铁的氧化物 | |
| 10 | 0.85 | 离子方程式的书写 氧化性、还原性强弱的比较 氧化还原反应方程式的配平 电子转移计算 | |
| 13 | 0.65 | 物质水溶液的导电性 离子反应的发生及书写 | |
| 二、多选题 | |||
| 11 | 0.85 | 氯离子的检验 Fe2+的鉴别及其应用 常见阴离子的检验 | |
| 12 | 0.65 | 化学方程式计算中物质的量的运用 离子反应在化合物组成的分析、鉴定的应用 硫酸根离子的检验 常见阴离子的检验 | |
| 14 | 0.4 | 化学方程式计算中物质的量的运用 基于氧化还原反应守恒规律的计算 铁及铁的氧化物混合物反应的相关计算 Fe、Cu及相关离子的反应 | |
| 三、填空题 | |||
| 15 | 0.65 | 酸、碱、盐、氧化物的概念及其相互联系 氧化还原反应的几组概念 漂白粉和漂粉精 过氧化钠和二氧化碳反应 | |
| 四、解答题 | |||
| 16 | 0.85 | 离子方程式的书写 元素金属性强弱的比较方法 元素非金属性强弱的比较方法 微粒半径大小的比较方法 | 无机推断题 |
| 17 | 0.65 | 氯气的实验室制法 氯气与金属单质的反应 常用仪器及使用 物质制备的探究 | 实验探究题 |
| 18 | 0.65 | 物质的量浓度的计算 非电解质、电解质物质类别判断 铝与强碱溶液反应 一定物质的量浓度的溶液的配制 | 实验探究题 |



