名校
1 . 为探究某食品包装袋内的一小包脱氧剂中的还原铁粉是否变质,分别取少量样品溶于盐酸中,进行下列实验,其中结论正确的是
| A.向溶液中滴加KSCN溶液呈红色,说明不含Fe2+,样品完全变质 |
| B.向溶液中通入氯气,然后再加入KSCN溶液呈红色,说明原溶液中含有Fe3+样品变质 |
| C.若滴加KSCN溶液未变红色,再滴加氯水变红色,则说明铁样品粉未变质 |
| D.向溶液中滴加足量的NaOH溶液,观察到红褐色沉淀,则说明样品完全变质 |
您最近一年使用:0次
2023-01-26更新
|
498次组卷
|
4卷引用:河北省保定市泽龙实验中学2022-2023学年高一下学期开学检测化学试题
名校
解题方法
2 . 铁器时代是人类发展史中一个极为重要的时代,铁及其化合物在人类的生产、生活中都起了巨大的作用。
(1)有“中华第一剑”之称的虢国玉柄铁剑是我国目前出土的最早冶炼铁,玉柄铁剑,剑断锈连,剑身表面的铁锈的主要成分是___ (填标号)。
(2)长期放置的FeSO4溶液易被氧化而变质,实验室用绿矾FeSO4·xH2O配制FeSO4溶液时为了防止FeSO4溶液变质,经常向其中加入铁粉,其原因是___ (用离子方程式表示)。
(3)利用部分变质的FeSO4溶液制备Fe2O3:
部分变质的FeSO4溶液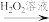 溶液I
溶液I 沉淀II
沉淀II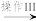 Fe2O3
Fe2O3
①H2O2溶液的作用是___ 。
②“溶液I”的溶质为___ (填化学式),写出由“溶液I”到“沉淀II”反应的离子方程式:___ 。
③“操作III”的名称为___ 。
(4)为测定某绿矾FeSO4·xH2O中结晶水的含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将该绿矾FeSO4·xH2O样品装入石英玻璃管中,再次将装置A称重,记为m2g。按图示连接好装置进行实验。

①将下列实验操作步骤正确排序:__ (填标号);重复上述操作步骤,直至装置A恒重,记为m3g。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2
e.称量装置A
f.冷却至室温
②根据实验记录,计算绿矾FeSO4·xH2O化学式中结晶水的数目x=___ (列出计算式即可)。
(1)有“中华第一剑”之称的虢国玉柄铁剑是我国目前出土的最早冶炼铁,玉柄铁剑,剑断锈连,剑身表面的铁锈的主要成分是
| A.Fe | B.FeO | C.Fe3O4 | D.Fe2O3 |
(3)利用部分变质的FeSO4溶液制备Fe2O3:
部分变质的FeSO4溶液
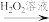 溶液I
溶液I 沉淀II
沉淀II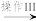 Fe2O3
Fe2O3①H2O2溶液的作用是
②“溶液I”的溶质为
③“操作III”的名称为
(4)为测定某绿矾FeSO4·xH2O中结晶水的含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将该绿矾FeSO4·xH2O样品装入石英玻璃管中,再次将装置A称重,记为m2g。按图示连接好装置进行实验。

①将下列实验操作步骤正确排序:
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2
e.称量装置A
f.冷却至室温
②根据实验记录,计算绿矾FeSO4·xH2O化学式中结晶水的数目x=
您最近一年使用:0次
2021-12-17更新
|
564次组卷
|
4卷引用:河北省百所学校大联考2021-2022学年高一12月联考化学试题
河北省百所学校大联考2021-2022学年高一12月联考化学试题河北省保定市唐县第一中学2022-2023学年高一上学期第三次考试化学试题河北省定州市第二中学2022-2023学年高一上学期12月月考化学试题(已下线)第三章 铁 金属材料(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)
名校
3 . 为探究某食品包装袋内一小包脱氧剂中的还原铁粉是否变质,分别取少量样品溶于盐酸,再进行下列实验,其中结论正确的是
| A.若滴加KSCN溶液,溶液变红,说明铁粉变质 |
| B.若滴加KSCN溶液,溶液未变红,说明铁粉未变质 |
| C.若依次滴加氯水、KSCN溶液,溶液变红,说明铁粉全部变质 |
| D.若滴加KSCN溶液,溶液未变红;再滴加氯水,溶液变红,说明铁粉部分变质 |
您最近一年使用:0次
2021-04-07更新
|
1029次组卷
|
16卷引用:河北省石家庄精英中学2020-2021学年高二下学期期末考试化学试题
河北省石家庄精英中学2020-2021学年高二下学期期末考试化学试题河北师范大学附属中学2023-2024学年高一上学期12月月考化学试题天津市和平区2017-2018学年高一上学期期末考试化学试题安徽省芜湖市第一中学2020-2021学年高一上学期第二次月考化学试题辽宁省沈阳市2020-2021学年高一上学期期末质量监测化学试题山西省怀仁市2020-2021学年高一上学期期末考试化学试题云南省曲靖市第二中学2020-2021学年高一上学期期末考试化学试题黑龙江省鹤岗市绥滨县第一中学2020-2021学年高一上学期期末考试化学(理)试题浙江省余姚中学2020-2021 学年高一上学期期中考试化学试题(已下线)专题六 铁及其化合物(A卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)天津市静海区第一中学2021-2022学年高三上学期(9月)学生学业能力调研化学试题人教2019版必修第一册第三章 铁 金属材料复习与提高河南省洛阳市2021-2022学年高一上学期期末考试化学试题浙江省宁波市效实中学2022-2023学年高一上学期期中考试化学试题安徽省芜湖市2022-2023学年高一上学期期末教学质量统测化学试题9.2.1反应的合理选择(课中)-2019苏教版必修2课前课中课后
名校
解题方法
4 . 下列实验操作能达到实验目的的是
| 目的 | 操作 | |
| A | 测定NaClO溶液的pH | 取一张pH试纸放在表面皿上,用洁净的玻璃棒蘸取待测液点滴于试纸的中部,与标准比色卡对比 |
| B | 验证Ksp(AgCl)>Ksp( AgI) | 取2 mL0. 1mol·L-1AgNO3溶液,先后滴加3滴0.1mol·L-1NaCl溶液和5滴0.1mol·L-1KI溶液,先生成白色沉淀,后又产生黄色沉淀 |
| C | 证明Na2CO3溶液中存在水解平衡 | 向含有酚酞的Na2CO3溶液中滴入BaCl2溶液,观察溶液的变化 |
| D | 检验Fe(NO3)2晶体是否已 氧化变质 | 将Fe(NO3)2样品溶于稀盐酸后,滴加KSCN溶液,观察溶液是否变红 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-11-24更新
|
624次组卷
|
8卷引用:河北省邯郸市永年区第二中学2023-2024学年高二上学期12月月考化学试题
名校
5 . 据古籍记载,焙烧绿矾( )矿石能制备铁红,同时制得硫酸。某研究性学习小组对绿矾的焙烧反应进行探究,装置如下图所示。
)矿石能制备铁红,同时制得硫酸。某研究性学习小组对绿矾的焙烧反应进行探究,装置如下图所示。

回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加 溶液,无明显现象。再向试管中加入适量
溶液,无明显现象。再向试管中加入适量___________ (填写试剂名称),振荡,溶液变为红色。由此可知该样品___________ (填“已”或“未”)变质。
(2)写出绿矾充分焙烧的过程中只生成一种酸性气体的化学方程式___________ 。
(3)装置 中冷水的作用是
中冷水的作用是___________ 。
(4)为防止倒吸,停止实验时应进行的操作是___________ 。
(5)用 滴定法测定绿矾的纯度。称取
滴定法测定绿矾的纯度。称取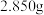 绿矾样品,配制成
绿矾样品,配制成 溶液,量取
溶液,量取 待测液于锥形瓶中,用
待测液于锥形瓶中,用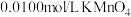 酸性溶液滴定,反应消耗
酸性溶液滴定,反应消耗 酸性溶液体积的平均值为
酸性溶液体积的平均值为 。
。
①配制绿矾样品溶液时需要用到的玻璃仪器是:烧杯、玻璃棒、量筒、___________ 。
②该实验滴定终点时溶液的颜色变为___________ 。
③该绿矾样品中 的质量分数为
的质量分数为___________ (计算结果保留3位有效数字)。
 )矿石能制备铁红,同时制得硫酸。某研究性学习小组对绿矾的焙烧反应进行探究,装置如下图所示。
)矿石能制备铁红,同时制得硫酸。某研究性学习小组对绿矾的焙烧反应进行探究,装置如下图所示。
回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加
 溶液,无明显现象。再向试管中加入适量
溶液,无明显现象。再向试管中加入适量(2)写出绿矾充分焙烧的过程中只生成一种酸性气体的化学方程式
(3)装置
 中冷水的作用是
中冷水的作用是(4)为防止倒吸,停止实验时应进行的操作是
(5)用
 滴定法测定绿矾的纯度。称取
滴定法测定绿矾的纯度。称取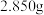 绿矾样品,配制成
绿矾样品,配制成 溶液,量取
溶液,量取 待测液于锥形瓶中,用
待测液于锥形瓶中,用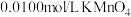 酸性溶液滴定,反应消耗
酸性溶液滴定,反应消耗 酸性溶液体积的平均值为
酸性溶液体积的平均值为 。
。①配制绿矾样品溶液时需要用到的玻璃仪器是:烧杯、玻璃棒、量筒、
②该实验滴定终点时溶液的颜色变为
③该绿矾样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2021-04-24更新
|
548次组卷
|
5卷引用:实验综合题
名校
6 . 下列说法不正确的是
①FeCl3溶液可用于铜质印刷线路板制作是因为FeCl3能从含Cu2+的溶液中置换出铜
②室温下,不能将浓硫酸盛放在铁桶中 ③K+、Fe3+、NO3-、SCN﹣在水溶液中能大量共存
④因氧化铁能与酸反应,可用于制作红色涂料 ⑤将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液观察溶液是否变红,可检验Fe(NO3)2晶体是否已氧化变质.
①FeCl3溶液可用于铜质印刷线路板制作是因为FeCl3能从含Cu2+的溶液中置换出铜
②室温下,不能将浓硫酸盛放在铁桶中 ③K+、Fe3+、NO3-、SCN﹣在水溶液中能大量共存
④因氧化铁能与酸反应,可用于制作红色涂料 ⑤将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液观察溶液是否变红,可检验Fe(NO3)2晶体是否已氧化变质.
| A.仅①②③ | B.仅①③④ | C.仅②④⑤ | D.全部 |
您最近一年使用:0次
2017-07-04更新
|
185次组卷
|
4卷引用:河北省承德市第二中学2016-2017学年高二下学期第一次月考化学试题
名校
7 . 铁常见的化合价有0、+2、+3,某化学兴趣小组进行了一系列有关铁及其化合物的实验,并检验其中所含的铁元素的化合价。
Ⅰ.利用如图装置进行“铁与水反应”的实验,并检验产物。
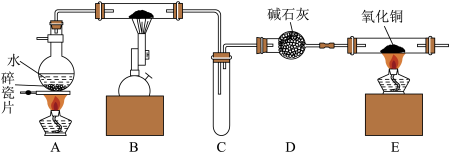
(1)B中反应的化学方程式为_______ 。
(2)E中的氧化铜出现由黑色变成红色可以证明反应后生成H2,点燃E处酒精灯之前应进行的具体操作步骤是_______ 。
(3)
现象A是_______ , a溶液中不含Fe3+的原因是金属铁将三价铁离子变成二价铁离子。
Ⅱ.铁是人体必需的微量元素,严重缺铁时需要服用补铁剂。实验小组为研究某补铁剂中铁元素的价态及其含量,设计并进行了如下实验:
[查阅资料] 1.该 补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。
2.KSCN中的硫元素为-2价。
3.K3[ Fe(CN)6]与Fe2+会产生蓝色沉淀。
实验一:检验该补铁剂中铁元素的价态。
(4)已知甲同学为了检验药品中Fe2+的存在。将药物碾碎、水溶后过滤。取少量所得滤液于试管中,加入K3[Fe(CN)6]溶液,未出现明显现象,其主要原因为_______ 。
改进后进行如下操作:

(5)试剂1是_______ , 试剂2是_______ 。
(6)加入试剂2后溶液变为浅红色,说明溶液①中含有_______ 。
(7)能证明溶液①中含有Fe2+的实验现象是_______ 。
(8)甲同学猜测深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的SCN-与H2O2发生了化学反应。
a.甲同学猜测的依据是_______ 。
b.乙同学通过实验证实了甲同学的猜测,其实验方案及现象是_______ 。
实验二:测定该补铁剂中铁元素的含量。
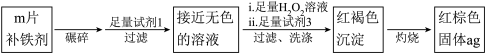
(9)计算每片该补铁剂含铁元素的质量为_______ g。
(10)人体只能吸收Fe2+,医生建议在服用该补铁剂时,同时服用维生素C,理由是_______ 。
Ⅰ.利用如图装置进行“铁与水反应”的实验,并检验产物。

(1)B中反应的化学方程式为
(2)E中的氧化铜出现由黑色变成红色可以证明反应后生成H2,点燃E处酒精灯之前应进行的具体操作步骤是
(3)
| 步骤 | 现象 |
| Ⅰ.取B中硬质玻璃管反应后样品少许,加入足量的盐酸并过滤,滤液为a | 固体溶解,溶液为绿色 |
| Ⅱ.取a溶液少许,滴加KSCN溶液 | 溶液不变红色 |
| Ⅲ.取a溶液少许,滴加NaOH溶液 | 现象A |
Ⅱ.铁是人体必需的微量元素,严重缺铁时需要服用补铁剂。实验小组为研究某补铁剂中铁元素的价态及其含量,设计并进行了如下实验:
[查阅资料] 1.该 补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。
2.KSCN中的硫元素为-2价。
3.K3[ Fe(CN)6]与Fe2+会产生蓝色沉淀。
实验一:检验该补铁剂中铁元素的价态。
(4)已知甲同学为了检验药品中Fe2+的存在。将药物碾碎、水溶后过滤。取少量所得滤液于试管中,加入K3[Fe(CN)6]溶液,未出现明显现象,其主要原因为
改进后进行如下操作:

(5)试剂1是
(6)加入试剂2后溶液变为浅红色,说明溶液①中含有
(7)能证明溶液①中含有Fe2+的实验现象是
(8)甲同学猜测深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的SCN-与H2O2发生了化学反应。
a.甲同学猜测的依据是
b.乙同学通过实验证实了甲同学的猜测,其实验方案及现象是
实验二:测定该补铁剂中铁元素的含量。

(9)计算每片该补铁剂含铁元素的质量为
(10)人体只能吸收Fe2+,医生建议在服用该补铁剂时,同时服用维生素C,理由是
您最近一年使用:0次
8 . 部分被氧化的Fe—Cu合金样品(氧化产物为Fe2O3、CuO)共5.92 g,经如下处理:

下列说法正确的是
①滤液A中的阳离子为Fe2+、Fe3+、H+
②样品中含氧元素的物质的量为0.03 mol
③溶解样品的过程中消耗硫酸的总物质的量为0.04 mol
④V=224mL
⑤V=336mL

下列说法正确的是
①滤液A中的阳离子为Fe2+、Fe3+、H+
②样品中含氧元素的物质的量为0.03 mol
③溶解样品的过程中消耗硫酸的总物质的量为0.04 mol
④V=224mL
⑤V=336mL
| A.①③④ | B.②③④ | C.②③⑤ | D.①③⑤ |
您最近一年使用:0次
2021-09-15更新
|
1539次组卷
|
10卷引用:河北正定中学2020-2021学年高一上学期第三次月考化学试题
河北正定中学2020-2021学年高一上学期第三次月考化学试题【全国百强校】湖南省长沙市长郡中学2019届高三上学期第五次调研考试化学试题福建2020届高三化学总复习专题训练——无极工艺流程选择填空题江西省南昌市第二中学2019-2020学年高二下学期期末考试化学试题黑龙江省大庆市铁人中学2019-2020学年高二下学期期末考试化学试题人教版(2019)高一必修第一册 第三章 铁 金属材料 章末综合检测卷湖南省长沙市湖南师大附中2022-2023学年高一下学期第一次月考化学试题 湖南师范大学附属中学2022-2023学年高一下学期第一次月考化学试题湖北省仙桃中学2022-2023学年高一下学期第一次段考化学试题云南省昆明市第八中学2023-2024学年高一上学期12月月考化学试题
名校
9 . 某学习小组的同学对氯气与铁的反应及产物进行了如下探究:

(1)装置的连接顺序为a→___ →______→_____→_____→b→c→f。
(2)硬质玻璃管与收集器之间没有用导管连接,这样做的优点是________________ 。
(3)反应一段时间,熄灭酒精灯,冷却后,将收集器及硬质玻璃管中的物质快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
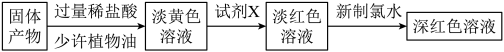
试剂X中溶质的化学式为____________ ;固体产物的成分可能为_____ (填字母)。
A.Fe和FeCl3 B.FeCl2和FeCl3 C.Fe、FeCl2和FeCl3 D.Fe和FeCl2
(4)加入少许植物油的作用是____________ ,加入新制氯水后溶液红色加深的原因:___________ (用离子方程式表示)。
(5)现有一含FeCl2和FeCl3混合物的样品,用离子交换法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为______ 。(计算结果保留两位有效数字)

(1)装置的连接顺序为a→
(2)硬质玻璃管与收集器之间没有用导管连接,这样做的优点是
(3)反应一段时间,熄灭酒精灯,冷却后,将收集器及硬质玻璃管中的物质快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

试剂X中溶质的化学式为
A.Fe和FeCl3 B.FeCl2和FeCl3 C.Fe、FeCl2和FeCl3 D.Fe和FeCl2
(4)加入少许植物油的作用是
(5)现有一含FeCl2和FeCl3混合物的样品,用离子交换法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为
您最近一年使用:0次
2019-02-02更新
|
778次组卷
|
10卷引用:河北省保定一中2018-2019学年高一上学期期末测试化学试题
(已下线)河北省保定一中2018-2019学年高一上学期期末测试化学试题【市级联考】安徽省黄山市2018-2019学年高一上学期期末考试化学试题云南省盈江县第一高级中学2019-2020学年高一上学期期末考试化学试题云南省西双版纳傣族自治州勐腊县第一中学2019-2020学年高一上学期期末考试化学试题云南省昆明市寻甸县第五中学2019-2020学年高一上学期期末考试化学试题(已下线)第三章单元检测(测)--2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)安徽省滁州市定远县民族中学2020-2021学年高一11月月考化学试题(已下线)专题10 化学实验基础——备战2021年高考化学纠错笔记云南省瑞丽市第一民族中学2021-2022学年高一下学期3月份考试化学试题实验活动2 铁及其化合物的性质



