名校
解题方法
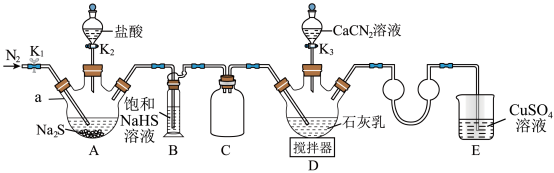
1 . 硫脲[CS(NH2)2]在药物制备、金属矿物浮选等方面有广泛应用。实验室可通过先制备Ca(HS)2,然后Ca(HS)2再与CaCN2合成CS(NH2)2实验装置(夹持及加热装置略)如图所示。回答下列问题:
(1)仪器a的名称是___________ ,装置B中饱和NaHS溶液的作用是___________ 。装置C的作用为___________ 。
(2)检查装置气密性后加入药品,打开K1,通入一段时间N2,目的是___________ ;然后关闭K1,打开K2,待A中反应结束后关闭K2。
(3)撤走搅拌器,水浴加热装置D,打开K3,在80℃条件下合成硫脲,控制温度在80°C的原因是___________ 。待D中反应结束后,关闭K3,打开K1,通入一段时间N2,目的是___________ 。
(4)设计实验证明反应过程中硫脲发生异构化生成了NH4SCN;取少量粗产品于试管中,加入适量蒸馏水溶解,再加入几滴___________ 溶液(填化学式),溶液变为红色,则可证明。
(5)装置E中CuSO4溶液的作用是___________ (用离子方程式表示)。
(6)装置D反应后的液体经分离、提纯、烘干可得产品。测定产品的纯度:称取m g产品,加水溶解配成250mL溶液,取25mL于锥形瓶中,加入稀硫酸酸化,用c mol/L酸性KMnO4标准溶液滴定,滴定至终点时消耗标准溶液V mL(已知滴定时,硫脲转化为CO2、N2和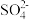 ,假设杂质不参与反应)。则样品中硫脲的质量分数为
,假设杂质不参与反应)。则样品中硫脲的质量分数为___________ (用含m、c、V的代数式表示)。
(1)仪器a的名称是
(2)检查装置气密性后加入药品,打开K1,通入一段时间N2,目的是
(3)撤走搅拌器,水浴加热装置D,打开K3,在80℃条件下合成硫脲,控制温度在80°C的原因是
(4)设计实验证明反应过程中硫脲发生异构化生成了NH4SCN;取少量粗产品于试管中,加入适量蒸馏水溶解,再加入几滴
(5)装置E中CuSO4溶液的作用是
(6)装置D反应后的液体经分离、提纯、烘干可得产品。测定产品的纯度:称取m g产品,加水溶解配成250mL溶液,取25mL于锥形瓶中,加入稀硫酸酸化,用c mol/L酸性KMnO4标准溶液滴定,滴定至终点时消耗标准溶液V mL(已知滴定时,硫脲转化为CO2、N2和
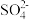 ,假设杂质不参与反应)。则样品中硫脲的质量分数为
,假设杂质不参与反应)。则样品中硫脲的质量分数为
您最近一年使用:0次
2024-04-20更新
|
253次组卷
|
5卷引用:河南省漯河市高级中学2023-2024学年高三下学期5月月考化学试题
10-11高二下·河北衡水·阶段练习
解题方法
2 .
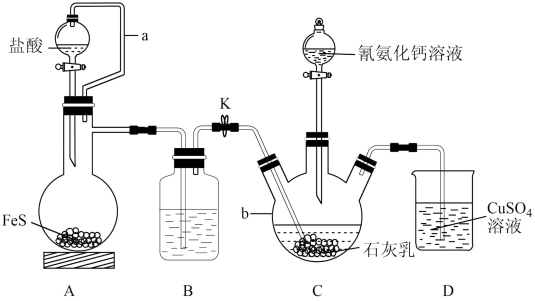
(1)菠菜营养丰富,素有“蔬菜之王”之称,在营养价值上是一种高效的补铁剂。某化学小组欲设计实验方案,探究菠菜中是否存在铁元素与草酸及可溶性草酸盐。甲同学查阅资料得知:草酸又名乙二酸,化学式为H2C2O4,是一种二元有机弱酸,具有较强的还原性。甲同学依据上述信息推测,菠菜中铁元素呈____ 价,其理由是____________________ 。甲同学同时设计实验方案,验证其推测是否正确。请简述实验方案_______________________________________ 。
(2)乙炔是有机合成工业的一种原料。工业上曾用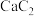 与水反应生成乙炔。
与水反应生成乙炔。
①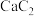 中
中 与
与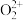 互为等电子体,
互为等电子体,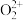 的电子式可表示为
的电子式可表示为_______________ ;1mol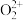 中含有的
中含有的 键数目为
键数目为________ 。
②乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是___________________ ;分子中处于同一直线上的原子数目最多为_____ 。
(1)菠菜营养丰富,素有“蔬菜之王”之称,在营养价值上是一种高效的补铁剂。某化学小组欲设计实验方案,探究菠菜中是否存在铁元素与草酸及可溶性草酸盐。甲同学查阅资料得知:草酸又名乙二酸,化学式为H2C2O4,是一种二元有机弱酸,具有较强的还原性。甲同学依据上述信息推测,菠菜中铁元素呈
(2)乙炔是有机合成工业的一种原料。工业上曾用
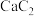 与水反应生成乙炔。
与水反应生成乙炔。①
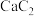 中
中 与
与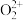 互为等电子体,
互为等电子体,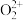 的电子式可表示为
的电子式可表示为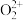 中含有的
中含有的 键数目为
键数目为②乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是
您最近一年使用:0次
2021高三·全国·专题练习
名校
解题方法
3 . 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”。由化学手册查阅得有关物质的熔、沸点数据如表。
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,你认为他的解释是否合理___________ (填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是___________ ,反应的离子方程式为___________ 。
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:
取一块该熔融物冷却后投入到少量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有Fe2O3.则物质甲是___________ (填化学式)。该同学的实验方案是否合理?___________ (填“合理”或“不合理”)。理由:___________ 。
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1460 |
| 沸点/℃ | 2467 | 2980 | 2750 |
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:
取一块该熔融物冷却后投入到少量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有Fe2O3.则物质甲是
您最近一年使用:0次
名校
解题方法
4 . 四氯化锡(SnCl4)是合成有机锡化合物的原料,制备SnCl4的装置如图所示。
有关信息如表:
(1)仪器A的名称为___________ ,甲中发生反应的离子方程式为___________ 。
(2)如缺少装置丙,丁处主要副反应的化学方程式为___________ 。
(3)加热丁装置,锡熔化,与Cl2反应,产物有SnCl4和SnCl2,为了确认丁中生成的SnCl2,可选用以下试剂___________ (填序号)检验。
A.稀盐酸 B.酸性高锰酸钾 C.加入有KSCN的FeCl3溶液
(4)丁中反应需要通入过量的Cl2,并控制温度在232~652℃范围,控制温度目的是___________ 。
(5)可以通过___________ 现象判断丁中的反应已经完成。若制得的SnCl4显黄色,可能的原因是___________ 。
(6)利用沉淀滴定法测定产品中Sn2+的含量,方案如下:准确称取mg产品于锥形瓶中,用蒸馏水溶解,X溶液作指示剂,用bmol/L的硝酸银标准溶液滴定,滴定终点时消耗硝酸银溶液V1mL,由此可计算产品中Sn2+的质量分数。
①参考表中的数据,X溶液最好选用的是___________ (填序号)。
A.NaCl溶液 B.NaBr溶液 C.NaCN溶液 D.Na2CrO4溶液
②乙同学认为甲同学测得的Sn2+含量可能会偏高,理由___________ 。

有关信息如表:
| 化学式 | Sn | SnCl2 | SnCl4 |
| 熔点/℃ | 232 | 246 | -33 |
| 沸点/℃ | 2260 | 652 | 114 |
| 其他性质 | 银白色固体金属 | 无色晶体,Sn2+易被Fe3+、I2等氧化为Sn4+ | 无色液体,易水解生成SnO2·xH2O |
(2)如缺少装置丙,丁处主要副反应的化学方程式为
(3)加热丁装置,锡熔化,与Cl2反应,产物有SnCl4和SnCl2,为了确认丁中生成的SnCl2,可选用以下试剂
A.稀盐酸 B.酸性高锰酸钾 C.加入有KSCN的FeCl3溶液
(4)丁中反应需要通入过量的Cl2,并控制温度在232~652℃范围,控制温度目的是
(5)可以通过
(6)利用沉淀滴定法测定产品中Sn2+的含量,方案如下:准确称取mg产品于锥形瓶中,用蒸馏水溶解,X溶液作指示剂,用bmol/L的硝酸银标准溶液滴定,滴定终点时消耗硝酸银溶液V1mL,由此可计算产品中Sn2+的质量分数。
①参考表中的数据,X溶液最好选用的是
A.NaCl溶液 B.NaBr溶液 C.NaCN溶液 D.Na2CrO4溶液
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 |
| 颜色 | 白 | 浅黄 | 白 | 砖红 |
| Ksp | 1.77×10-10 | 5.4×10-14 | 2.7×10-16 | 1.12×10-12 |
您最近一年使用:0次
名校
解题方法
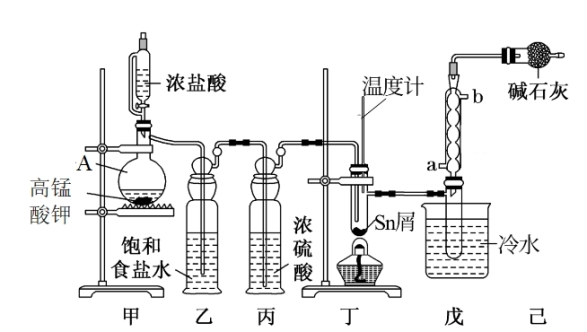
5 . 硫脲[ ]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙(
]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙( )与
)与 溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
回答下列问题:
(1) 的电子式为
的电子式为_______ 。仪器b的名称是_______ 。
(2)装置A中a的作用是_______ ,A中发生反应的化学方程式为_______ 。
(3)装置B中盛放的试剂是_______ ,其作用是_______ 。
(4)装置C中生成硫脲的总反应为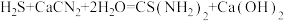 ,若反应分两步进行,写出第二步生成硫脲的化学方程式:
,若反应分两步进行,写出第二步生成硫脲的化学方程式:_______ 。
(5)装置D中可能出现的现象是_______ 。
(6)硫氰化铵(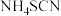 )熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是
)熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是_______ (写出操作步骤和实验现象)。
 ]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙(
]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙( )与
)与 溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
回答下列问题:
(1)
 的电子式为
的电子式为(2)装置A中a的作用是
(3)装置B中盛放的试剂是
(4)装置C中生成硫脲的总反应为
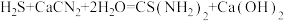 ,若反应分两步进行,写出第二步生成硫脲的化学方程式:
,若反应分两步进行,写出第二步生成硫脲的化学方程式:(5)装置D中可能出现的现象是
(6)硫氰化铵(
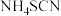 )熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是
)熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是
您最近一年使用:0次
2022-04-16更新
|
442次组卷
|
3卷引用:河北省名校联盟2021-2022学年高三下学期4月质量检测化学试题
2014·江苏南通·二模
名校
6 . 三氯化铁是合成草酸铁的重要原料。
(1)利用工业FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)3·5H2O]的实验流程如下图所示:
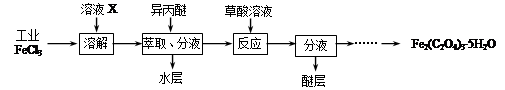
①为抑制FeCl3水解,溶液X为____________ 。
②上述流程中FeCl3能被异丙醚萃取,其原因是_________ ;检验萃取、分液后所得水层中是否含有Fe3+的方法是______________ 。
③所得Fe2(C2O4)3·5H2O需用冰水洗涤,其目的是__________________ 。
④为测定所得草酸铁晶体的纯度,实验室称取a g样品,加硫酸酸化,用KMnO4标准溶液滴定生成的H2C2O4,KMnO4标准溶液应置于如图所示仪器________________ (填“甲”或“乙”)中。下列情况会造成实验测得Fe2(C2O4)3·5H2O含量偏低的是________________ 。

a.盛放KMnO4的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
(2)某研究性学习小组欲从蚀刻镀铜电路板所得废液(溶质为FeCl2、CuCl2、FeCl3)出发,制备单质铜和无水FeCl3,再由FeCl3合成Fe2(C2O4)3·5H2O。请补充完整由蚀刻废液制备单质铜和无水FeCl3的实验步骤(可选用的试剂:铁粉、盐酸、NaOH溶液和H2O2溶液):向废液中加入足量铁粉,充分反应后过滤;__________ ;___________ ;调节溶液pH,将溶液蒸发浓缩、冷却结晶、过滤、洗涤干燥得FeCl3·6H2O;________________ ,得到无水FeCl3。
(1)利用工业FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)3·5H2O]的实验流程如下图所示:

①为抑制FeCl3水解,溶液X为
②上述流程中FeCl3能被异丙醚萃取,其原因是
③所得Fe2(C2O4)3·5H2O需用冰水洗涤,其目的是
④为测定所得草酸铁晶体的纯度,实验室称取a g样品,加硫酸酸化,用KMnO4标准溶液滴定生成的H2C2O4,KMnO4标准溶液应置于如图所示仪器

a.盛放KMnO4的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
(2)某研究性学习小组欲从蚀刻镀铜电路板所得废液(溶质为FeCl2、CuCl2、FeCl3)出发,制备单质铜和无水FeCl3,再由FeCl3合成Fe2(C2O4)3·5H2O。请补充完整由蚀刻废液制备单质铜和无水FeCl3的实验步骤(可选用的试剂:铁粉、盐酸、NaOH溶液和H2O2溶液):向废液中加入足量铁粉,充分反应后过滤;
您最近一年使用:0次
2016-12-09更新
|
721次组卷
|
4卷引用:2016届江苏省泰州中学高三上学期第二次质检化学试卷
2016届江苏省泰州中学高三上学期第二次质检化学试卷福建省福州一中2019-2020学年高二下学期第一次月考化学试题(已下线)2014届江苏省南通市高三第二次调研化学试卷2017届江苏省南通市高三高考全真模拟(二)化学试卷



