2019·安徽六安·一模
名校
1 . 二氯亚砜(SOCl2)是一种无色易挥发液体,剧烈水解生成两种气体,常用作脱水剂,其熔点-105℃,沸点79℃,140℃以上时易分解。
(1)用硫黄(S)、液氯和三氧化硫为原料,在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量比为______________________ 。
(2)甲同学设计如图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2(夹持及加热装置略)
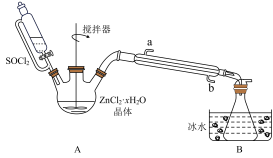
①SOCl2在该实验中的作用_________________________________ ;加热条件下,A装置中总的化学方程式为_________________________________ 。
②实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为___________ (填序号)
a.干燥 b.洗涤; c加入足量硝酸酸化的硝酸银溶液,充分反应;
d称取蒸干后的固体m克溶于水;e.过滤; f称得固体为n克
若m/n=___________ (保留小数点后两位),即可证明晶体已完全脱水。
(3)乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。
①可能发生的副反应的离子方程式_________________________________ 。
②丙同学设计了如下实验方案判断副反应的可能性:
i.取少量FeCl3·6H2O于试管中,加入足量SOCl2振荡使两种物质充分反应:
ii.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。
供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、KSCN溶液、K3[Fe(CN)6]溶液、溴水)
(1)用硫黄(S)、液氯和三氧化硫为原料,在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量比为
(2)甲同学设计如图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2(夹持及加热装置略)

①SOCl2在该实验中的作用
②实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为
a.干燥 b.洗涤; c加入足量硝酸酸化的硝酸银溶液,充分反应;
d称取蒸干后的固体m克溶于水;e.过滤; f称得固体为n克
若m/n=
(3)乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。
①可能发生的副反应的离子方程式
②丙同学设计了如下实验方案判断副反应的可能性:
i.取少量FeCl3·6H2O于试管中,加入足量SOCl2振荡使两种物质充分反应:
ii.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。
供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、KSCN溶液、K3[Fe(CN)6]溶液、溴水)
| 方案 | 操作 | 现象 | 结论 |
| 方案一 | 往一支试管中滴加 | 若无明显现象 | 则发生了上述副反应 |
| 方案二 | 往另一支试管中滴加 | 则没有发生上述副反应 |
您最近一年使用:0次
2021高三·全国·专题练习
名校
解题方法
2 . 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”。由化学手册查阅得有关物质的熔、沸点数据如表。
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,你认为他的解释是否合理___________ (填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是___________ ,反应的离子方程式为___________ 。
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:
取一块该熔融物冷却后投入到少量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有Fe2O3.则物质甲是___________ (填化学式)。该同学的实验方案是否合理?___________ (填“合理”或“不合理”)。理由:___________ 。
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1460 |
| 沸点/℃ | 2467 | 2980 | 2750 |
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:
取一块该熔融物冷却后投入到少量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有Fe2O3.则物质甲是
您最近一年使用:0次
解题方法
3 . 磷酸亚铁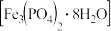 为白蓝色晶体,溶于强酸,不溶于水和乙醇。它是生产
为白蓝色晶体,溶于强酸,不溶于水和乙醇。它是生产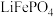 的原料,实验室利用
的原料,实验室利用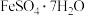 、
、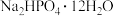 及
及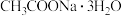 为原料制备磷酸亚铁的实验流程如图1:
为原料制备磷酸亚铁的实验流程如图1:
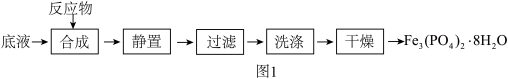
合成时的主要反应为: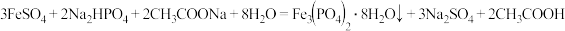
 实验中由原料配制溶液时,蒸馏水事先要煮沸、冷却,煮沸的目的是
实验中由原料配制溶液时,蒸馏水事先要煮沸、冷却,煮沸的目的是______ 。
 合成时,在三口烧瓶中先加入抗坏血酸
合成时,在三口烧瓶中先加入抗坏血酸 稀溶液作底液,再向烧瓶中,滴入
稀溶液作底液,再向烧瓶中,滴入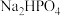 与
与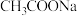 混合溶液至
混合溶液至 时,再滴入
时,再滴入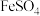 溶液,最终维持
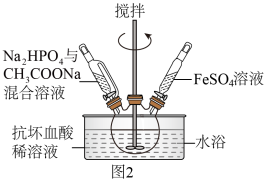
溶液,最终维持 装置如图2所示
装置如图2所示 。
。
 实验不是将三种溶液直接混合的原因是
实验不是将三种溶液直接混合的原因是______ 。
 用抗坏血酸溶液作底液而不用铁粉,其主要原因是
用抗坏血酸溶液作底液而不用铁粉,其主要原因是______ 。
 生成的
生成的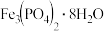 沉淀需充分洗涤,检验洗涤是否完全的方法是
沉淀需充分洗涤,检验洗涤是否完全的方法是______
 检验产品中是否混有
检验产品中是否混有 或
或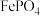 杂质的方法是
杂质的方法是______ 。
 某研究性学习小组的同学拟用工业品十二水合磷酸氢二钠
某研究性学习小组的同学拟用工业品十二水合磷酸氢二钠 含
含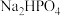 、重金属盐及有色杂质等
、重金属盐及有色杂质等 提纯得到
提纯得到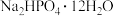 晶体。已知:
晶体。已知: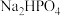 溶液pH
溶液pH  ,重金属硫化物不溶于水。
,重金属硫化物不溶于水。
请补充实验步骤
 实验中必须使用的试剂有:
实验中必须使用的试剂有: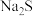 溶液、活性炭、
溶液、活性炭、 溶液、乙醇
溶液、乙醇 磷酸氢二钠在水中溶解度
磷酸氢二钠在水中溶解度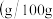 水
水
将工业品溶于适量热水,______ 。
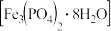 为白蓝色晶体,溶于强酸,不溶于水和乙醇。它是生产
为白蓝色晶体,溶于强酸,不溶于水和乙醇。它是生产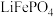 的原料,实验室利用
的原料,实验室利用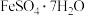 、
、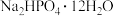 及
及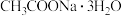 为原料制备磷酸亚铁的实验流程如图1:
为原料制备磷酸亚铁的实验流程如图1:

合成时的主要反应为:
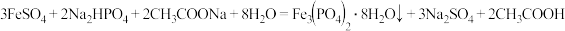
 实验中由原料配制溶液时,蒸馏水事先要煮沸、冷却,煮沸的目的是
实验中由原料配制溶液时,蒸馏水事先要煮沸、冷却,煮沸的目的是 合成时,在三口烧瓶中先加入抗坏血酸
合成时,在三口烧瓶中先加入抗坏血酸 稀溶液作底液,再向烧瓶中,滴入
稀溶液作底液,再向烧瓶中,滴入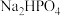 与
与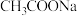 混合溶液至
混合溶液至 时,再滴入
时,再滴入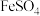 溶液,最终维持
溶液,最终维持 装置如图2所示
装置如图2所示 。
。 实验不是将三种溶液直接混合的原因是
实验不是将三种溶液直接混合的原因是 用抗坏血酸溶液作底液而不用铁粉,其主要原因是
用抗坏血酸溶液作底液而不用铁粉,其主要原因是 生成的
生成的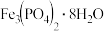 沉淀需充分洗涤,检验洗涤是否完全的方法是
沉淀需充分洗涤,检验洗涤是否完全的方法是 检验产品中是否混有
检验产品中是否混有 或
或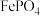 杂质的方法是
杂质的方法是 某研究性学习小组的同学拟用工业品十二水合磷酸氢二钠
某研究性学习小组的同学拟用工业品十二水合磷酸氢二钠 含
含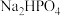 、重金属盐及有色杂质等
、重金属盐及有色杂质等 提纯得到
提纯得到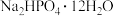 晶体。已知:
晶体。已知: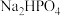 溶液pH
溶液pH  ,重金属硫化物不溶于水。
,重金属硫化物不溶于水。请补充实验步骤
 实验中必须使用的试剂有:
实验中必须使用的试剂有: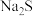 溶液、活性炭、
溶液、活性炭、 溶液、乙醇
溶液、乙醇 磷酸氢二钠在水中溶解度
磷酸氢二钠在水中溶解度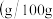 水
水
温度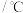 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
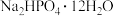 | 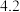 | 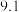 | 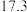 | 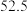 | |||||||
 | 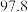 | ||||||||||
 |  | 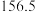 | 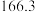 |  | 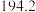 | ||||||
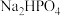 | 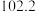 |
您最近一年使用:0次
2018·天津红桥·二模
解题方法
4 . I.铁是生产、生活及生命中的重要元素。
(1)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合能力。药品美蓝是其有效的解毒剂,解毒时美蓝发生_____ 反 应(填“氧化”或“还原”)。
(2)现有一瓶放置了一段时间的某浓度的FeCl2溶液,请设计实验检验其中是否含有Fe3+_____ 。
(3)普通铁粉与水蒸气在高温下反应生成铁的某种氧化物和氢气,该氧化物和氢气在高温下发生逆反应得到“引火铁”。若一定量的普通铁粉和水蒸气在高温下反应生成44.8LH2 (已换算到标况下),则转移电子数目为_______ ;“引火铁” 是一种极细的铁粉,它在空气中可以自燃,其原因是_____________ 。
II.化合物M是某种具有磁学性质的新型电子材料的主要成分,由两种元素组成。为了研究其组成,设计如下实验:

气体甲可使湿润红色石蕊试纸交蓝。请回答:
(1) M的化学式___________ ,气体甲的电子式__________ 。
(2)白色沉淀乙在空气中变成红褐色沉淀丙的原因是(用化学方程式表示)_______________ 。
(3) 高温条件下,丁与甲反应生成两种单质和水,该反应的化学方程式为______________ 。
(1)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合能力。药品美蓝是其有效的解毒剂,解毒时美蓝发生
(2)现有一瓶放置了一段时间的某浓度的FeCl2溶液,请设计实验检验其中是否含有Fe3+
(3)普通铁粉与水蒸气在高温下反应生成铁的某种氧化物和氢气,该氧化物和氢气在高温下发生逆反应得到“引火铁”。若一定量的普通铁粉和水蒸气在高温下反应生成44.8LH2 (已换算到标况下),则转移电子数目为
II.化合物M是某种具有磁学性质的新型电子材料的主要成分,由两种元素组成。为了研究其组成,设计如下实验:

气体甲可使湿润红色石蕊试纸交蓝。请回答:
(1) M的化学式
(2)白色沉淀乙在空气中变成红褐色沉淀丙的原因是(用化学方程式表示)
(3) 高温条件下,丁与甲反应生成两种单质和水,该反应的化学方程式为
您最近一年使用:0次
2018-05-21更新
|
327次组卷
|
4卷引用:2018年高考题及模拟题汇编 专题13 元素及其化合物知识的综合应用
(已下线)2018年高考题及模拟题汇编 专题13 元素及其化合物知识的综合应用(已下线)章末综合测评(三)【全国市级联考】天津市红桥区2018届高三下学期第二次模拟考试化学试题河南省周口市中英文学校2021届高三上学期期中考试化学试题



