名校
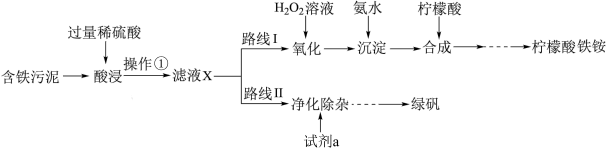
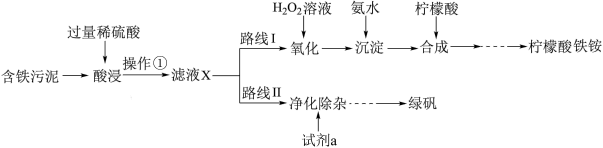
1 . 某实验小组以含铁污泥(主要成分为Fe2O3、FeO、Fe及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾(FeSO4•7H2O)和柠檬酸铁铵。根据所学知识,回答下列问题:
① 时检验,溶液变红,写出反应的离子方程式
时检验,溶液变红,写出反应的离子方程式___________ 。
② 时检验,用离子方程式表示溶液未变红的原因
时检验,用离子方程式表示溶液未变红的原因___________ 。
③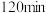 时检验,溶液复又变红,用离子方程式说明原因
时检验,溶液复又变红,用离子方程式说明原因___________ 。
(2)操作①的名称是___________ ,路线I中,加H2O2溶液的目的是(用离子方程式说明)___________ 。
(3)实验室中配制FeSO4溶液时通常需加入少量的试剂a,目的是___________
(4)测定所得硫酸亚铁晶体中 的含量,步骤如下:
的含量,步骤如下:
Ⅰ:称取 硫酸亚铁晶体样品,配制成
硫酸亚铁晶体样品,配制成 溶液。
溶液。
Ⅱ:取出 溶液,加入适量稀硫酸,滴入
溶液,加入适量稀硫酸,滴入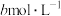 的
的 溶液,至反应完全共消耗
溶液,至反应完全共消耗 溶液
溶液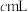 。
。
①计算硫酸亚铁晶体样品中 的质量分数
的质量分数___________ 。
②若配置硫酸亚铁溶液出现黄色,则测定结果___________ (填:偏高、偏低、不变)
| 酸浸时间 |  |  | 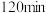 |
| 用KSCN溶液检验 | 变红 | 未变红 | 变红 |
 时检验,溶液变红,写出反应的离子方程式
时检验,溶液变红,写出反应的离子方程式②
 时检验,用离子方程式表示溶液未变红的原因
时检验,用离子方程式表示溶液未变红的原因③
 时检验,溶液复又变红,用离子方程式说明原因
时检验,溶液复又变红,用离子方程式说明原因(2)操作①的名称是
(3)实验室中配制FeSO4溶液时通常需加入少量的试剂a,目的是
(4)测定所得硫酸亚铁晶体中
 的含量,步骤如下:
的含量,步骤如下:Ⅰ:称取
 硫酸亚铁晶体样品,配制成
硫酸亚铁晶体样品,配制成 溶液。
溶液。Ⅱ:取出
 溶液,加入适量稀硫酸,滴入
溶液,加入适量稀硫酸,滴入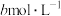 的
的 溶液,至反应完全共消耗
溶液,至反应完全共消耗 溶液
溶液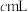 。
。①计算硫酸亚铁晶体样品中
 的质量分数
的质量分数②若配置硫酸亚铁溶液出现黄色,则测定结果
您最近半年使用:0次
解题方法
2 . 某实验小组以含铁污泥(主要成分为Fe2O3、FeO、Fe及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾(FeSO4•7H2O)和柠檬酸铁铵。
根据所学知识,回答下列问题:
(1)操作①的名称是_______ ,路线I中,加入H2O2溶液的目的是_______ 。
(2)写出“酸浸”时,Fe2O3与硫酸反应的化学方程式:_______ ;检验含有Fe3+的试剂是_______ 。
(3)实验室中配制FeSO4溶液时通常需加入少量的试剂a,目的是_______ 。
(4)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:_______ 。
(5)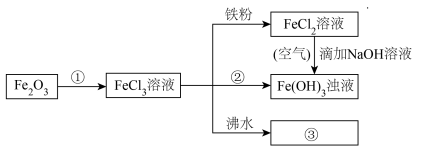
FeCl2溶液→Fe(OH)3浊液的过程中,观察到的实验现象是_______ 。

根据所学知识,回答下列问题:
(1)操作①的名称是
(2)写出“酸浸”时,Fe2O3与硫酸反应的化学方程式:
(3)实验室中配制FeSO4溶液时通常需加入少量的试剂a,目的是
(4)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:
(5)

FeCl2溶液→Fe(OH)3浊液的过程中,观察到的实验现象是
您最近半年使用:0次
解题方法
3 . 某实验小组以含铁污泥(主要成分为Fe2O3、FeO、Fe及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾(FeSO4•7H2O)和柠檬酸铁铵。
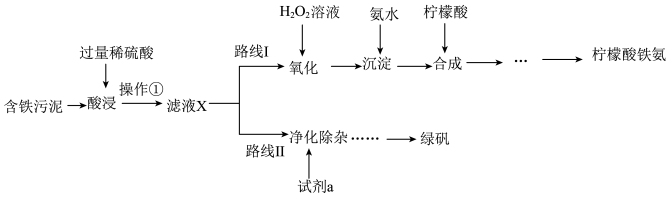
根据所学知识,回答下列问题:
(1)操作①的名称______ ,路线I中,加入H2O2溶液的目的是______ 。
(2)写出“酸浸”时,Fe2O3与硫酸反应的化学方程式:______ ;检验含有Fe3+的方法是______ 。
(3)“滤液X”中一定含有的阳离子为_______ 。
(4)实验室中配制FeSO4溶液时通常需加入少量的试剂a,目的是_____ ,请写出相应的离子方程式:______ 。

根据所学知识,回答下列问题:
(1)操作①的名称
(2)写出“酸浸”时,Fe2O3与硫酸反应的化学方程式:
(3)“滤液X”中一定含有的阳离子为
(4)实验室中配制FeSO4溶液时通常需加入少量的试剂a,目的是
您最近半年使用:0次
解题方法
4 . 富马酸(反式丁烯二酸)与Fe2+形成的配合物——富马酸铁又称“富血铁”,可用于治疗缺铁性贫血。以下是合成富马酸铁的一种工艺路线:
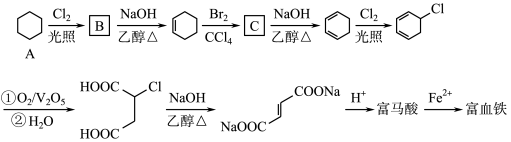
回答下列问题:
(1)A的化学名称为:_________________ ,由A生成B的反应类型为:___________
(2)C的结构简式为:______________ ,加热时,C与NaOH的乙醇溶液反应的化学方程式为:___________
(3)富马酸的结构简式为:___________
(4)检验富血铁中是否含有Fe3+的实验操作步骤是:___________
(5)富马酸为二元羧酸,1mol富马酸与足量饱和NaHCO3溶液反应可放出_______ L CO2(标况);富马酸的同分异构体中,同为二元羧酸的还有(写出结构简式):___________ 、___________ 。

回答下列问题:
(1)A的化学名称为:
(2)C的结构简式为:
(3)富马酸的结构简式为:
(4)检验富血铁中是否含有Fe3+的实验操作步骤是:
(5)富马酸为二元羧酸,1mol富马酸与足量饱和NaHCO3溶液反应可放出
您最近半年使用:0次
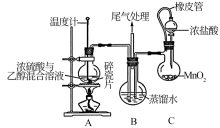
5 . 2−氯乙醇(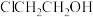 )是重要的有机溶剂和有机合成原料,主要用作合成橡胶的原料以及染料、农药、医药的中间体。氯乙醇的工业生产常用1991年Gomberg提出的方法——将乙烯和氯气同时通入水中制得。某校同学设计下列装置进行2−氯乙醇制备实验(部分加热装置及夹持仪器已省略):
)是重要的有机溶剂和有机合成原料,主要用作合成橡胶的原料以及染料、农药、医药的中间体。氯乙醇的工业生产常用1991年Gomberg提出的方法——将乙烯和氯气同时通入水中制得。某校同学设计下列装置进行2−氯乙醇制备实验(部分加热装置及夹持仪器已省略):
已知装置A中发生的主反应: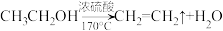 ;
;
主要副反应: 。
。
回答下列问题:
(1)配制浓硫酸和乙醇混合溶液的方法是___________ 。
a.搅拌下将浓硫酸慢慢加入到乙醇中 b.搅拌下将乙醇慢慢加入到浓硫酸中
(2)装置A圆底烧瓶中加碎瓷片的目的是___________ 。
(3)装置C中橡皮管的作用是___________ 。
(4)装置B中生成2−氯乙醇的过程的化学反应方程式有___________ 。
(5)反应结束后,装置B的溶液中2−氯乙醇质量分数的测定步骤如下(假定含氯物质只有2−氯乙醇和HCl,密度为 ,2−氯乙醇的摩尔质量为
,2−氯乙醇的摩尔质量为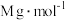 。):
。):
步骤1:吸取2.00mL装置B中的溶液于锥形瓶中,加入NaOH溶液,加热,使2−氯乙醇中的氯元素转化为 ,用硝酸酸化后加入a mL 0.1000
,用硝酸酸化后加入a mL 0.1000
 标准溶液,然后加入几滴铁铵矾[
标准溶液,然后加入几滴铁铵矾[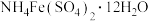 ]的溶液,用0.1000
]的溶液,用0.1000 的
的 标准溶液回滴过量的
标准溶液回滴过量的 (
( ),消耗
),消耗 溶液b mL。
溶液b mL。
步骤2:另取2.00mL装置B中的溶液于锥形瓶中,加入a mL 0.1000
 标准溶液,加入几滴铁铵矾的溶液,用0.1000
标准溶液,加入几滴铁铵矾的溶液,用0.1000 的
的 标准溶液回滴过量的
标准溶液回滴过量的 ,消耗
,消耗 溶液c mL。
溶液c mL。
①铁铵矾溶液的作用是___________ 。
②装置B的溶液中2−氯乙醇的质量分数为___________ 。
③在滴定终点到达之前的滴定过程中,两种沉淀表面会吸附部分 ,需不断剧烈摇动锥形瓶。若步骤2中为未按此要求操作,则测定结果会
,需不断剧烈摇动锥形瓶。若步骤2中为未按此要求操作,则测定结果会___________ (选填“偏高”“偏低”或“无影响”)。
 )是重要的有机溶剂和有机合成原料,主要用作合成橡胶的原料以及染料、农药、医药的中间体。氯乙醇的工业生产常用1991年Gomberg提出的方法——将乙烯和氯气同时通入水中制得。某校同学设计下列装置进行2−氯乙醇制备实验(部分加热装置及夹持仪器已省略):
)是重要的有机溶剂和有机合成原料,主要用作合成橡胶的原料以及染料、农药、医药的中间体。氯乙醇的工业生产常用1991年Gomberg提出的方法——将乙烯和氯气同时通入水中制得。某校同学设计下列装置进行2−氯乙醇制备实验(部分加热装置及夹持仪器已省略): 
已知装置A中发生的主反应:
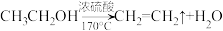 ;
;主要副反应:
 。
。回答下列问题:
(1)配制浓硫酸和乙醇混合溶液的方法是
a.搅拌下将浓硫酸慢慢加入到乙醇中 b.搅拌下将乙醇慢慢加入到浓硫酸中
(2)装置A圆底烧瓶中加碎瓷片的目的是
(3)装置C中橡皮管的作用是
(4)装置B中生成2−氯乙醇的过程的化学反应方程式有
(5)反应结束后,装置B的溶液中2−氯乙醇质量分数的测定步骤如下(假定含氯物质只有2−氯乙醇和HCl,密度为
 ,2−氯乙醇的摩尔质量为
,2−氯乙醇的摩尔质量为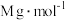 。):
。):步骤1:吸取2.00mL装置B中的溶液于锥形瓶中,加入NaOH溶液,加热,使2−氯乙醇中的氯元素转化为
 ,用硝酸酸化后加入a mL 0.1000
,用硝酸酸化后加入a mL 0.1000
 标准溶液,然后加入几滴铁铵矾[
标准溶液,然后加入几滴铁铵矾[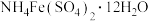 ]的溶液,用0.1000
]的溶液,用0.1000 的
的 标准溶液回滴过量的
标准溶液回滴过量的 (
(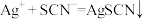 ),消耗
),消耗 溶液b mL。
溶液b mL。步骤2:另取2.00mL装置B中的溶液于锥形瓶中,加入a mL 0.1000

 标准溶液,加入几滴铁铵矾的溶液,用0.1000
标准溶液,加入几滴铁铵矾的溶液,用0.1000 的
的 标准溶液回滴过量的
标准溶液回滴过量的 ,消耗
,消耗 溶液c mL。
溶液c mL。①铁铵矾溶液的作用是
②装置B的溶液中2−氯乙醇的质量分数为
③在滴定终点到达之前的滴定过程中,两种沉淀表面会吸附部分
 ,需不断剧烈摇动锥形瓶。若步骤2中为未按此要求操作,则测定结果会
,需不断剧烈摇动锥形瓶。若步骤2中为未按此要求操作,则测定结果会
您最近半年使用:0次
名校
6 . 二氯亚砜(SOCl2)是一种无色易挥发液体,剧烈水解生成两种气体,常用作脱水剂,其熔点为-105℃,沸点为79℃,140℃以上时易分解。并且Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为4Li+2SOC12=4LiCl+S+SO2。
(1)组装该电池必须在无水、无氧的条件下进行,原因是______________________ 。
(2)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,反应的化学方程式为______________________ 。用硫黄(S)、液氯和三氧化硫为原料在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量之比为___________ 。
(3)甲同学设计如图所示的装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并利用装置F验证生成物中的某种气体(夹持及加热装置略)。
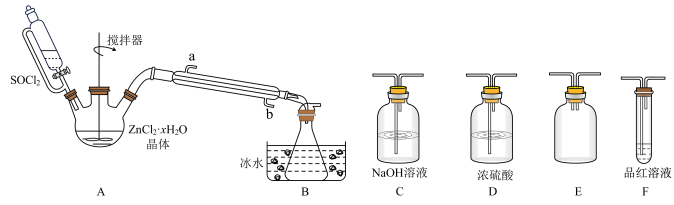
①用原理解释SOCl2在该实验中的作用:_________________________________ 。
②装置的连接顺序为A→B→______________________ 。
③实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为___________ (填序号)。
a.加入足量硝酸酸化的硝酸银溶液,充分反应 b.称得固体为n克
c.干燥 d.称取蒸干后的固体m克溶于水
e.过滤 f.洗涤
(4)乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。
①可能发生的副反应的离子方程式为_________________________________ 。
②两同学设计了如下实验方案判断副反应的可能性:
i.取少量FeCl3·6H2O于试管中,加入足量SOCl2,振荡使两种物质充分反应;
ii.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。
(供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、BaCl2溶液、K3[Fe(CN)6]溶液、溴水)
(1)组装该电池必须在无水、无氧的条件下进行,原因是
(2)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,反应的化学方程式为
(3)甲同学设计如图所示的装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并利用装置F验证生成物中的某种气体(夹持及加热装置略)。

①用原理解释SOCl2在该实验中的作用:
②装置的连接顺序为A→B→
③实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为
a.加入足量硝酸酸化的硝酸银溶液,充分反应 b.称得固体为n克
c.干燥 d.称取蒸干后的固体m克溶于水
e.过滤 f.洗涤
(4)乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。
①可能发生的副反应的离子方程式为
②两同学设计了如下实验方案判断副反应的可能性:
i.取少量FeCl3·6H2O于试管中,加入足量SOCl2,振荡使两种物质充分反应;
ii.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。
(供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、BaCl2溶液、K3[Fe(CN)6]溶液、溴水)
| 方案 | 操作 | 现象 | 结论 |
| 方案一 | 往一支试管中滴加 | 若有白色沉淀生成 | 则发生了上述副反应 |
| 方案二 | 往另一支试管中滴加 | 则没有发生上述副反应 |
您最近半年使用:0次
2019-03-07更新
|
855次组卷
|
2卷引用:【市级联考】云南省保山市2019届高三下学期毕业生市级统一检测理科综合化学试题
名校
7 . 二氯亚砜(SOCl2)是一种无色易挥发液体,剧烈水解生成两种气体,常用作脱水剂,其熔点-105℃,沸点79℃,140℃以上时易分解。
(1)用硫黄(S)、液氯和三氧化硫为原料,在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量比为______________________ 。
(2)甲同学设计如图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2(夹持及加热装置略)
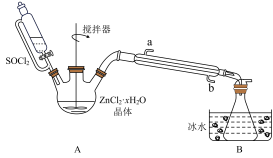
①SOCl2在该实验中的作用_________________________________ ;加热条件下,A装置中总的化学方程式为_________________________________ 。
②实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为___________ (填序号)
a.干燥 b.洗涤; c加入足量硝酸酸化的硝酸银溶液,充分反应;
d称取蒸干后的固体m克溶于水;e.过滤; f称得固体为n克
若m/n=___________ (保留小数点后两位),即可证明晶体已完全脱水。
(3)乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。
①可能发生的副反应的离子方程式_________________________________ 。
②丙同学设计了如下实验方案判断副反应的可能性:
i.取少量FeCl3·6H2O于试管中,加入足量SOCl2振荡使两种物质充分反应:
ii.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。
供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、KSCN溶液、K3[Fe(CN)6]溶液、溴水)
(1)用硫黄(S)、液氯和三氧化硫为原料,在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量比为
(2)甲同学设计如图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2(夹持及加热装置略)

①SOCl2在该实验中的作用
②实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为
a.干燥 b.洗涤; c加入足量硝酸酸化的硝酸银溶液,充分反应;
d称取蒸干后的固体m克溶于水;e.过滤; f称得固体为n克
若m/n=
(3)乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。
①可能发生的副反应的离子方程式
②丙同学设计了如下实验方案判断副反应的可能性:
i.取少量FeCl3·6H2O于试管中,加入足量SOCl2振荡使两种物质充分反应:
ii.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。
供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、KSCN溶液、K3[Fe(CN)6]溶液、溴水)
| 方案 | 操作 | 现象 | 结论 |
| 方案一 | 往一支试管中滴加 | 若无明显现象 | 则发生了上述副反应 |
| 方案二 | 往另一支试管中滴加 | 则没有发生上述副反应 |
您最近半年使用:0次
名校
解题方法
8 . 二氯亚砜(SOCl2)是一种无色易挥发液体,与水剧烈水解生成两种气体,常用作脱水剂,其熔点—105℃,沸点79℃,140℃以上时易分解。
(1)用硫黄(用S表示)、液氯和三氧化硫为原料在一定条件合成氯化亚砜,原子利用率达100%,则三者的物质的量比为_______________ 。写出SOCl2吸收水蒸气的化学方程式:_______________________________ 。
(2)甲同学设计下图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略)。
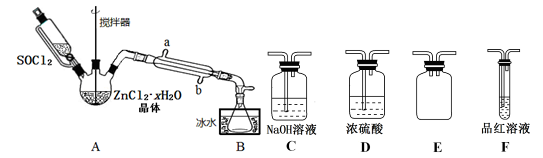
①装置的连接顺序为A→B→____ →___ →___ →____ 。
②冷凝管的进水口是_______________ 。(填“a”或“b”)
③实验结束,为检测ZnCl2·xH2O晶体是否完全脱水,称取蒸干后的固体ag溶于水,加入足量稀硝酸和硝酸银溶液,过滤洗涤干燥,称得固体为bg。若 =
=___ (保留一位小数),即可证明ZnCl2·xH2O晶体已完全脱水。
④乙同学认为直接将ZnCl2·xH2O晶体置于坩埚中加热灼烧即可得到无水ZnCl2,但大家说此方法不行,请解释原因______________________ 。
(3)丙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丁同学认为该实验会发生氧化还原反应。戊同学设计了如下实验方案判断丁同学的观点:取少量FeCl3 •6H2O于试管中,加入SOCl2,振荡使两种物质充分反应;再往试管中加水溶解,滴加KSCN溶液,若没有明显现象,则证明脱水过程中发生了氧化还原反应。按照戊同学的思路方法,还可以选择证明__________ 或______________ (填离子符号)是否存在证明该过程是否发生了氧化还原反应。
(1)用硫黄(用S表示)、液氯和三氧化硫为原料在一定条件合成氯化亚砜,原子利用率达100%,则三者的物质的量比为
(2)甲同学设计下图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略)。

①装置的连接顺序为A→B→
②冷凝管的进水口是
③实验结束,为检测ZnCl2·xH2O晶体是否完全脱水,称取蒸干后的固体ag溶于水,加入足量稀硝酸和硝酸银溶液,过滤洗涤干燥,称得固体为bg。若
 =
=④乙同学认为直接将ZnCl2·xH2O晶体置于坩埚中加热灼烧即可得到无水ZnCl2,但大家说此方法不行,请解释原因
(3)丙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丁同学认为该实验会发生氧化还原反应。戊同学设计了如下实验方案判断丁同学的观点:取少量FeCl3 •6H2O于试管中,加入SOCl2,振荡使两种物质充分反应;再往试管中加水溶解,滴加KSCN溶液,若没有明显现象,则证明脱水过程中发生了氧化还原反应。按照戊同学的思路方法,还可以选择证明
您最近半年使用:0次
解题方法
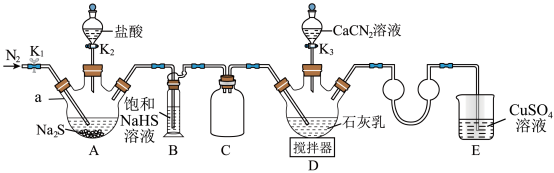
9 . 硫脲[CS(NH2)2]在药物制备、金属矿物浮选等方面有广泛应用。实验室可通过先制备Ca(HS)2,然后Ca(HS)2再与CaCN2合成CS(NH2)2实验装置(夹持及加热装置略)如图所示。回答下列问题:
(1)仪器a的名称是___________ ,装置B中饱和NaHS溶液的作用是___________ 。装置C的作用为___________ 。
(2)检查装置气密性后加入药品,打开K1,通入一段时间N2,目的是___________ ;然后关闭K1,打开K2,待A中反应结束后关闭K2。
(3)撤走搅拌器,水浴加热装置D,打开K3,在80℃条件下合成硫脲,控制温度在80°C的原因是___________ 。待D中反应结束后,关闭K3,打开K1,通入一段时间N2,目的是___________ 。
(4)设计实验证明反应过程中硫脲发生异构化生成了NH4SCN;取少量粗产品于试管中,加入适量蒸馏水溶解,再加入几滴___________ 溶液(填化学式),溶液变为红色,则可证明。
(5)装置E中CuSO4溶液的作用是___________ (用离子方程式表示)。
(6)装置D反应后的液体经分离、提纯、烘干可得产品。测定产品的纯度:称取m g产品,加水溶解配成250mL溶液,取25mL于锥形瓶中,加入稀硫酸酸化,用c mol/L酸性KMnO4标准溶液滴定,滴定至终点时消耗标准溶液V mL(已知滴定时,硫脲转化为CO2、N2和 ,假设杂质不参与反应)。则样品中硫脲的质量分数为
,假设杂质不参与反应)。则样品中硫脲的质量分数为___________ (用含m、c、V的代数式表示)。
(1)仪器a的名称是
(2)检查装置气密性后加入药品,打开K1,通入一段时间N2,目的是
(3)撤走搅拌器,水浴加热装置D,打开K3,在80℃条件下合成硫脲,控制温度在80°C的原因是
(4)设计实验证明反应过程中硫脲发生异构化生成了NH4SCN;取少量粗产品于试管中,加入适量蒸馏水溶解,再加入几滴
(5)装置E中CuSO4溶液的作用是
(6)装置D反应后的液体经分离、提纯、烘干可得产品。测定产品的纯度:称取m g产品,加水溶解配成250mL溶液,取25mL于锥形瓶中,加入稀硫酸酸化,用c mol/L酸性KMnO4标准溶液滴定,滴定至终点时消耗标准溶液V mL(已知滴定时,硫脲转化为CO2、N2和
 ,假设杂质不参与反应)。则样品中硫脲的质量分数为
,假设杂质不参与反应)。则样品中硫脲的质量分数为
您最近半年使用:0次
10-11高二下·河北衡水·阶段练习
解题方法
10 .
(1)菠菜营养丰富,素有“蔬菜之王”之称,在营养价值上是一种高效的补铁剂。某化学小组欲设计实验方案,探究菠菜中是否存在铁元素与草酸及可溶性草酸盐。甲同学查阅资料得知:草酸又名乙二酸,化学式为H2C2O4,是一种二元有机弱酸,具有较强的还原性。甲同学依据上述信息推测,菠菜中铁元素呈____ 价,其理由是____________________ 。甲同学同时设计实验方案,验证其推测是否正确。请简述实验方案_______________________________________ 。
(2)乙炔是有机合成工业的一种原料。工业上曾用 与水反应生成乙炔。
与水反应生成乙炔。
① 中
中 与
与 互为等电子体,
互为等电子体, 的电子式可表示为
的电子式可表示为_______________ ;1mol 中含有的
中含有的 键数目为
键数目为________ 。
②乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是___________________ ;分子中处于同一直线上的原子数目最多为_____ 。
(1)菠菜营养丰富,素有“蔬菜之王”之称,在营养价值上是一种高效的补铁剂。某化学小组欲设计实验方案,探究菠菜中是否存在铁元素与草酸及可溶性草酸盐。甲同学查阅资料得知:草酸又名乙二酸,化学式为H2C2O4,是一种二元有机弱酸,具有较强的还原性。甲同学依据上述信息推测,菠菜中铁元素呈
(2)乙炔是有机合成工业的一种原料。工业上曾用
 与水反应生成乙炔。
与水反应生成乙炔。①
 中
中 与
与 互为等电子体,
互为等电子体, 的电子式可表示为
的电子式可表示为 中含有的
中含有的 键数目为
键数目为②乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是
您最近半年使用:0次



