名校
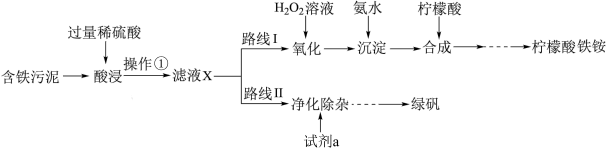
1 . 某实验小组以含铁污泥(主要成分为Fe2O3、FeO、Fe及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾(FeSO4•7H2O)和柠檬酸铁铵。根据所学知识,回答下列问题:
①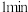 时检验,溶液变红,写出反应的离子方程式
时检验,溶液变红,写出反应的离子方程式___________ 。
②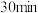 时检验,用离子方程式表示溶液未变红的原因
时检验,用离子方程式表示溶液未变红的原因___________ 。
③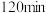 时检验,溶液复又变红,用离子方程式说明原因
时检验,溶液复又变红,用离子方程式说明原因___________ 。
(2)操作①的名称是___________ ,路线I中,加H2O2溶液的目的是(用离子方程式说明)___________ 。
(3)实验室中配制FeSO4溶液时通常需加入少量的试剂a,目的是___________
(4)测定所得硫酸亚铁晶体中 的含量,步骤如下:
的含量,步骤如下:
Ⅰ:称取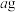 硫酸亚铁晶体样品,配制成
硫酸亚铁晶体样品,配制成 溶液。
溶液。
Ⅱ:取出 溶液,加入适量稀硫酸,滴入
溶液,加入适量稀硫酸,滴入 的
的 溶液,至反应完全共消耗
溶液,至反应完全共消耗 溶液
溶液 。
。
①计算硫酸亚铁晶体样品中 的质量分数
的质量分数___________ 。
②若配置硫酸亚铁溶液出现黄色,则测定结果___________ (填:偏高、偏低、不变)
| 酸浸时间 |  | 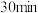 | 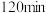 |
| 用KSCN溶液检验 | 变红 | 未变红 | 变红 |
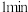 时检验,溶液变红,写出反应的离子方程式
时检验,溶液变红,写出反应的离子方程式②
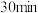 时检验,用离子方程式表示溶液未变红的原因
时检验,用离子方程式表示溶液未变红的原因③
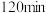 时检验,溶液复又变红,用离子方程式说明原因
时检验,溶液复又变红,用离子方程式说明原因(2)操作①的名称是
(3)实验室中配制FeSO4溶液时通常需加入少量的试剂a,目的是
(4)测定所得硫酸亚铁晶体中
 的含量,步骤如下:
的含量,步骤如下:Ⅰ:称取
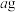 硫酸亚铁晶体样品,配制成
硫酸亚铁晶体样品,配制成 溶液。
溶液。Ⅱ:取出
 溶液,加入适量稀硫酸,滴入
溶液,加入适量稀硫酸,滴入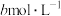 的
的 溶液,至反应完全共消耗
溶液,至反应完全共消耗 溶液
溶液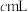 。
。①计算硫酸亚铁晶体样品中
 的质量分数
的质量分数②若配置硫酸亚铁溶液出现黄色,则测定结果
您最近一年使用:0次
解题方法
2 . 某实验小组以含铁污泥(主要成分为Fe2O3、FeO、Fe及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾(FeSO4•7H2O)和柠檬酸铁铵。
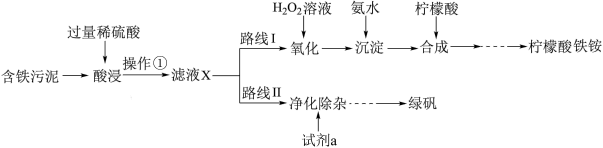
根据所学知识,回答下列问题:
(1)操作①的名称是_______ ,路线I中,加入H2O2溶液的目的是_______ 。
(2)写出“酸浸”时,Fe2O3与硫酸反应的化学方程式:_______ ;检验含有Fe3+的试剂是_______ 。
(3)实验室中配制FeSO4溶液时通常需加入少量的试剂a,目的是_______ 。
(4)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:_______ 。
(5)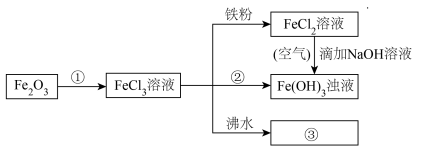
FeCl2溶液→Fe(OH)3浊液的过程中,观察到的实验现象是_______ 。

根据所学知识,回答下列问题:
(1)操作①的名称是
(2)写出“酸浸”时,Fe2O3与硫酸反应的化学方程式:
(3)实验室中配制FeSO4溶液时通常需加入少量的试剂a,目的是
(4)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:
(5)

FeCl2溶液→Fe(OH)3浊液的过程中,观察到的实验现象是
您最近一年使用:0次
解题方法
3 . 某实验小组以含铁污泥(主要成分为Fe2O3、FeO、Fe及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾(FeSO4•7H2O)和柠檬酸铁铵。
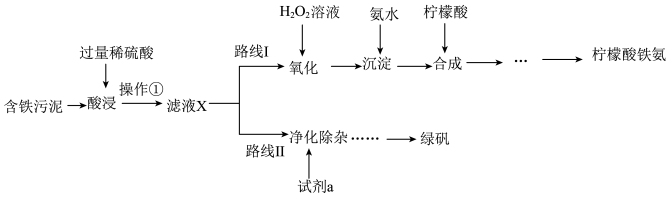
根据所学知识,回答下列问题:
(1)操作①的名称______ ,路线I中,加入H2O2溶液的目的是______ 。
(2)写出“酸浸”时,Fe2O3与硫酸反应的化学方程式:______ ;检验含有Fe3+的方法是______ 。
(3)“滤液X”中一定含有的阳离子为_______ 。
(4)实验室中配制FeSO4溶液时通常需加入少量的试剂a,目的是_____ ,请写出相应的离子方程式:______ 。

根据所学知识,回答下列问题:
(1)操作①的名称
(2)写出“酸浸”时,Fe2O3与硫酸反应的化学方程式:
(3)“滤液X”中一定含有的阳离子为
(4)实验室中配制FeSO4溶液时通常需加入少量的试剂a,目的是
您最近一年使用:0次
名校
4 . 二氯亚砜(SOCl2)是一种无色易挥发液体,剧烈水解生成两种气体,常用作脱水剂,其熔点为-105℃,沸点为79℃,140℃以上时易分解。并且Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为4Li+2SOC12=4LiCl+S+SO2。
(1)组装该电池必须在无水、无氧的条件下进行,原因是______________________ 。
(2)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,反应的化学方程式为______________________ 。用硫黄(S)、液氯和三氧化硫为原料在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量之比为___________ 。
(3)甲同学设计如图所示的装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并利用装置F验证生成物中的某种气体(夹持及加热装置略)。
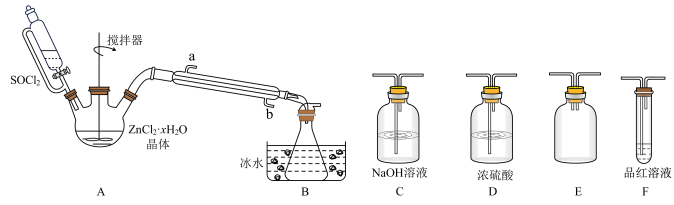
①用原理解释SOCl2在该实验中的作用:_________________________________ 。
②装置的连接顺序为A→B→______________________ 。
③实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为___________ (填序号)。
a.加入足量硝酸酸化的硝酸银溶液,充分反应 b.称得固体为n克
c.干燥 d.称取蒸干后的固体m克溶于水
e.过滤 f.洗涤
(4)乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。
①可能发生的副反应的离子方程式为_________________________________ 。
②两同学设计了如下实验方案判断副反应的可能性:
i.取少量FeCl3·6H2O于试管中,加入足量SOCl2,振荡使两种物质充分反应;
ii.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。
(供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、BaCl2溶液、K3[Fe(CN)6]溶液、溴水)
(1)组装该电池必须在无水、无氧的条件下进行,原因是
(2)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,反应的化学方程式为
(3)甲同学设计如图所示的装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并利用装置F验证生成物中的某种气体(夹持及加热装置略)。

①用原理解释SOCl2在该实验中的作用:
②装置的连接顺序为A→B→
③实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为
a.加入足量硝酸酸化的硝酸银溶液,充分反应 b.称得固体为n克
c.干燥 d.称取蒸干后的固体m克溶于水
e.过滤 f.洗涤
(4)乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。
①可能发生的副反应的离子方程式为
②两同学设计了如下实验方案判断副反应的可能性:
i.取少量FeCl3·6H2O于试管中,加入足量SOCl2,振荡使两种物质充分反应;
ii.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。
(供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、BaCl2溶液、K3[Fe(CN)6]溶液、溴水)
| 方案 | 操作 | 现象 | 结论 |
| 方案一 | 往一支试管中滴加 | 若有白色沉淀生成 | 则发生了上述副反应 |
| 方案二 | 往另一支试管中滴加 | 则没有发生上述副反应 |
您最近一年使用:0次
2019-03-07更新
|
855次组卷
|
2卷引用:江西省景德镇一中2020-2021学年高一上学期期中考试化学(1班)试题
名校
解题方法
5 . 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”。由化学手册查阅得有关物质的熔、沸点数据如表。
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,你认为他的解释是否合理___________ (填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是___________ ,反应的离子方程式为___________ 。
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:
取一块该熔融物冷却后投入到少量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有Fe2O3.则物质甲是___________ (填化学式)。该同学的实验方案是否合理?___________ (填“合理”或“不合理”)。理由:___________ 。
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1460 |
| 沸点/℃ | 2467 | 2980 | 2750 |
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:
取一块该熔融物冷却后投入到少量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有Fe2O3.则物质甲是
您最近一年使用:0次
6 . Ⅰ.钠、铝、铁是三种重要的金属,它们的单质及其化合物在生活生产中有重要的作用。请回答下列问题:
(1)钠着火不能用二氧化碳来灭火,已知钠在足量二氧化碳中燃烧生成炭黑和一种白色固体。根据实验现象写出方程式:_______ ,该反应中氧化剂和还原剂的物质的量之比为______ 。
Ⅱ.一些活泼金属也可作还原剂,将相对不活泼的金属从其化合物中置换出来。例如“铝热反应”的原理是: 。其反应装置如下图所示,已知镁条与氯酸钾反应产生高温可引发“铝热反应”。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入装有沙子的蒸发皿中”。由化学手册查阅得有关物质的熔、沸点数据如下表。
。其反应装置如下图所示,已知镁条与氯酸钾反应产生高温可引发“铝热反应”。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入装有沙子的蒸发皿中”。由化学手册查阅得有关物质的熔、沸点数据如下表。
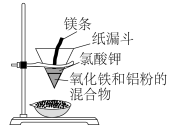
(2)该同学推测,铝热反应所得到的熔融物可能是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_____ (填化学式),该试剂与金属铝反应的离子方程式为_______ 。
(3)另一同学推测铝热反应得到的熔融物中还含有 ,他设计了如下方案来验证熔融物是否有
,他设计了如下方案来验证熔融物是否有 剩余:取一块该熔融物冷却后投入到稍过量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有
剩余:取一块该熔融物冷却后投入到稍过量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有 。则物质甲是
。则物质甲是_______ (填化学式)。该同学的实验方案是否合理?______ (填“合理”或“不合理”)。理由:_______ (用离子方程式说明)。
(1)钠着火不能用二氧化碳来灭火,已知钠在足量二氧化碳中燃烧生成炭黑和一种白色固体。根据实验现象写出方程式:
Ⅱ.一些活泼金属也可作还原剂,将相对不活泼的金属从其化合物中置换出来。例如“铝热反应”的原理是:
 。其反应装置如下图所示,已知镁条与氯酸钾反应产生高温可引发“铝热反应”。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入装有沙子的蒸发皿中”。由化学手册查阅得有关物质的熔、沸点数据如下表。
。其反应装置如下图所示,已知镁条与氯酸钾反应产生高温可引发“铝热反应”。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入装有沙子的蒸发皿中”。由化学手册查阅得有关物质的熔、沸点数据如下表。
| 物质 | Al |  | Fe |  |
| 熔点/℃ | 660 | 2054 | 1535 | 1460 |
| 沸点/℃ | 2467 | 2980 | 2750 |
(2)该同学推测,铝热反应所得到的熔融物可能是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是
(3)另一同学推测铝热反应得到的熔融物中还含有
 ,他设计了如下方案来验证熔融物是否有
,他设计了如下方案来验证熔融物是否有 剩余:取一块该熔融物冷却后投入到稍过量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有
剩余:取一块该熔融物冷却后投入到稍过量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有 。则物质甲是
。则物质甲是
您最近一年使用:0次
2024-01-14更新
|
166次组卷
|
2卷引用:辽宁省部分高中2023-2024学年高一上学期期末考试高化学试题
7 . 金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。请回答下列问题
(1)31号元素镓(Ga)与铝同族。镓(Ga)在周期表的位置是___________ ;写出镓的氯化物和氨水反应的化学方程式___________ 。铍、铝二者的单质、化合物均具有相似的化学性质,写出BeCl2溶液与Na2BeO2的水溶液混合的化学方程式___________ 。
(2)人类最早使用的金属材料的主要成分是铜。下列有关铜元素的说法中,不正确的是___________(填字母)
(3)在稀 溶液中加入适量
溶液中加入适量 溶液至
溶液至 恰好完全沉淀,此时铝元素的存在形式主要为
恰好完全沉淀,此时铝元素的存在形式主要为___________ (用化学式表示)。
(4)某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”。由化学手册查阅得有关物质的熔、沸点数据如表。
①该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,你认为他的解释是否合理___________ (填“合理”或“不合理”)。
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所涉及的反应的离子方程式为___________ 。
③另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:取一块该熔融物冷却后投入到少量稀硫酸中,向反应后的混合液中滴加KSCN溶液,观察到溶液颜色未变红,证明该熔融物中不含有Fe2O3.该同学的实验方案是否合理?___________ (填“合理”或“不合理”)。理由:___________ 。
(1)31号元素镓(Ga)与铝同族。镓(Ga)在周期表的位置是
(2)人类最早使用的金属材料的主要成分是铜。下列有关铜元素的说法中,不正确的是___________(填字母)
| A.青铜、不锈钢、硬铝都是合金 |
| B.铜表面易形成致密的氧化膜 |
| C.铜与O2反应生成黑色的CuO |
| D.CuSO4·5H2O是一种混合物,加热后变为白色固体 |
 溶液中加入适量
溶液中加入适量 溶液至
溶液至 恰好完全沉淀,此时铝元素的存在形式主要为
恰好完全沉淀,此时铝元素的存在形式主要为(4)某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”。由化学手册查阅得有关物质的熔、沸点数据如表。
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1460 |
| 沸点/℃ | 2467 | 2980 | 2750 |
①该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,你认为他的解释是否合理
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所涉及的反应的离子方程式为
③另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:取一块该熔融物冷却后投入到少量稀硫酸中,向反应后的混合液中滴加KSCN溶液,观察到溶液颜色未变红,证明该熔融物中不含有Fe2O3.该同学的实验方案是否合理?
您最近一年使用:0次
8 . 一定条件下,铁与空气接触时表面会形成氧化物,如一块低碳钢可以被三种氧化物膜所覆盖:与金属接触的一侧是FeO,中间是 ,与空气接触的一侧则是
,与空气接触的一侧则是 。回答下列问题:
。回答下列问题:
(1) 是磁铁矿的主要成分,也是中国古代“四大发明”之一“司南”的指针材料。用Al粉和
是磁铁矿的主要成分,也是中国古代“四大发明”之一“司南”的指针材料。用Al粉和 反应焊接钢轨的化学方程式为
反应焊接钢轨的化学方程式为_______ 。
(2)FeO可以合成补铁剂 。欲验证
。欲验证 超过保质期后已变质,可进行的操作是:取定量样品加水溶解静置、取少许溶液于试管中,向其中加入
超过保质期后已变质,可进行的操作是:取定量样品加水溶解静置、取少许溶液于试管中,向其中加入_______ 溶液(填试剂名称),若液体出现红色,则证明该药物已变质。
(3)某实验小组设计了如下实验步骤,利用部分变质的废弃 溶液制备
溶液制备 。
。

框图中热空气的作用为_______ ,写出a→b的离子方程式_______ ,写出 的一种用途:
的一种用途:_______ 。
 ,与空气接触的一侧则是
,与空气接触的一侧则是 。回答下列问题:
。回答下列问题:(1)
 是磁铁矿的主要成分,也是中国古代“四大发明”之一“司南”的指针材料。用Al粉和
是磁铁矿的主要成分,也是中国古代“四大发明”之一“司南”的指针材料。用Al粉和 反应焊接钢轨的化学方程式为
反应焊接钢轨的化学方程式为(2)FeO可以合成补铁剂
 。欲验证
。欲验证 超过保质期后已变质,可进行的操作是:取定量样品加水溶解静置、取少许溶液于试管中,向其中加入
超过保质期后已变质,可进行的操作是:取定量样品加水溶解静置、取少许溶液于试管中,向其中加入(3)某实验小组设计了如下实验步骤,利用部分变质的废弃
 溶液制备
溶液制备 。
。
框图中热空气的作用为
 的一种用途:
的一种用途:
您最近一年使用:0次
名校
解题方法
9 . Ⅰ.铁是生产、生活及生命中的重要元素。
(1)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合的能力。药品美蓝是其有效的解毒剂,解毒时美蓝发生___________ (填“氧化”或“还原”)反应。
(2)现有一瓶放置了一段时间的某浓度的FeCl2溶液,请设计实验检验其中是否含有Fe3+:___________ 。
(3)普通铁粉与水蒸气在高温下反应生成铁的某种氧化物和氢气,该氧化物和氢气在高温下发生逆反应得到“引火铁”。若一定量的普通铁粉和水蒸气在高温下反应生成44.8 L H2(已换算到标况下),则转移电子数目为___________ ;“引火铁”是一种极细的铁粉,它在空气中可以自燃,其原因是___________ 。
Ⅱ.化合物M是某种具有磁学性质的新型电子材料的主要成分,由两种元素组成。为了研究其组成,设计如下实验:

气体甲可使湿润红色石蕊试纸变蓝。请回答:
(4)M的化学式为___________ 。
(5)白色沉淀乙在空气中变成红褐色沉淀丙的原因是(用化学方程式表示)___________ 。
(6)高温条件下,丁与甲反应生成两种单质和水,该反应的化学方程式为___________ 。
(1)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合的能力。药品美蓝是其有效的解毒剂,解毒时美蓝发生
(2)现有一瓶放置了一段时间的某浓度的FeCl2溶液,请设计实验检验其中是否含有Fe3+:
(3)普通铁粉与水蒸气在高温下反应生成铁的某种氧化物和氢气,该氧化物和氢气在高温下发生逆反应得到“引火铁”。若一定量的普通铁粉和水蒸气在高温下反应生成44.8 L H2(已换算到标况下),则转移电子数目为
Ⅱ.化合物M是某种具有磁学性质的新型电子材料的主要成分,由两种元素组成。为了研究其组成,设计如下实验:

气体甲可使湿润红色石蕊试纸变蓝。请回答:
(4)M的化学式为
(5)白色沉淀乙在空气中变成红褐色沉淀丙的原因是(用化学方程式表示)
(6)高温条件下,丁与甲反应生成两种单质和水,该反应的化学方程式为
您最近一年使用:0次



