1 . 根据下列装置图,回答有关问题:___________ ,该反应为可逆反应,其离子方程式为___________ 。
(2)装置乙中,直流电源a为___________ 极(填“正”或“负”),阳极反应式为___________ 。
(3)装置丙中,d试管内铁钉除发生化学腐蚀外,还发生了___________ (填“析氢腐蚀”或“吸氧腐蚀”),其腐蚀速率比c试管中铁钉的腐蚀速率___________ (“快”“慢”或“相等”),c试管内正极的电极反应式为___________ 。
(4)装置丁中,从交换膜右侧向左侧迁移的离子是___________ ,负极的电极反应式为___________ 。
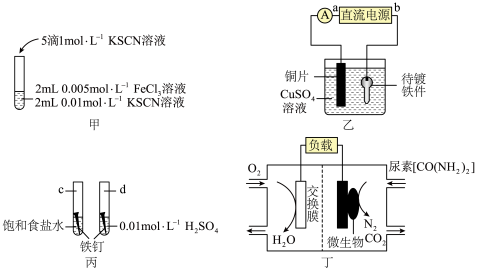
(2)装置乙中,直流电源a为
(3)装置丙中,d试管内铁钉除发生化学腐蚀外,还发生了
(4)装置丁中,从交换膜右侧向左侧迁移的离子是
您最近一年使用:0次
名校
解题方法
2 . 根据要求完成下列方程式。
(1)K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,其光解反应的化学方程式为:2K3[Fe(C2O4)3] 2FeC2O4 +3K2C2O4 +2CO2↑。
2FeC2O4 +3K2C2O4 +2CO2↑。
①草酸亚铁在隔绝空气的条件下加热会分解,可以制得黑色粉末状的氧化亚铁,写出该反应的化学方程式___________ 。
②氢氧化亚铁的制备过程中要注意隔绝空气,否则白色沉淀会迅速转化为灰绿色,最后得到红褐色物质,写出该转化过程的化学方程式___________ 。
③高铁酸钠是新型的净水剂,在强碱中氢氧化铁可以被氯气氧化生成紫色的高铁酸根,完成该反应的离子方程式___________ 。
(2)黄血盐(K4[Fe(CN)6] )是合法的食品添加剂,用作抗结剂;黄血盐在溶液中遇到Fe3+ ,生成普鲁士蓝沉淀。
①铊是一种剧毒化学品,若出现了中毒症状,应立即就医,在医学上,医生通常建议中毒者服用一种可溶性普鲁士蓝(KFe[Fe(CN)6])解毒,Tl+ 与K+ 性质接近,铊可置换普鲁士兰中的钾后,形成不溶性物质,随粪便排出,对治疗经口急慢性铊中毒有一定疗效,写出解铊毒反应的离子方程式___________ 。
②无水黄血盐可被浓硫酸分解,生成三种常见的盐和一种常见的无色无味气体,分析完成该反应的化学方程式___________ 。(提示:反应中价态不变)
(3)基于生成滕氏蓝的化学反应原理发展起来的晒制蓝图技术在复印机诞生之前广泛用于工程图纸的复制。赤血盐溶液遇到Fe2+ ,可以生成蓝色的滕氏蓝沉淀,写出得到滕氏蓝沉淀反应的离子方程式___________ 。(已知:氯气遇到黄血盐可以得到赤血盐)
(1)K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,其光解反应的化学方程式为:2K3[Fe(C2O4)3]
 2FeC2O4 +3K2C2O4 +2CO2↑。
2FeC2O4 +3K2C2O4 +2CO2↑。①草酸亚铁在隔绝空气的条件下加热会分解,可以制得黑色粉末状的氧化亚铁,写出该反应的化学方程式
②氢氧化亚铁的制备过程中要注意隔绝空气,否则白色沉淀会迅速转化为灰绿色,最后得到红褐色物质,写出该转化过程的化学方程式
③高铁酸钠是新型的净水剂,在强碱中氢氧化铁可以被氯气氧化生成紫色的高铁酸根,完成该反应的离子方程式
(2)黄血盐(K4[Fe(CN)6] )是合法的食品添加剂,用作抗结剂;黄血盐在溶液中遇到Fe3+ ,生成普鲁士蓝沉淀。
①铊是一种剧毒化学品,若出现了中毒症状,应立即就医,在医学上,医生通常建议中毒者服用一种可溶性普鲁士蓝(KFe[Fe(CN)6])解毒,Tl+ 与K+ 性质接近,铊可置换普鲁士兰中的钾后,形成不溶性物质,随粪便排出,对治疗经口急慢性铊中毒有一定疗效,写出解铊毒反应的离子方程式
②无水黄血盐可被浓硫酸分解,生成三种常见的盐和一种常见的无色无味气体,分析完成该反应的化学方程式
(3)基于生成滕氏蓝的化学反应原理发展起来的晒制蓝图技术在复印机诞生之前广泛用于工程图纸的复制。赤血盐溶液遇到Fe2+ ,可以生成蓝色的滕氏蓝沉淀,写出得到滕氏蓝沉淀反应的离子方程式
您最近一年使用:0次
3 . 离子方程式能够体现反应的实质。写出下列反应的离子方程式。
(1)钠投入水中___________ 。
(2)NO2通入水中___________ 。
(3)铜片投入氯化铁溶液中___________ 。
(4)氯气通入稀NaOH溶液中___________ 。
(1)钠投入水中
(2)NO2通入水中
(3)铜片投入氯化铁溶液中
(4)氯气通入稀NaOH溶液中
您最近一年使用:0次
4 . 铁及其化合物在日常生产生活中应用广泛,研究意义重大。
(1)医疗上流行的“理疗特效热”,是利用铁缓慢氧化放出均匀、稳定的热,使患处保持温热状态。若56g铁粉完全被氧化成氧化铁,则需要消耗标况下氧气的体积为___________ L。
(2)当人体缺铁时,往往需要吃补铁保健品。人体能够吸收的是+2价的铁,但是+2价的铁很容易被氧化。检验某固体补铁剂中铁元素已被氧化的实验方法及结论为___________ 。
(3)氯化铁的用途之一是五金蚀刻,蚀刻产品有眼镜架、钟表、电子元件和不锈钢标牌等。氯化铁溶液蚀刻不锈钢时发生的主要反应的离子方程式为___________ 。
(4)高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理。湿法制备高铁酸钠反应体系中有六种微粒:Fe3+、ClO-、OH-、 、Cl-、H2O,则湿法制高铁酸钠的离子反应方程式为
、Cl-、H2O,则湿法制高铁酸钠的离子反应方程式为___________ ,该反应中,被氧化的元素是___________ (填元素符号),氧化剂是___________ (填化学式),生成lmol高铁酸钠时,转移电子的物质的量为___________ mol。
(1)医疗上流行的“理疗特效热”,是利用铁缓慢氧化放出均匀、稳定的热,使患处保持温热状态。若56g铁粉完全被氧化成氧化铁,则需要消耗标况下氧气的体积为
(2)当人体缺铁时,往往需要吃补铁保健品。人体能够吸收的是+2价的铁,但是+2价的铁很容易被氧化。检验某固体补铁剂中铁元素已被氧化的实验方法及结论为
(3)氯化铁的用途之一是五金蚀刻,蚀刻产品有眼镜架、钟表、电子元件和不锈钢标牌等。氯化铁溶液蚀刻不锈钢时发生的主要反应的离子方程式为
(4)高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理。湿法制备高铁酸钠反应体系中有六种微粒:Fe3+、ClO-、OH-、
 、Cl-、H2O,则湿法制高铁酸钠的离子反应方程式为
、Cl-、H2O,则湿法制高铁酸钠的离子反应方程式为
您最近一年使用:0次
名校
解题方法
5 . 某小组同学分别探究FeCl2溶液、FeCl3溶液的性质。
I.探究FeCl2溶液的性质。
(1)从物质类别角度判断FeCl2属于___________ ,因此可以与某些碱反应。
(2)预测FeCl2具有氧化性,因此可以与Zn反应,此时Zn体现___________ 性。
(3)预测FeCl2具有还原性,预测依据是___________ ,因此可以与酸性KMnO4溶液反应。
(4)进行如下实验操作:
①i中的现象是___________ ,用化学方程式表示产生该现象的原因:___________ 、___________ 。
②ii中反应的离子方程式是___________ 。
③iii中的现象是___________ 。
(5)某同学认为iii中现象并不能证明Fe2+具有还原性,他的理由有二:①将酸性高锰酸钾稀释也可能产生该现象、②___________ , 为证实该反应中Fe2+确实被氧化,需要在反应后的溶液中加入试剂___________ ,观察到现象___________ 。
II.探究FeCl3溶液的性质。
小组同学进行如下实验操作并观察到对应现象:
(6)iv中反应的离子方程式是___________ 。
(7)vi 中滴加氯水过程中,氯水反应的离子方程式是___________ 。
III.小组同学探究vi中褪色原因,提出两种假设: a.铁离子被转化,b. SCN被转化。
(8)分别向褪色后的溶液中滴加0.1 mol/L FeCl3溶液和KSCN溶液各1滴,观察到___________ 现象,得出结论:假设b成立。
(9)进一步预测SCN-可能被转化为SO ,通过实验验证了该预测,写出实验操作及现象
,通过实验验证了该预测,写出实验操作及现象___________ 。
I.探究FeCl2溶液的性质。
(1)从物质类别角度判断FeCl2属于
(2)预测FeCl2具有氧化性,因此可以与Zn反应,此时Zn体现
(3)预测FeCl2具有还原性,预测依据是
(4)进行如下实验操作:
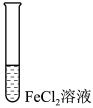 | 序号 | 操作 |
| i | 滴加NaOH溶液 | |
| ii | 加入少量锌粉 | |
| iii | 滴加酸性KMnO4溶液 |
②ii中反应的离子方程式是
③iii中的现象是
(5)某同学认为iii中现象并不能证明Fe2+具有还原性,他的理由有二:①将酸性高锰酸钾稀释也可能产生该现象、②
II.探究FeCl3溶液的性质。
小组同学进行如下实验操作并观察到对应现象:
| 操作 | 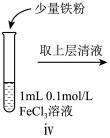 |  | 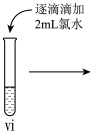 |
| 现象 | 溶液由棕黄色变为浅绿色 | 无明显现象 | 溶液变为红色, 而后红色褪去 |
(7)vi 中滴加氯水过程中,氯水反应的离子方程式是
III.小组同学探究vi中褪色原因,提出两种假设: a.铁离子被转化,b. SCN被转化。
(8)分别向褪色后的溶液中滴加0.1 mol/L FeCl3溶液和KSCN溶液各1滴,观察到
(9)进一步预测SCN-可能被转化为SO
 ,通过实验验证了该预测,写出实验操作及现象
,通过实验验证了该预测,写出实验操作及现象
您最近一年使用:0次
2022-01-12更新
|
721次组卷
|
5卷引用:河南省郑州市第七高级中学2023-2024学年高一上学期12月考试化学试题
河南省郑州市第七高级中学2023-2024学年高一上学期12月考试化学试题北京市昌平区2021-2022学年高一上学期期末考试化学试题 (已下线)3.1.2 铁盐和亚铁盐-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)广东省广州市第二中学2022-2023学年高一上学期12月月考化学试题9.2.1反应的合理选择(课后)-2019苏教版必修2课前课中课后



