名校
解题方法
1 . 为探究 溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
(1)配制:50 mL 1.0 mol⋅L-1的 溶液,测其pH约为0.7,即
溶液,测其pH约为0.7,即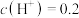 mol⋅L-1。用离子方程式解释
mol⋅L-1。用离子方程式解释 溶液呈酸性的原因:
溶液呈酸性的原因:___________ 。
(2)小组同学利用上述 溶液探究其与足量锌粉的反应。实验操作及现象如表:
溶液探究其与足量锌粉的反应。实验操作及现象如表:
已知:Zn的性质与Al相似,能发生反应:
①红褐色沉淀是:___________ (填化学式),结合实验现象和平衡移动原理解释出现红褐色沉淀的原因:___________ 。
②反应后溶液为浅绿色,写出相关反应的离子方程式:___________ 。
③分离出黑色固体,经下列实验证实了其中含有的主要物质。
ⅰ.黑色固体可以被磁铁吸引;
ⅱ.向黑色固体中加入足量的NaOH溶液,产生气泡;
ⅲ.将ⅱ中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
ⅳ.向ⅲ反应后的溶液中滴加KSCN溶液,无变化。
a.黑色固体中一定含有的物质是___________ 。
b.小组同学认为上述实验无法确定黑色固体中是否含有 ,理由是
,理由是___________ 。
(3)为进一步探究上述1.0 mol⋅L-1 溶液中
溶液中 和
和 氧化性的相对强弱,继续实验并观察到反应开始时现象如表:
氧化性的相对强弱,继续实验并观察到反应开始时现象如表:
小组同学得出结论:在1.0 mol⋅L-1  溶液中,
溶液中, 的氧化性比
的氧化性比 更强。
更强。
 溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
溶液中的离子平衡和离子反应,某小组同学进行了如下实验。(1)配制:50 mL 1.0 mol⋅L-1的
 溶液,测其pH约为0.7,即
溶液,测其pH约为0.7,即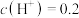 mol⋅L-1。用离子方程式解释
mol⋅L-1。用离子方程式解释 溶液呈酸性的原因:
溶液呈酸性的原因:(2)小组同学利用上述
 溶液探究其与足量锌粉的反应。实验操作及现象如表:
溶液探究其与足量锌粉的反应。实验操作及现象如表:| 操作 | 现象 |
向反应瓶中加入6.5 g锌粉,然后加入50 mL 1.0 mol·L 的 的 溶液,搅拌 溶液,搅拌 | 溶液温度迅速上升,稍后出现红褐色沉淀,同时出现少量气泡;反应一段时间后静置,上层溶液为浅绿色,反应瓶底部有黑色固体 |
| 收集检验反应过程中产生的气体 | 集气管口靠近火焰,有爆鸣声 |

①红褐色沉淀是:
②反应后溶液为浅绿色,写出相关反应的离子方程式:
③分离出黑色固体,经下列实验证实了其中含有的主要物质。
ⅰ.黑色固体可以被磁铁吸引;
ⅱ.向黑色固体中加入足量的NaOH溶液,产生气泡;
ⅲ.将ⅱ中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
ⅳ.向ⅲ反应后的溶液中滴加KSCN溶液,无变化。
a.黑色固体中一定含有的物质是
b.小组同学认为上述实验无法确定黑色固体中是否含有
 ,理由是
,理由是(3)为进一步探究上述1.0 mol⋅L-1
 溶液中
溶液中 和
和 氧化性的相对强弱,继续实验并观察到反应开始时现象如表:
氧化性的相对强弱,继续实验并观察到反应开始时现象如表:| 操作 | 现象 |
将5 mL 1.0 mol⋅L-1的 溶液与0.65 g锌粉混合 溶液与0.65 g锌粉混合 | 溶液温度迅速上升,开始时几乎没有气泡 |
| 将 | 溶液中立即产生大量气泡 |
 溶液中,
溶液中, 的氧化性比
的氧化性比 更强。
更强。
您最近一年使用:0次
解题方法
2 . 化学小组同学通过实验探究某补铁药品中含亚铁盐,实验过程如下:
(1)甲同学取少量溶液,先加入2滴 溶液,溶液无明显变化;再加入几滴新制氯水,溶液变红。氯水与亚铁盐反应的离子方程式为
溶液,溶液无明显变化;再加入几滴新制氯水,溶液变红。氯水与亚铁盐反应的离子方程式为__________ 。
(2)乙同学也取少量溶液,滴加 溶液,有沉淀生成;将其露置于空气中可观察到的现象是
溶液,有沉淀生成;将其露置于空气中可观察到的现象是__________ ;产生该现象原因是__________ (用化学方程式解释)。
(3)丙同学取少量甲同学实验后的溶液,加入过量铁粉,溶液红色又消失。此实验能证明的是__________ 。
(1)甲同学取少量溶液,先加入2滴
 溶液,溶液无明显变化;再加入几滴新制氯水,溶液变红。氯水与亚铁盐反应的离子方程式为
溶液,溶液无明显变化;再加入几滴新制氯水,溶液变红。氯水与亚铁盐反应的离子方程式为(2)乙同学也取少量溶液,滴加
 溶液,有沉淀生成;将其露置于空气中可观察到的现象是
溶液,有沉淀生成;将其露置于空气中可观察到的现象是(3)丙同学取少量甲同学实验后的溶液,加入过量铁粉,溶液红色又消失。此实验能证明的是
您最近一年使用:0次
3 . 书写方程式:
(1)检验Fe3+的离子方程式:___________ 。
(2)氯化铝溶液中加氨水的离子方程式:___________ 。
(3)除去Fe2O3中的Al2O3,可以选用的试剂是:___________ ,反应的离子方程式是___________ 。
(4)打磨过的铝条与NaOH反应的离子方程式:___________ 。
(1)检验Fe3+的离子方程式:
(2)氯化铝溶液中加氨水的离子方程式:
(3)除去Fe2O3中的Al2O3,可以选用的试剂是:
(4)打磨过的铝条与NaOH反应的离子方程式:
您最近一年使用:0次
名校
解题方法
4 . 请按要求回答下列问题:
(1)按照物质的分类方法, 应属于
应属于___________ (填序号)。
①酸②氯化物③混合物④盐⑤化合物⑥电解质
(2)写出 在水中的电离方程式
在水中的电离方程式___________ 。
(3)铁元素是人体内一种微量元素,主要以Fe2+的形式存在。请回答下列问题:
①下列微粒中,既有氧化性又有还原性的是___________ (填字母)。
A.Fe B.Fe2+ C.Fe3+
②维生素C可使食物中的Fe3+转化为Fe2+,在此过程中___________ 是还原剂
③某种麦片中含有微量的细小铁粉,食用该麦片后,铁粉与胃酸反应的离子方程式是___________ 。
④含硫酸亚铁的药片可治疗缺铁性贫血,可用___________ 溶液检验该硫酸亚铁药片是否变质。
(1)按照物质的分类方法,
 应属于
应属于①酸②氯化物③混合物④盐⑤化合物⑥电解质
(2)写出
 在水中的电离方程式
在水中的电离方程式(3)铁元素是人体内一种微量元素,主要以Fe2+的形式存在。请回答下列问题:
①下列微粒中,既有氧化性又有还原性的是
A.Fe B.Fe2+ C.Fe3+
②维生素C可使食物中的Fe3+转化为Fe2+,在此过程中
③某种麦片中含有微量的细小铁粉,食用该麦片后,铁粉与胃酸反应的离子方程式是
④含硫酸亚铁的药片可治疗缺铁性贫血,可用
您最近一年使用:0次
名校
解题方法
5 . 化学是一门实用性很强的科学,请根据题意填空:
(1)铝合金和碳纤维复合材料是飞机、火箭的常用材料,这主要利用了它们具有的共同性能是密度___________ (填“大”或“小”),铝的在地壳中的含量比铁___________ (填“多”或“少”)。
(2)铝制餐具不宜长时间存放酸性、碱性食物,说明Al2O3属于___________ 氧化物,写出氧化铝与NaOH溶液反应的离子反应方程式___________ 。
(3)面粉发酵时会产生有机酸(用HA表示其化学式),影响口感。我们可以加入膨松剂(主要含NaHCO3),那么蒸出来的馒头蓬松柔软,且口感好。若加入过量的膨松剂,请写出相关反应的化学方程式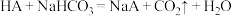 ,
,___________ ,由以上反应可知,酸性HA___________ H2CO3。
(4)电子工业用FeCl3溶液制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:___________ ,某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:首先取少量待测溶液﹐滴入___________ (填写试剂的名称)溶液呈红色,则溶液中含有的Fe3+,另取50.0mL待测溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、洗涤、干燥,称量沉淀质量为43.05g,则待测液中Cl-的物质的量浓度为___________ 。
(1)铝合金和碳纤维复合材料是飞机、火箭的常用材料,这主要利用了它们具有的共同性能是密度
(2)铝制餐具不宜长时间存放酸性、碱性食物,说明Al2O3属于
(3)面粉发酵时会产生有机酸(用HA表示其化学式),影响口感。我们可以加入膨松剂(主要含NaHCO3),那么蒸出来的馒头蓬松柔软,且口感好。若加入过量的膨松剂,请写出相关反应的化学方程式
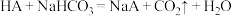 ,
,(4)电子工业用FeCl3溶液制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
您最近一年使用:0次
名校
解题方法
6 . 按要求书写化学方程式或离子方程式。
(1)除去氯化亚铁溶液中的氯化铁杂质,相应的离子方程式为___________ 。
(2)工业上用FeCl3溶液腐蚀铜线路板,相应的离子方程式为___________ 。
(3)浓硫酸和铜反应,相应的化学方程式为___________ 。
(4)Fe(OH)2在空气中被氧化,相应的化学方程式为___________ 。
(5)SO2能使氯水褪色,相应的离子方程式为___________ 。
(1)除去氯化亚铁溶液中的氯化铁杂质,相应的离子方程式为
(2)工业上用FeCl3溶液腐蚀铜线路板,相应的离子方程式为
(3)浓硫酸和铜反应,相应的化学方程式为
(4)Fe(OH)2在空气中被氧化,相应的化学方程式为
(5)SO2能使氯水褪色,相应的离子方程式为
您最近一年使用:0次
7 . 铁元素在地壳中含量居于第四位。铁是目前产量最大,使用最广泛的金属。我国目前发现最早的人工冶铁制品是河南三门峡出土的西周晚期的玉柄铁剑。
(1)在钢铁厂的生产中,炽热的铁水或钢水注入模具之前必须进行充分的干燥处理,不得留有水,请用化学方程式解释_______ 。
(2)铁是人体必需微量元素中含量最多的一种。当人体贫血时,可以服用含FeSO4的补血剂,搭配维C效果更好,维C在这个过程中的作用是做_______ 剂。
(3)电子工业中常用FeCl3溶液作为“腐蚀液”腐蚀覆铜板。为了检验反应后所得混合溶液中还有Fe3+,可选择下列试剂中的_______ (填编号)进行检验。
A.KSCN 溶液 B.酸性 KMnO4溶液 C.新制氯水
(4)高铁酸钠 是一种新型绿色消毒剂,其一种制备原理如下: _______
是一种新型绿色消毒剂,其一种制备原理如下: _______ _______
_______ _______=_______
_______=_______ _______
_______ _______
_______
①请将方程式补充完整并配平该方程式_______ 。
②氧化剂和还原剂个数之比为:_______ 。
(5)干法制备高铁酸钾的主要反应为: 。该反应中的还原剂是
。该反应中的还原剂是_______ ,每生成0.5mol Na2FeO4转移_______ 个电子(阿伏加德罗常数的值用NA表示)。
(1)在钢铁厂的生产中,炽热的铁水或钢水注入模具之前必须进行充分的干燥处理,不得留有水,请用化学方程式解释
(2)铁是人体必需微量元素中含量最多的一种。当人体贫血时,可以服用含FeSO4的补血剂,搭配维C效果更好,维C在这个过程中的作用是做
(3)电子工业中常用FeCl3溶液作为“腐蚀液”腐蚀覆铜板。为了检验反应后所得混合溶液中还有Fe3+,可选择下列试剂中的
A.KSCN 溶液 B.酸性 KMnO4溶液 C.新制氯水
(4)高铁酸钠
 是一种新型绿色消毒剂,其一种制备原理如下: _______
是一种新型绿色消毒剂,其一种制备原理如下: _______ _______
_______ _______=_______
_______=_______ _______
_______ _______
_______
①请将方程式补充完整并配平该方程式
②氧化剂和还原剂个数之比为:
(5)干法制备高铁酸钾的主要反应为:
 。该反应中的还原剂是
。该反应中的还原剂是
您最近一年使用:0次
名校
解题方法
8 . 回答下列问题
(1)除去Na2CO3粉末中的NaHCO3固体,用化学方程式表示___________ ;
(2)除去MgO中混有的Al2O3,用离子方程式表示___________ ;
(3)除去FeCl3溶液中的FeCl2,用离子方程式表示___________ 。
(1)除去Na2CO3粉末中的NaHCO3固体,用化学方程式表示
(2)除去MgO中混有的Al2O3,用离子方程式表示
(3)除去FeCl3溶液中的FeCl2,用离子方程式表示
您最近一年使用:0次
名校
9 . 现有八种物质: ①铁粉 ②NH3 ③稀盐酸 ④熔融FeCl3 ⑤CH4 ⑥CaCO3固体 ⑦CuSO4溶液 ⑧Fe3O4。
(1)①-⑥属于电解质的是_______ 。
(2)写出③与⑧反应的离子方程式_______ 。将③与⑧反应后的溶液和⑦混合,再加入过量的①,反应结束后,一定没有的阳离子为_________ 。
(3)标准状况下,4.8g⑤中所含氢原子数与______ molH2O所含氢原子数相等。
(4)标准状况下,将22.4L②溶于83mL水中形成溶液的密度为0.88g/cm3,该氨水溶质的物质的量浓度为______ mol/L ,溶质的质量分数为_______ 。
(1)①-⑥属于电解质的是
(2)写出③与⑧反应的离子方程式
(3)标准状况下,4.8g⑤中所含氢原子数与
(4)标准状况下,将22.4L②溶于83mL水中形成溶液的密度为0.88g/cm3,该氨水溶质的物质的量浓度为
您最近一年使用:0次
名校
10 . 现有下列物质:① ②
② 溶液 ③
溶液 ③ 固体 ④
固体 ④ ⑤饱和
⑤饱和 溶液 ⑥
溶液 ⑥ ⑦熔融
⑦熔融 ,回答下列问题:
,回答下列问题:
(1)上述物质中,属于电解质的是_______ 。
(2)熔融 的电离方程式为
的电离方程式为_______ 。
(3)①与②反应的化学方程式为_______ 。
(4)碳酸钠可用于海水提溴,涉及的反应为: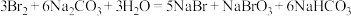 。
。
ⅰ)该反应的离子方程式为_______ 。
ⅱ)当 参与反应时,转移电子的物质的量为
参与反应时,转移电子的物质的量为_______ 。
(5)④⑤⑥是侯氏制碱的原料,三者反应的化学方程式为_______ 。
 ②
② 溶液 ③
溶液 ③ 固体 ④
固体 ④ ⑤饱和
⑤饱和 溶液 ⑥
溶液 ⑥ ⑦熔融
⑦熔融 ,回答下列问题:
,回答下列问题:(1)上述物质中,属于电解质的是
(2)熔融
 的电离方程式为
的电离方程式为(3)①与②反应的化学方程式为
(4)碳酸钠可用于海水提溴,涉及的反应为:
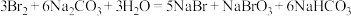 。
。ⅰ)该反应的离子方程式为
ⅱ)当
 参与反应时,转移电子的物质的量为
参与反应时,转移电子的物质的量为(5)④⑤⑥是侯氏制碱的原料,三者反应的化学方程式为
您最近一年使用:0次
2024-01-19更新
|
57次组卷
|
2卷引用:海南省琼海市嘉积中学2023-2024学年高一上学期第三次月考化学科试题



