14-15高三上·辽宁沈阳·期末
名校
解题方法
1 . 为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,其中实验方案设计不合理的是

| A.④ | B.③ |
| C.③④ | D.①②③④⑤ |
您最近一年使用:0次
2023-08-16更新
|
942次组卷
|
43卷引用:新疆乌鲁木齐市第四中学2021-2022学年高一上学期期末考试化学试题
新疆乌鲁木齐市第四中学2021-2022学年高一上学期期末考试化学试题(已下线)第12讲 铁、亚铁盐和铁盐-【暑假自学课】2022年新高一化学暑假精品课(鲁科版2019必修第一册)(已下线)第三章 铁 金属材料(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)2014-2015天津市和平区高一上学期期末考试化学试卷2016-2017学年河北石家庄辛集中学高一上阶段考二化学卷河北省辛集中学2017-2018学年高一上学期12月月考化学试题河南省商丘市第一高级中学2017-2018学年高一上学期第二次月考化学试题【全国百强校】河北省石家庄市辛集中学2018-2019学年高一上学期第二次月考化学试题内蒙古自治区翁牛特旗乌丹第一中学2018-2019学年高一上学期期中考试化学试题山东省莒县第一中学2018-2019学年高一上学期12月月考化学试题西藏自治区拉萨市那曲第二高级中学2019-2020学年高一上学期期末考试化学试题河北省张家口市宣化区第一中学2019-2020学年高一3月月考化学试题江西省临川第一中学2019-2020学年高一上学期12月月考化学试题人教版(2019)高一必修第一册 第三章 第一节 铁及其化合物鲁科版(2019)高一必修第一册第3章 物质的性质与转化 第1节 铁的多样性人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物(已下线)第三章 铁 金属材料(能力提升)-2020-2021学年高一化学单元测试定心卷(人教版2019必修第一册)(已下线)3.2.3 铁的重要化合物(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版)(已下线)3.1.2 铁的重要化合物(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)(已下线)3.1.2 铁盐和亚铁盐-2021-2022学年高一化学课后培优练(人教版2019必修第一册)吉林省长春外国语学校2021-2022学年高一上学期第二次月考化学试题(已下线)易错专题23 Fe2+和Fe3+的检验与转化-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)河北省辛集市第一中学2021-2022学年高一上学期第四次月考化学试题宁夏石嘴山市第三中学2021-2022学年高一上学期期末考试化学试题第2课时 铁盐和亚铁盐第1课时 亚铁盐和铁盐安徽省合肥市第三中学2023-2024学年高一上学期12月份学情调研化学试题(已下线)2014届辽宁省新民市第一高级中学高三上学期期末考试化学试卷(已下线)2015届宁夏银川市唐徕回民中学高三上学期期中考试化学试卷黑龙江省大庆第一中学2017-2018学年高一上学期期末考试化学试题广西陆川县中学2017-2018学年高一上学期期末考试化学试题吉林省柳河中学2017-2018学年高一上学期期末考试化学试题【校级联考】天津市静海区2019届高三上学期三校联考化学试题北京首都师范大学第二附属中学2021届高三9月月考化学试题云南省普洱市景东彝族自治县第一中学2020-2021学年高一上学期月考化学试题江西省会昌中学2020-2021学年高一上学期第二次月考化学试题江西省新余市第四中学2020-2021学年高一上学期第二次段考化学试题云南省文山州砚山县第三高级中学2020-2021学年高一12月月考化学试题上海市控江中学2021-2022学年高二上学期第一次月考化学试卷云南省大理市黄冈实验中学2021-2022学年高一上学期12月月考化学试题天津北京师范大学静海附属学校 (天津市静海区北师大实验学校)2023-2024学年高三上学期第二次阶段检测(期中)化学试题2015-2016学年福建省龙海二中高二下学期期末化学试卷2017届吉林省汪清六中高三上第二次月考化学试卷
2019高三·全国·专题练习
名校
解题方法
2 . 已知硝酸能将Fe2+氧化为Fe3+。某同学对未知物A盐的水溶液进行了鉴定,实验过程及现象如图所示:

| A.盐A一定是FeCl3 |
| B.白色沉淀B是AgCl |
| C.滤液C中一定含Fe3+ |
| D.无法确定A中是否含有Fe2+ |
您最近一年使用:0次
2023-07-20更新
|
926次组卷
|
9卷引用:第三章 铁 金属材料(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)
(已下线)第三章 铁 金属材料(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)(已下线)第三章 章末检测(1)——《高中新教材同步备课》(人教版 必修第一册)安徽省池州市第一中学2020-2021学年高一12月月考化学试题山西省沁县中学2020-2021学年高一上学期第二次月考化学试题江西省新建一中2020-2021学年高一下学期开学考试化学试题作业(十七) 亚铁盐和铁盐陕西省商洛市商州区高级中学2023-2024学年高一下学期3月月考化学试题(已下线)【走进新高考】(人教版必修一)3.2.2几种重要的金属化合物——铁的重要化合物 同步练习02(已下线)考点10 铁及其重要化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
3 . 为检验某溶液中是否含有 ,可以选择的试剂是
,可以选择的试剂是
 ,可以选择的试剂是
,可以选择的试剂是| A.KSCN溶液 | B. 溶液 溶液 | C.酸性 溶液 溶液 | D. 溶液 溶液 |
您最近一年使用:0次
2023-05-27更新
|
512次组卷
|
15卷引用:广东省汕尾市2021-2022学年高一上学期末教学质量监测化学试题
广东省汕尾市2021-2022学年高一上学期末教学质量监测化学试题湖南省娄底市新化县2021-2022学年高一上学期期末考试化学试题(已下线)3.1.2 铁盐和亚铁盐-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)新疆叶城县第八中学2021-2022学年高一上学期期末考试化学试题山东省临沂市2018-2019学年学业水平考试预测试题(一)新疆乌苏市第一中学2021-2022学年高一下学期开学考试化学(B)试题2023年湖南省娄底市高一学业水平考试模拟化学试题(已下线)专题六 物质的电离与离子反应(已下线)专题二 物质的检验、除杂和鉴别河北省武邑中学2019-2020学年高二12月月考化学试题湖南省邵阳市双清区十一中2019-2020学年高一12月月考化学试题北京市新学道临川学校2021届高三上学期第一次月考化学试题湖南省张家界市2020-2021学年高一上学期期末考试化学试题湖南省茶陵县第三中学2018-2019学年高二下学期第一次月考化学试题湖南省株洲市茶陵县第三中学2019-2020学年高二上学期12月月考化学试题(学考)
9-10高二下·山东潍坊·期末
名校
解题方法
4 . 要证明某溶液中不含Fe3+,而可能含有Fe2+,进行如下实验操作的最佳顺序为
①加入足量氯水②加入足量KMnO4(H+)溶液③加入少量KSCN溶液
①加入足量氯水②加入足量KMnO4(H+)溶液③加入少量KSCN溶液
| A.①③ | B.③① | C.①②③ | D.③②① |
您最近一年使用:0次
2023-01-09更新
|
371次组卷
|
113卷引用:黑龙江省牡丹江市第三高级中学2021-2022学年高一上学期期末考试化学试题
黑龙江省牡丹江市第三高级中学2021-2022学年高一上学期期末考试化学试题黑龙江省牡丹江市第三高级中学2021-2022学年高一下学期开学考试化学试题第三章 铁金属材料 本章复习提升黑龙江省嫩江市第一中学2021-2022学年高一下学期开学考试化学试题四川省凉山州宁南中学2022-2023学年高一上学期第二次月考化学试题(已下线)2011-2012学年江苏省泰州中学高三化学期中化学试卷(已下线)2011-2012学年黑龙江省庆安三中高一上学期期末考试化学试卷(已下线)2015河北保定某重点中学同步作业(必修1苏教版)3.2.2铜铁及其化合物2015-2016学年黑龙江省哈尔滨六中高一上期末化学试卷2015-2016学年河北省冀州中学高一下开学考试化学试卷2015-2016学年广东省清远市高一上学期期末考试化学试卷2015-2016学年黑龙江省海林林业局一中高一上学期期末化学试卷2015-2016学年辽宁省庄河高中高一下期末化学试卷河南省鹤壁市淇滨高级中学2017-2018学年高一上学期第三次月考化学试题河北省辛集中学2017-2018学年高一上学期第三次阶段考试化学试题人教版2017-2018学年高一化学必修1:3.2 几种重要的金属化合物 同步测试1【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高一上学期期末考试化学试题新疆疏勒县八一中学2018-2019学年高一上学期期末考试化学试题山东省德州市夏津县双语中学2019-2020学年高一12月月考化学试题四川省三台县芦溪中学2017—2018学年高一上学期第三次月考化学试题四川省绵阳市三台县芦溪中学2017-2018学年高一上学期第三次月考化学试题人教版高中化学必修一第三章《金属及其化合物》测试卷1山西省运城市盐湖五中2019-2020学年高一上学期期中考试化学试题(已下线)【南昌新东方】湾里一中2019-2020 高一(上)期末吉林省长春市九台区第四中学2019-2020高一上学期期末测试化学试题海南省海南枫叶国际学校2019-2020学年高一上学期期末考试化学试题辽宁省阜新市第二高级中学2019-2020学年高一下学期期末考试化学试题(已下线)3.1.2 铁及其化合物之间的转化关系练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)人教版(2019)高一必修第一册第三章 铁 金属材料 第一节 铁及其化合物 课时2 铁盐、亚铁盐鲁科版(2019)高一必修第一册第三章第1节 铁的多样性 课时1 亚铁盐和铁盐铁 铁的氧化物和铁的氢氧化物(已下线)第三章 铁 金属材料(能力提升)-2020-2021学年高一化学单元测试定心卷(人教版2019必修第一册)(已下线)3.1.2 铁的重要化合物-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)河北省石家庄市第二中学西校区2020-2021学年高一上学期12月月考化学试卷辽宁省阜新市第二高级中学2020-2021学年高一上学期期末考试化学试题(苏教版2019)必修第二册专题9 金属与人类文明 第二单元 探究铁及其化合物的转化(已下线)第07讲 铁及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)黑龙江省牡丹江市第三高级中学2022-2023学年高三上学期第一次月考化学试题甘肃省武威市古浪县第二中学2021-2022学年高一上学期期末考试化学试题辽宁省大石桥市第三高级中学2021-2022学年高一12月月考化学试题新疆阿克苏市实验中学2021-2022学年高一上学期期末考试化学(文)试题云南省大姚县第一中2021-2022学年高一下学期3月份考试化学试题新疆阿克苏市实验中学2021-2022学年高一上学期期末考试化学(理)试题吉林省永吉县第四中学2022-2023学年高一上学期期末考试化学试题第1课时 亚铁盐和铁盐四川省宜宾市兴文第二中学校2023-2024学年高一下学期开学化学试题(已下线)2010年江苏省泰兴市重点中学高三上学期第一次检测化学试题(已下线)2010年上海市吴淞中学高二上学期期中考试化学试卷(已下线)2010—2011年福建省厦门市杏南中学高一12月月考化学卷(已下线)2012届上海市松江二中高三上学期期中考试化学试卷(已下线)2011-2012学年上海市崇明中学高二上学期期中考试化学试卷(已下线)2011-2012学年内蒙古巴彦淖尔市中学高三期中考试化学试卷(已下线)2011-2012学年云南省玉溪一中高一下学期期中考试化学试卷(已下线)2013届辽宁朝阳柳城高级中学高三上学期第二次月考化学试卷(已下线)2014-2015学年福建省三明一中高一上学期期中化学试卷2015-2016学年河南省安阳三十六中高二6月月考化学试卷2015-2016学年山西晋城市高平市特立高级中学高二下期中理科化学卷2017届河北省故城县高级中学高三上学期期中化学试卷2016-2017学年福建省三明一中高一上期中化学卷2016-2017学年吉林省实验中学高一上学期期末化学试卷上海市金山中学2016-2017学年高二上学期期末等级考试化学试题宁夏银川市兴庆区2018届高三上学期第二次月考化学试题安徽省濉溪县临涣中学2017-2018学年高一上学期第二次月考化学试题湖北省长阳中学2017-2018学年高一化学上学期期末考试题山东省昌邑市第一中学2017-2018学年高一上学期第二次期末模拟考试化学试题湖南省石门县第一中学2016-2017学年高一下学期期末考试化学试题内蒙古阿拉善左旗高级中学2017-2018学年高二下学期期末考试化学试题(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第3讲 铁及其化合物【教学案】吉林省辽源市田家炳高级中学等五校2017-2018学年高一上学期期末联考(第64届)化学试题(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第3讲 铁及其化合物 (教学案)【全国百强校】云南省玉溪市第一中学2018-2019学年高一上学期第一次月考化学试题山东省泰安市宁阳一中2018-2019学年高一上学期阶段性考试二(12月)化学试题内蒙古开来中学2018-2019学年高二下学期期末考试化学试题黑龙江省牡丹江市第三高级中学2018-2019学年高二下学期期末考试化学试题(已下线)上海市华东师范大学第二附属中学2016-2017学年高二上学期期末考试化学试题上海市吴淞中学2017-2018学年高二上第一次月考化学试题上海市复旦中学2019-2020学年高二上学期第一次月考化学试题上海市上海交大附中2017-2018高二上期末化学题2019学年上海市奉贤区曙光中学高二化学上学期期中考试试卷福建省三明第一中学2019-2020学年高一上学期期中考试化学试题浙江省金华市东阳中学2019-2020学年高一上学期期中考试化学试题宁夏青铜峡市高级中学2019-2020学年高一上学期期末考试化学试题甘肃省武威第八中学2019—2020学年高一上学期期末考试化学试题上海市华东师大二附中2016-2017学年高二(上)期末化学试卷上海市青浦二中2016届高三上学期8月摸底考试化学试题(已下线)上海市建平中学2013届高三第一次模拟化学试题甘肃省武威市第十八中学2019-2020学年高一上学期期末考试化学试题上海南洋中学2019-2020学年高二上学期期中复习卷(沪科版)化学试题陕西省榆林市第十二中学2021届高三上学期第一次月考化学试题(已下线)【浙江新东方】71.陕西省榆林市子洲中学2021届高三上学期第一次月考化学试题(已下线)专题05 金属及其重要化合物-备战2021届高考化学二轮复习题型专练宁夏青铜峡市高级中学2020-2021学年高一上学期期末考试化学试题黑龙江省大庆市肇州县肇州中学2020-2021学年高一下学期第一次月考化学试题黑龙江省伊春市伊美区第二中学2020-2021学年高一上学期第三次月考化学试题新疆新源县第二中学2019-2020学年高一上学期期末考试化学试题福建省莆田第十五中学2018-2019学年高一下学期期中测试化学试题(已下线)微专题13 亚铁离子、三价铁离子的性质及检验-备战2022年高考化学考点微专题黑龙江省双鸭山市第一中学2020-2021学年高一第二次月考化学试题上海市向明中学2021-2022学年高二上学期期中考试化学试题上海市向明中学2021-2022学年高三上学期期中考试化学试题浙江省乐清市知临中学2021-2022学年高一上学期期中考试化学(B)试题新疆可克达拉市镇江高级中学2022-2023学年高一上学期期末考试化学试题黑龙江省富锦市第一中学2022-2023学年高一下学期第一次考试化学试题新疆昌吉州行知学校2022-2023学年高一下学期第一次月考化学试题新疆石河子第一中学2023-2024学年高一上学期11月月考化学试题(已下线)2010年潍坊市高二下学期新课程期末测试化学2016届江西省宜春市铜鼓中学高三二模化学试卷黑龙江省伊春市第二中学2017-2018学年高二下学期期末考试化学试题【全国校级联考】新疆维吾尔自治区昌吉市教育共同体2019届高三上学期9月月考化学试题云南省易门一中2019-2020学年高二开学考试化学试题广东省中山市中山纪念中学2020届高三第二次质量检测化学试题福建省莆田第二十五中学2021届高三上学期月考二化学试题广东省普宁二中实验学校2021-2022学年高三上学期第一次月考化学试题
21-22高一·全国·假期作业
解题方法
5 . 铁黄(FeOOH)是一种重要的化工产品,向一定浓度的FeSO4溶液中通入氨气,调节pH至6.0时,通入氧气,生成铁黄。以硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2以及其他难溶杂质)为原料制备FeOOH,其流程如图所示:
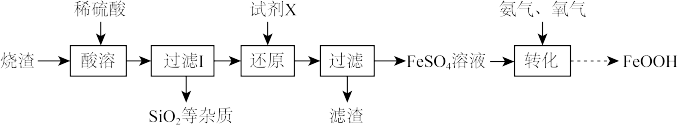
(1)FeOOH可表示为xFe2O3•yH2O,则x:y=_____ 。
(2)“酸溶”步骤中Fe2O3与酸反应的离子方程式为_____ 。
(3)“过滤I”后,滤液中所含金属阳离子有_____ (填离子符号)。
(4)“还原”时,试剂X若选用铁粉,则该反应的离子方程式为_____ 。
(5)“转化”过程中,氧化时应控制pH在合理的范围,pH过大会导致产品颜色变黑,则产品中可能含有的杂质是_____ (填化学式)。
(6)为测定制得的铁黄的纯度,进行如下实验:
①准确称取3.0g铁黄样品。
②加入50.0mL1mol•L-1的过量硫酸溶解(假设其他杂质不溶于酸)。
③加入草酸钠(Na2C2O4)完全沉淀Fe3+。
④用浓度为0.5mol•L-1、体积为20.0mL的NaOH溶液刚好中和剩余的硫酸。
铁黄与硫酸反应的化学方程式为_____ ,该铁黄样品的纯度为_____ 。

(1)FeOOH可表示为xFe2O3•yH2O,则x:y=
(2)“酸溶”步骤中Fe2O3与酸反应的离子方程式为
(3)“过滤I”后,滤液中所含金属阳离子有
(4)“还原”时,试剂X若选用铁粉,则该反应的离子方程式为
(5)“转化”过程中,氧化时应控制pH在合理的范围,pH过大会导致产品颜色变黑,则产品中可能含有的杂质是
(6)为测定制得的铁黄的纯度,进行如下实验:
①准确称取3.0g铁黄样品。
②加入50.0mL1mol•L-1的过量硫酸溶解(假设其他杂质不溶于酸)。
③加入草酸钠(Na2C2O4)完全沉淀Fe3+。
④用浓度为0.5mol•L-1、体积为20.0mL的NaOH溶液刚好中和剩余的硫酸。
铁黄与硫酸反应的化学方程式为
您最近一年使用:0次
21-22高一·全国·假期作业
名校
解题方法
6 . 在下列各溶液中,离子一定能大量共存的是
A.与铝反应放出 的溶液: 的溶液: 、 、 、 、 、 、 、 、 |
B.含有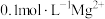 的溶液中: 的溶液中: 、 、 、 、 、 、 |
C.含有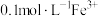 的溶液中: 的溶液中: 、 、 、 、 、 、 |
D.室温下,强酸性溶液中: 、 、 、 、 、 、 |
您最近一年使用:0次
21-22高一·全国·假期作业
名校
解题方法
7 . 下列各组离子在给定条件下一定能大量共存的是
A.澄清透明溶液:Cu2+、 、Cl-、 、Cl-、 |
B.含有大量 的溶液:H+、Fe2+、Cl-、 的溶液:H+、Fe2+、Cl-、 |
| C.红色溶液:Fe3+、K+、Cl-、SCN- |
D.与铝反应生成氢气的溶液:Mg2+、 、Na+、 、Na+、 |
您最近一年使用:0次
22-23高一上·全国·课时练习
8 . 混合物的除杂
| 混合物(括号内为杂质) | 除杂方法及试剂 |
| Fe2+(Fe3+) | ① |
| FeCl3溶液(FeCl2溶液) | ② |
| Fe2+(Cu2+) | ③ |
| Fe(Al) | ④ |
| Fe2O3(Al 2O3) | ⑤ |
您最近一年使用:0次
22-23高一上·全国·课后作业
9 . 二价铁(Fe3+)的性质
(1)化合价:+3价,处于_______ 价态。
(2)性质预测:只有_______ 。
(3)与还原剂的反应

①与Cu反应:_______ 。
②与Fe反应:_______ 。
(1)化合价:+3价,处于
(2)性质预测:只有
(3)与还原剂的反应

①与Cu反应:
②与Fe反应:
您最近一年使用:0次
22-23高一上·全国·阶段练习
名校
10 . 铁是人体必需的微量元素,严重缺铁时需要服用补铁剂。实验小组为研究某补铁剂中铁元素的价态及其含量,设计并进行了如下实验:
【查阅资料】Ⅰ.该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。
Ⅱ.KSCN中的硫元素为-2价。
Ⅲ.Fe(OH)3受热分解生成Fe2O3。
实验Ⅰ.检验该补铁剂中铁元素的价态。
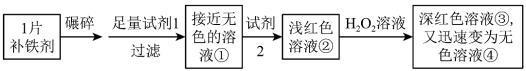
将补铁剂碾碎的目的是增大接触面积,使其充分溶解。
(1)试剂1是_______ ,试剂2是_______ 。
(2)加入试剂2后溶液变为浅红色,说明溶液①中含有_______ 。
(3)能证明溶液①中含有Fe2+的实验现象是_______ 。
(4)补全在上述条件下Fe2+与H2O2发生反应的离子方程式:_______ 。
_______H++_______Fe2++_______H2O2=_______ _______+_______ _______
(5)甲同学猜测深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的SCN-与H2O2发生了化学反应。
a.甲同学猜测的依据是_______ 。
b.乙同学通过实验证实了甲同学的猜测,其实验方案及现象是_______ 。
实验Ⅱ.测定该补铁剂中铁元素的含量。

(6)计算每片该补铁剂含铁元素的质量为_______ g。
(7)人体只能吸收Fe2+,医生建议在服用该补铁剂时,同时服用有较强还原性的维生素C,理由是_______ 。
【查阅资料】Ⅰ.该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。
Ⅱ.KSCN中的硫元素为-2价。
Ⅲ.Fe(OH)3受热分解生成Fe2O3。
实验Ⅰ.检验该补铁剂中铁元素的价态。

将补铁剂碾碎的目的是增大接触面积,使其充分溶解。
(1)试剂1是
(2)加入试剂2后溶液变为浅红色,说明溶液①中含有
(3)能证明溶液①中含有Fe2+的实验现象是
(4)补全在上述条件下Fe2+与H2O2发生反应的离子方程式:
_______H++_______Fe2++_______H2O2=_______ _______+_______ _______
(5)甲同学猜测深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的SCN-与H2O2发生了化学反应。
a.甲同学猜测的依据是
b.乙同学通过实验证实了甲同学的猜测,其实验方案及现象是
实验Ⅱ.测定该补铁剂中铁元素的含量。

(6)计算每片该补铁剂含铁元素的质量为
(7)人体只能吸收Fe2+,医生建议在服用该补铁剂时,同时服用有较强还原性的维生素C,理由是
您最近一年使用:0次
2022-11-01更新
|
603次组卷
|
3卷引用:第二次月考测评卷-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)
(已下线)第二次月考测评卷-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)北京市海淀区第二十中学2022-2023学年高一上学期11月月考化学试题章末检测卷(三) 铁 金属材料



