名校
解题方法
1 . 铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是_______ nm。
(2)在实验室中,FeCl3可以用铁粉与_______ 反应制备,保存FeCl2溶液会加入少量铁屑,其原理是_______ (用化学方程式表示)。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_______ 。某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①甲同学取少量待测溶液﹐滴入_______ (写出试剂名称),溶液呈红色,证明溶液中含有Fe3+。
②乙同学取少量待测溶液﹐滴加酸性高锰酸钾溶液,振荡后紫红色褪去,因此他得出结论,溶液中存在Fe2+。丙同学认为乙同学的实验方法不严谨,理由是_______ 。(用离子方程式和必要的文字进行解释)已知:氧化性KMnO4>Cl2
③通过查阅资料,同学们得知,Fe2+能与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀。乙同学另取少量待测溶液﹐滴加K3[Fe(CN)6)]溶液,有蓝色沉淀生成,证明溶液中存在Fe2+。该反应的离子方程式为_______ 。
(4)欲从FeCl3腐蚀铜后所得溶液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
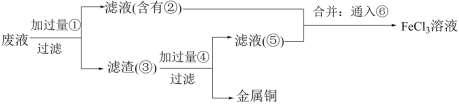
已知⑥为黄绿色的气体单质,请写出通入⑥的离子方程式:_______ 。用H2O2代替⑥也能实现实验目的。请写出加入H2O2的离子方程式:_______ 。
(1)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是
(2)在实验室中,FeCl3可以用铁粉与
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
①甲同学取少量待测溶液﹐滴入
②乙同学取少量待测溶液﹐滴加酸性高锰酸钾溶液,振荡后紫红色褪去,因此他得出结论,溶液中存在Fe2+。丙同学认为乙同学的实验方法不严谨,理由是
③通过查阅资料,同学们得知,Fe2+能与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀。乙同学另取少量待测溶液﹐滴加K3[Fe(CN)6)]溶液,有蓝色沉淀生成,证明溶液中存在Fe2+。该反应的离子方程式为
(4)欲从FeCl3腐蚀铜后所得溶液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
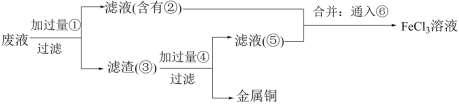
已知⑥为黄绿色的气体单质,请写出通入⑥的离子方程式:
您最近一年使用:0次
2022-04-05更新
|
408次组卷
|
2卷引用:四川省成都市龙泉驿区教育科学研究院2021-2022学年高二下学期期中考试化学试卷
名校
解题方法
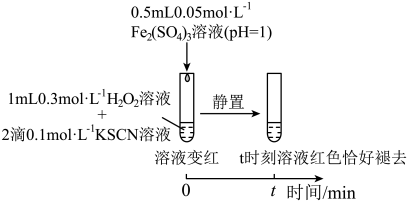
2 . 某小组在验证H2O2氧化Fe2+时发现异常现象,并对其进行深入探究。
实验I:
(1)实验I中溶液变红是因为Fe3+与SCN-发生了反应,其离子方程式是__ 。
(2)探究实验I中红色褪去的原因:取反应后溶液,___ (填实验操作和现象),证明溶液中有Fe3+,而几乎无SCN-。
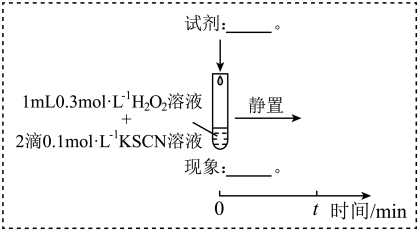
(3)研究发现,酸性溶液中H2O2能氧化SCN-,但反应很慢且无明显现象,而实验I中褪色相对较快,由此推测Fe3+能加快H2O2与SCN-的反应。通过实验II和III得到了证实。参照实验II的图例,在虚线框内补全实验III:__ 。
实验II:
实验III:
(4)查阅资料:Fe3+加快H2O2与SCN-反应的主要机理有
i.Fe3++H2O2=Fe2++HO2·+H+
ii.Fe2++H2O2=Fe3++·OH+OH-
iii.OH(羟基自由基)具有强氧化性,能直接氧化SCN-
为探究Fe2+对H2O2与SCN-反应速率的影响,设计实验如图:
实验IV:

①t′<t,对比实验IV和II可得出结论:在本实验条件下,___ 。
②结合资料和(1)~(4)的研究过程,从反应速率和化学平衡的角度解释实验I中溶液先变红后褪色的原因:____ 。
③实验I~IV中均有O2生成,小组同学推测可能是HO2·与溶液中其他微粒相互作用生成的,这些微粒有___ 。
实验I:
| 装置与操作 | 现象 |
 | 溶液立即变红,继续滴加H2O2溶液,红色变浅并逐渐褪去 |
(2)探究实验I中红色褪去的原因:取反应后溶液,
(3)研究发现,酸性溶液中H2O2能氧化SCN-,但反应很慢且无明显现象,而实验I中褪色相对较快,由此推测Fe3+能加快H2O2与SCN-的反应。通过实验II和III得到了证实。参照实验II的图例,在虚线框内补全实验III:
实验II:

实验III:

(4)查阅资料:Fe3+加快H2O2与SCN-反应的主要机理有
i.Fe3++H2O2=Fe2++HO2·+H+
ii.Fe2++H2O2=Fe3++·OH+OH-
iii.OH(羟基自由基)具有强氧化性,能直接氧化SCN-
为探究Fe2+对H2O2与SCN-反应速率的影响,设计实验如图:
实验IV:

①t′<t,对比实验IV和II可得出结论:在本实验条件下,
②结合资料和(1)~(4)的研究过程,从反应速率和化学平衡的角度解释实验I中溶液先变红后褪色的原因:
③实验I~IV中均有O2生成,小组同学推测可能是HO2·与溶液中其他微粒相互作用生成的,这些微粒有
您最近一年使用:0次
2021-08-13更新
|
638次组卷
|
7卷引用:北京市铁路第二中学2022-2023学年高二上学期期中检测化学试题
名校
3 . 某小组同学对FeCl3与KI的反应进行探究。
【初步探究】室温下进行下表所列实验。
(1)证明实验Ⅰ中有I2生成,加入的试剂为_______ 。
(2)实验Ⅱ可以证明Fe3+与I-发生可逆反应,其操作为_______ 。
(3)写出实验Ⅰ反应的离子方程式:_______ 。
(4)实验Ⅰ中溶液的颜色不变后再进行后续实验,其目的是_______ 。
【深入探究】20min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(5)已知在酸性较强的条件下,I-可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I-氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:_______ ,20 min内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素 可能是_______ (写出1条即可)。
(6)乙同学查阅资料可知:FeCl3与KI的反应体系中还存在I-+I2 I
I ,I
,I 呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:
呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:_______ 。
【初步探究】室温下进行下表所列实验。
| 序号 | 操作 | 现象 |
| 实验Ⅰ | 取5 mL0.1 mol·L-1KI溶液,滴加0.1 mol·L-1FeCl3溶液5~6滴(混合溶液pH=5) | 溶液变为棕黄色 |
| 实验Ⅱ | _______ | 溶液变红 |
(2)实验Ⅱ可以证明Fe3+与I-发生可逆反应,其操作为
(3)写出实验Ⅰ反应的离子方程式:
(4)实验Ⅰ中溶液的颜色不变后再进行后续实验,其目的是
【深入探究】20min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(5)已知在酸性较强的条件下,I-可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I-氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:
(6)乙同学查阅资料可知:FeCl3与KI的反应体系中还存在I-+I2
 I
I ,I
,I 呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:
呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:
您最近一年使用:0次
2022-10-22更新
|
212次组卷
|
3卷引用:北京市顺义牛栏山第一中学2022-2023学年高二上学期10月月考化学试题
名校
解题方法
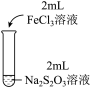
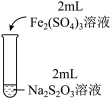
4 . 某实验小组对Na2S2O3分别与FeCl3、Fe2(SO4)3的反应进行实验探究。
实验药品:0.1mol/LNa2S2O3溶液(pH=7);0.1mol/LFeCl3溶液(pH=1);0.05mol/LFe2(SO4)3溶液(pH=1)。
实验过程
资料:ⅰ.Na2S2O3在酸性条件下不稳定,发生自身氧化还原反应;
ⅱ.Fe3++ ⇌Fe(S2O3)+(暗紫色),Fe2+遇
⇌Fe(S2O3)+(暗紫色),Fe2+遇 无明显现象
无明显现象
(1)配制FeCl3溶液时,需要用盐酸酸化,结合离子方程式解释原因:_______ 。
(2)对实验Ⅰ中现象产生的原因探究如下:
①证明有Fe2+生成:取实验Ⅰ中褪色后溶液,加入1~2滴K3[Fe(CN)6]溶液,观察到_______ 。
②实验I中紫色褪去时 被氧化成
被氧化成 ,相关反应的离子方程式是
,相关反应的离子方程式是_______ 。
③实验I和Ⅱ对比,Ⅰ中出现淡黄色浑浊,而Ⅱ中不出现淡黄色浑浊的原因是_______ 。
(3)为探究实验Ⅱ和Ⅲ中紫色褪去快慢不同的原因,设计实验如下:
①试剂X是_______ 。
②由实验Ⅳ和实验Ⅴ得出的结论是_______ 。
实验药品:0.1mol/LNa2S2O3溶液(pH=7);0.1mol/LFeCl3溶液(pH=1);0.05mol/LFe2(SO4)3溶液(pH=1)。
实验过程
| 实验编号 | Ⅰ | Ⅱ | Ⅲ |
| 实验操作 |
|
|
|
| 实验现象 | 溶液呈紫色, 静置后紫色迅速褪去, 久置后出现淡黄色浑浊 | 溶液呈紫色, 静置后紫色褪去, 久置后不出现淡黄色浑浊 | 溶液呈紫色, 静置后紫色缓慢褪去, 久置后不出现淡黄色浑浊 |
ⅱ.Fe3++
 ⇌Fe(S2O3)+(暗紫色),Fe2+遇
⇌Fe(S2O3)+(暗紫色),Fe2+遇 无明显现象
无明显现象(1)配制FeCl3溶液时,需要用盐酸酸化,结合离子方程式解释原因:
(2)对实验Ⅰ中现象产生的原因探究如下:
①证明有Fe2+生成:取实验Ⅰ中褪色后溶液,加入1~2滴K3[Fe(CN)6]溶液,观察到
②实验I中紫色褪去时
 被氧化成
被氧化成 ,相关反应的离子方程式是
,相关反应的离子方程式是③实验I和Ⅱ对比,Ⅰ中出现淡黄色浑浊,而Ⅱ中不出现淡黄色浑浊的原因是
(3)为探究实验Ⅱ和Ⅲ中紫色褪去快慢不同的原因,设计实验如下:
| 实验编号 | Ⅳ | Ⅴ |
| 实验操作 | 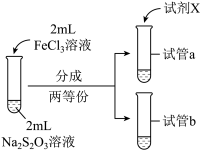 |  |
| 实验现象 | 紫色褪去时间a>b | 紫色褪去时间c<d |
②由实验Ⅳ和实验Ⅴ得出的结论是
您最近一年使用:0次
2021-01-20更新
|
1043次组卷
|
7卷引用:北京市清华大学附属中学2022-2023学年高二上学期期末化学试题
北京市清华大学附属中学2022-2023学年高二上学期期末化学试题北京市东城区2021届高三上学期期末教学统一检测化学试题(已下线)大题04 无机定量与探究实验-【考前抓大题】备战2021年高考化学(全国通用)(已下线)解密07 非金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密07 非金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练辽宁省葫芦岛市2021届高考第一次模拟考试化学试题北京理工大学附属中学2023-2024学年高三上学期10月月考化学试题
名校
解题方法
5 . 铁及其化合物在人类生产生活中发挥着重要作用。其中,K2FeO4为紫色固体,微溶于KOH浓溶液;在碱性溶液中较稳定;具有强氧化性,是一种多功能饮用水处理剂;在碱性条件下,可由NaClO氧化Fe(NO3)3制备。硫酸亚铁按(NH4)2Fe(SO4)2]常用于滴定测量。下列关于铁及其化合物的性质与用途具有对应关系的是
| A.Fe2O3属于碱性氧化物,可用作颜料 |
| B.常温下Fe遇浓硫酸钝化,可用铁制槽罐车运输浓硫酸 |
| C.FeCl3溶液显酸性,可用于蚀刻铜质印刷电路板 |
| D.K2FeO4溶液具有吸附性,可用于饮用水的消毒杀菌 |
您最近一年使用:0次
2022-01-23更新
|
262次组卷
|
3卷引用:江苏省海安市2021-2022学年高二上学期学业质量检测化学试题
名校
解题方法
6 . 高中常用“价类二维”思路研究物质的性质,右下图是铁及其化合物的二维图的部分信息。

(1)X的化学式为______ 。
图中物质只具有还原性的是______ 。(写化学式)
(2)将 溶液转化为
溶液转化为 的试剂可选
的试剂可选______ 。
a.稀硫酸 b. 溶液 c.酸性
溶液 c.酸性 d.溴水
d.溴水
(3)某中学实验小组设计如下实验探究亚铁盐的性质。
①实验Ⅰ中由白色沉淀生成红褐色沉淀的化学方程式__________________ 。
②对实验Ⅱ所得白色沉淀展开研究:
查阅资料:在溶液中不存在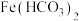
i.取Ⅱ中少量白色沉淀,充分洗涤,向其中加入稀硫酸,沉淀完全溶解,产生无色气泡;
ii.向i所得溶液中滴入KSCN试剂,溶液几乎不变红;
iii.向ii溶液中再滴入少量氯水,溶液立即变为红色。
根据以上现象,实验Ⅱ中生成的白色沉淀的化学式为__________________ 。
(4) 可用作补铁剂,使用时医生建议与维生素C同服,同学甲猜测维生素C可将
可用作补铁剂,使用时医生建议与维生素C同服,同学甲猜测维生素C可将 转化为
转化为 以利于人体吸收。为了验证这一猜想,设计如下实验:
以利于人体吸收。为了验证这一猜想,设计如下实验:
由上述实验能否得出维生素C可将 转化为
转化为 为的结论?
为的结论?_______ (填“能”或“否”),请说明理由:_____________________ 。

(1)X的化学式为
图中物质只具有还原性的是
(2)将
 溶液转化为
溶液转化为 的试剂可选
的试剂可选a.稀硫酸 b.
 溶液 c.酸性
溶液 c.酸性 d.溴水
d.溴水(3)某中学实验小组设计如下实验探究亚铁盐的性质。
实验方案 | 现象 | |
Ⅰ | 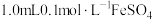 溶液中滴加1.0mL0.5 mol∙L−1 NaOH溶液 溶液中滴加1.0mL0.5 mol∙L−1 NaOH溶液 | 生成白色沉淀,后沉淀基本变为红褐色 |
Ⅱ | 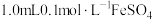 溶液中滴加1.0mL0.5 mol∙L−1 溶液中滴加1.0mL0.5 mol∙L−1 溶液 溶液 | 生成白色沉淀,后沉淀颜色几乎不变 |
②对实验Ⅱ所得白色沉淀展开研究:
查阅资料:在溶液中不存在
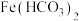
i.取Ⅱ中少量白色沉淀,充分洗涤,向其中加入稀硫酸,沉淀完全溶解,产生无色气泡;
ii.向i所得溶液中滴入KSCN试剂,溶液几乎不变红;
iii.向ii溶液中再滴入少量氯水,溶液立即变为红色。
根据以上现象,实验Ⅱ中生成的白色沉淀的化学式为
(4)
 可用作补铁剂,使用时医生建议与维生素C同服,同学甲猜测维生素C可将
可用作补铁剂,使用时医生建议与维生素C同服,同学甲猜测维生素C可将 转化为
转化为 以利于人体吸收。为了验证这一猜想,设计如下实验:
以利于人体吸收。为了验证这一猜想,设计如下实验:实验方案 | 实验现象 |
取适量 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液。 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液。 | 溶液紫红色褪去 |
 转化为
转化为 为的结论?
为的结论?
您最近一年使用:0次
2022-09-06更新
|
608次组卷
|
4卷引用:上海市敬业中学2022-2023学年高二上学期10月月考(等级考)化学试题
上海市敬业中学2022-2023学年高二上学期10月月考(等级考)化学试题天津市河西区2021-2022学年高一上学期期末质量调查化学试题天津市河西区微山路中学2022-2023学年高一上学期期末考试化学试题(已下线)专题07 铁及其化合物 金属材料-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(天津专用)
7 . 某研究小组查阅资料发现Fe3+与I-的反应具有可逆性,推测亚铁盐与饱和碘水的混合液中会存在Fe3+,并据此设计实验1(如下图所示),发现溶液未变红。该小组对溶液未变红的原因进行了如下探究。
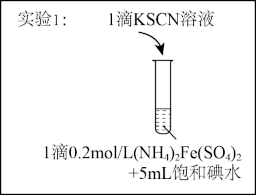
I.初步探究
实验2:用煮沸冷却后的蒸馏水重新配制两种饱和溶液进行实验,实验记录如下表。
(1)研究小组同学根据所查阅资料写出的Fe3+与I-反应的离子方程式为____ 。
(2)实验2中,加入石蜡油的目的是____ 。
(3)小组同学做出推断:反应速率不是导致实验1中溶液未变红的主要原因,他们的理由是___ 。
II.查阅资料,继续探究
【资料】AgSCN为不溶于水的白色固体。
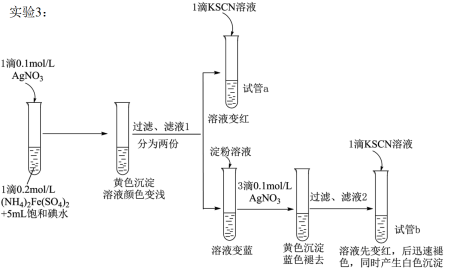
(4)试管a的实验现象说明滤液l中含有____ 。
(5)试管b中,加入KSCN溶液后所产生实验现象的原因是___ 。
(6)甲同学对实验3提出了质疑,认为其实验现象并不能证明I2氧化了Fe2+。他提出如下假设:i.可能是AgNO3氧化了Fe2+;ii.可能是空气中的O2氧化了Fe2+。 他设计、实施了实验4,实验记录如下表。
①试剂a是 ___ 。
②依据实验4,甲同学做出判断:______________________
(7)根据实验1~4所得结论是____ 。

I.初步探究
实验2:用煮沸冷却后的蒸馏水重新配制两种饱和溶液进行实验,实验记录如下表。
| 编号 | 饱 和 (NH4)2Fe(SO4)2溶液 | 饱和碘水 | 石蜡油 | 操作 | KSCN溶液 | 现象 |
| 2-1 | 1滴 | 5mL | 1mL | 不加热 | 1滴 | 无明显现象 |
| 2-2 | 1滴 | 5mL | 1mL | 加热一段时间后冷却 | 1滴 | 无明显现象 |
(2)实验2中,加入石蜡油的目的是
(3)小组同学做出推断:反应速率不是导致实验1中溶液未变红的主要原因,他们的理由是
II.查阅资料,继续探究
【资料】AgSCN为不溶于水的白色固体。

(4)试管a的实验现象说明滤液l中含有
(5)试管b中,加入KSCN溶液后所产生实验现象的原因是
(6)甲同学对实验3提出了质疑,认为其实验现象并不能证明I2氧化了Fe2+。他提出如下假设:i.可能是AgNO3氧化了Fe2+;ii.可能是空气中的O2氧化了Fe2+。 他设计、实施了实验4,实验记录如下表。
| 编号 | 实验操作 | 实验现象 |
4 | 在试管中加入1滴0.2mol/L(NH4)2Fe(SO4)2溶液,5mL蒸馏水,1滴试剂a,一段时间后加入1滴KSCN溶液 | 溶液不变红 |
②依据实验4,甲同学做出判断:
(7)根据实验1~4所得结论是
您最近一年使用:0次
2020-05-09更新
|
916次组卷
|
5卷引用:北京市第十一中学2022-2023学年高二上学期期中考试化学试卷
22-23高二上·浙江·期中
8 . 下列有关物质的性质与用途具有对应关系的是
| A.钠单质密度较小,可用于冶炼金属钛 |
| B.氯化亚铁有还原性,可作为“腐蚀液”制作印刷电路板 |
| C.漂白粉有强氧化性,可用作游泳池等场所的消毒剂 |
| D.氢氧化铁胶体吸附性强,可用于杀菌净水 |
您最近一年使用:0次
解题方法
9 . 下列有关铁及其化合物的说法错误的是
A. 是一种黄色粉末 是一种黄色粉末 | B. 既有氧化性又有还原性 既有氧化性又有还原性 |
C.可用KSCN溶液检验溶液中的 | D.可用Fe除去 溶液中含有的 溶液中含有的 |
您最近一年使用:0次
2023-06-05更新
|
388次组卷
|
2卷引用:山东省普通高中2021-2022学年高二下学期学业水平合格性考试化学试题
21-22高一·全国·课时练习
解题方法
10 . 下列说法正确的是
| A.Fe2+既有氧化性又有还原性 |
| B.因为Fe比Cu活泼,所以FeCl3不能与Cu反应 |
| C.FeCl2溶液与氯水反应的离子方程式为:Fe2++Cl2=Fe3++2Cl- |
| D.向溶液加入氯水,再加入KSCN溶液,溶液变血红色,说明该溶液中含有Fe2+ |
您最近一年使用:0次